
- •Учебно-методический комплекс дисциплины «физическая химия» для студентов всех форм обучения
- •Содержание
- •1. Цели освоения учебной дисциплины
- •2. Место учебной дисциплины в структуре ооп университета
- •2.1. Из курса «Химия»
- •2.2. Из курса «Физика»
- •2.3.Из курса «Математика»
- •3. Компетенции студента, формируемые в результате освоения дисциплины
- •По окончании изучения курса студент должен:
- •4. Структура дисциплины Объем дисциплины и виды учебной работы
- •Содержание и тематическое планирование дисциплины
- •5. Образовательные технологии
- •6. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины и учебно-методическое обеспечение самостоятельной работы студентов
- •6.1.Задания и методические указания для выполнения контрольной работы
- •6.1.1. Теоретические сведения
- •1. Первый закон термодинамики для химических процессов
- •Изохорический и изобарический тепловые эффекты
- •Связь между изобарическим и изохорическим тепловыми эффектами
- •Термохимическое уравнение
- •Стандартное состояние
- •Теплота образования химического соединения
- •Расчет стандартного теплового эффекта (стандартной энтальпии) при заданной температуре реакции
- •2. Второй закон термодинамики
- •2.1.Определительное уравнение энтропии
- •2.2 Расчеты изменений энтропии различных систем Изобарический нагрев веществ без фазовых превращений
- •Учет фазовых превращений 1-го рода при расчете энтропии системы
- •Расчет стандартного изменения энтропии () при протекании химической реакции
- •При нагревании от 298к до заданной температуры т
- •3. Основные фрагменты по теме “химическое равновесие. Константа равновесия”
- •Влияние температуры на константу равновесия. Уравнение изобары
- •Расчет химического сродства () в нестандартных условиях. Уравнение изотермы
- •6.1.2. Задания к контрольной работе
- •6.2. Вопросы для подготовки к зачету
- •Поверхностные явления в физико-химических системах
- •Кинетика растекания жидкостей (расплавов. Кинетика химических реакций
- •6.3. Практические работы
- •6.3.1. Практическая работа «первый закон термодинамики» Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •6.3.2. Практическая работа «Стандартное химическое сродство элементов к кислороду"
- •Контрольные задания
- •6.3.3. Практическая работа «расчет химических равновесий» Задание 1
- •6.3.4. Практическая работа « поверхностные явления
- •6.3.5. Практическая работа «кинетика химических реакций»
- •Задание 5
- •8. Материально-техническое обеспечение дисциплины
5. Образовательные технологии
В преподавании курса «Физическая химия» используются следующие формы:
лекции; практические занятия, в рамках которых решаются задачи, обсуждаются вопросы лекций и домашних заданий; контрольные работы;
экспресс-диагностика и тестирование по отдельным темам дисциплины;
самостоятельная работа студентов, включающая усвоение теоретического материала, выполнение домашних заданий, подготовка к текущему контролю знаний и к промежуточным аттестациям;
рейтинговая технология контроля учебной деятельности студентов для обеспечения их ритмичной работы в течение семестра;
консультирование студентов по вопросам учебного материала, решения задач.
6. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины и учебно-методическое обеспечение самостоятельной работы студентов
6.1.Задания и методические указания для выполнения контрольной работы
6.1.1. Теоретические сведения
1. Первый закон термодинамики для химических процессов
Тепловой эффект химического процесса согласно первому закону термодинамики преобразуется в работу, совершенную системой, и изменяет ее внутреннюю энергию:
Q = DU + A = DU + p DV, (1)
где Q – тепловой эффект; DU = U2 – U1 – изменение внутренней энергии; U2, U1 – соответственно внутренние энергии продуктов реакции и исходных веществ; А = p DV - работа, совершаемая реакцией; р – давление; DV = V2 – V1 – изменение объемов продуктов реакции и исходных веществ.
Внутренняя энергия, как и любое термодинамическое свойство системы, является функцией состояния, т.е. ее изменение не зависит от того через какие промежуточные стадии идет процесс, а определяется только исходным и конечным состоянием системы.
Для бесконечно малых элементарных процессов уравнение (1) принимает вид
dQ= +dA=dU+pdV(2)
где dQ и dA - величины теплоты и работы малого процесса, которые зависят от пути проведения процесса, а dU - изменение внутренней энергии в малом процессе, являющееся полным дифференциалом.
Изохорический и изобарический тепловые эффекты
Процессы, в которых участвуют система, могут протекать при различных условиях.
Процесс, происходящий при постоянном объеме (V = сonst, DV = 0), называется изохорическим.
QV = DU = U2 – U1 , (3)
где QV – изохорический тепловой эффект химической реакции.
Процесс, идущий при постоянном давлении (р = сonst), называется изобарическим.
Qр = DH = H2 – H1 = DU + p DV, (4)
где Qp – изобарический тепловой эффект; H2, H1 – соответственно энтальпии продуктов реакции и исходных веществ; DH – изменение энтальпии процесса; H = U + pV; p – давление; V – объем, занимаемый системой.
Для изотермического процесса (Т =const) изменение внутренней энергии DU = 0, следовательно, dQ = pdV.
Для идеального (разреженного реального) газа, используя уравнение Менделеева-Клайперона, записать его относительно p
![]() (5)
(5)
проведем интегрирование:
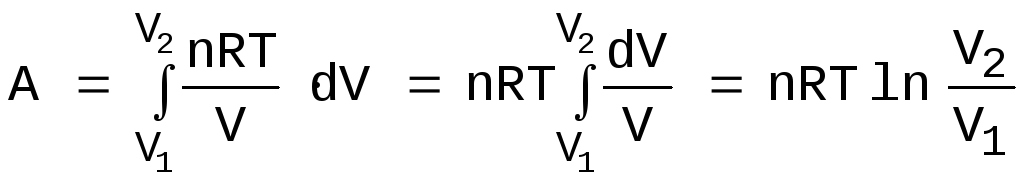 (6)
(6)
Работа адиабатического процесса (Q = 0) может быть определена следующими наиболее часто применимыми уравнениями:
А = -DU (7)
А = nCv (T1 – T2); (8)
А = (p1 V1 – p2 V2 )/(g-1) , (9)
где g = Ср/Сv (10)
Ср – изобарная теплоемкость; Сv – изохорная теплоемкость.
Выражения зависимости работы и теплоты от параметров р, V, T системы в конечном 2 и начальном 1 состоянии в четырех основных процессах с идеальными газами совместно с уравнениями состояния газа приведены в табл. 3.
Таблица 3 - Выражения зависимости работы и теплоты от параметров системы совместно с уравнениями состояния газа
|
Процесс |
Работа |
Теплота |
Уравнение состояния газа |
|
Изохорический |
0 |
nCv(T2-T1) |
p/T = const |
|
Изобарический |
p(V2-V1) |
nCp(T2-T1) |
V/T = const |
|
Изотермический |
nRTln(V2/V1) |
nRTln(p1/p2) |
pV = const |
|
Адиабитический |
nCv(T2-T1); (p1 V1 – p2 V2 )/(g-1)
|
0 |
pVg = const ТVg-1 = const Тр(g-1)/g = const |
Выражение для взаимосвязи молярной (атомной) теплоемкости идеальных газов при постоянном давлении Cp и при постоянном объеме Cv имеет вид
Cp - Cv = R (11)
Молярная теплоемкость идеального газа при постоянном объеме без учета энергии колебательного движения, т.е. при сравнительно невысоких температурах, равна:
Для одноатомных молекул
Cv = 3/2R (12)
Для двухатомных и линейных многоатомных молекул
Cv = 5/2R (13)
Для нелинейных трехатомных и многоатомных молекул
Cv = 3R (14)
Температурная зависимость изобарных молярных теплоемкостей веществ, участвующих в реакции, определяется формулой
Ср = a + bT + c¢/T2, (15)
где a, b, c' – эмпирические коэффициенты, постоянные для данного вещества в определенном интервале температур.
