
Пособие для БМ-2013-2 PDF
.pdf
Различные значения скоростей υ и концентраций СА могут быть по-
лучены из одной кинетической кривой изменения концентрации вещества А со временем СА f (Рис. 4.4), где скорость реакции в любой момент
времени рассчитывается как тангенс угла наклона касательной в точке.
tg |
lg |
|
|
lg C |
|||
|
A |
||
|
|
Рис. 4.3 Зависимость скорости реакции от концентрации вещества А
tg |
C |
A |
|
|
|||
|
|
|
|
|
|
|
|
Рис. 4.4 Кинетическая кривая С |
f для вещества А. |
|
А |
n |
A |
|
Метод Вант-Гоффа также основан на уравнении (4.14) и позволяет по двум значениям скорости реакции в разные моменты времени и двум соответствующим концентрациям вещества А определить порядок реакции
91
n lg |
|
|
2 |
||
|
||
|
||
|
1 |
|
C |
|
lg |
2 |
|
C |
||
|
||
|
1 |
,
(4.15)
где среднюю скорость реакции определяют как изменение концентрации
вещества за определенный промежуток времени |
С |
, а концентрации |
|
|
|||
|
|
С1 и С2 представляют собой средние значения на выбранном интервале ∆С.
Задача №8
Определить порядок и константу скорости реакции, протекающей при температуре Т, используя данные о ходе процесса во времени τ от начала реакции (табл. 4.3).
Рассмотрим алгоритм решения предлагаемой задачи на примере ре-
зультатов кинетических исследований трех химических реакций.
1.При изучении кинетики реакции взаимодействия 0,1М раство-
ров йодистого метила и пиридина в тетрахлорметане
C5H5N + C2H5I → C7H10N+ + I−
были получены следующие данные:
τ, c |
235 |
465 |
720 |
1040 |
1440 |
1920 |
2370 |
|
|
|
|
|
|
|
|
[I-], моль/л |
0,015 |
0,026 |
0,035 |
0,044 |
0,052 |
0,059 |
0,064 |
|
|
|
|
|
|
|
|
Концентрации продукта реакции I− (х) позволяют найти текущие концентрации пиридина или йодистого метила (С0-х) в различные момен-
ты времени. Имеющаяся кинетическая информация дает возможность ис-
пользовать для определения порядка реакции метод подстановки.
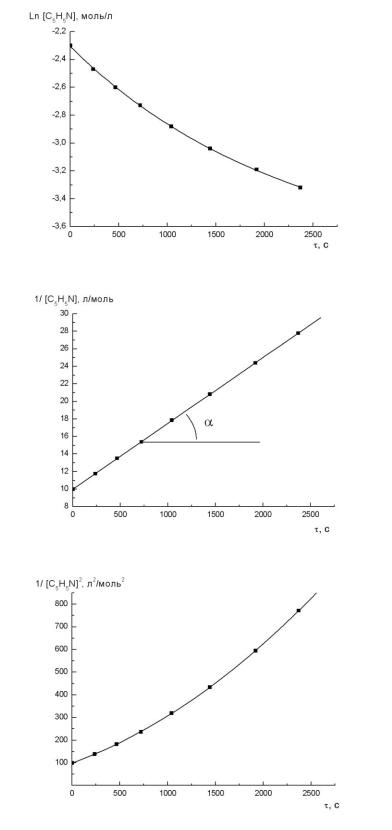
Для реализации графического варианта метода подстановки следует выполнить необходимые расчеты (табл. 4.4) и проиллюстрировать их, то есть построить графики в координатах: ln([C5 H5 N]) f ( ) ,
([C5 H5 N] 1 ) f ( ) , ([C5 H5 N] 2 ) f ( ) (Рис. 4.5 а, б, в).
92
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4.3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
№ |
|
τ, |
Контроль |
Т, |
№ |
|
|
Контроль |
|
|||||
вар- |
Реакция |
за ходом реак- |
вар- |
Реакция |
τ, мин |
Т, К |
||||||||
мин |
К |
за ходом реакции |
||||||||||||
та |
|
ции |
та |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Раствор N2O5 в ССl4 раз- |
|
а |
|
|
||
|
2NCl3(ж) → N2 + 3Cl2 |
|
а |
|
|
|
20 |
11,4 |
|
|||||
|
|
|
|
|
|
|
||||||||
1, |
4 |
10 |
|
|
8, |
лагается с выделением |
40 |
19,9 |
|
|||||
|
|
|
|
|||||||||||
а – объем N2 ×10-6, м 3; |
6 |
13 |
|
298 |
60 |
23,9 |
313 |
|||||||
15 |
|
22 |
О2; |
|||||||||||
Cl2 - поглощается |
22 |
26 |
|
|
80 |
27,2 |
|
|||||||
|
∞ |
28,5 |
|
|
а – объем О2 , мл |
100 |
29,5 |
|
||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
∞ |
34,75 |
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
b |
|
|
|
|
|
|
|
|
|
|
2HgCl2 + НСООNa → |
0 |
0,1034 |
|
0,1734 |
|
|
|
|
|
|
|
|
|
|
→Hg2Cl2+NaCl+HCl + CO2 |
3 |
0,0679 |
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2О2 в присутствии кол- |
|
|
|
|
|
||
|
а – концентрация HgCl2, |
0 |
0,0503 |
|
0,1734 |
|
|
|
а |
|
|
|||
2, |
|
|
9, |
лоидной платины разла- |
10 |
3,3 |
|
|
||||||
|
3 |
0,0326 |
|
- |
|
|
|
|||||||
|
|
298 |
30 |
8,1 |
|
303 |
||||||||
|
моль/л; b – концентрация |
|
|
|
|
|||||||||
16 |
|
|
|
|
23 |
гается с выделением О2; |
|
|||||||
НСООNa, моль/л |
0 |
0,1028 |
|
1,0227 |
|
∞ |
15,6 |
|
||||||
|
|
|
|
а – объем О2, м л |
|
|
|
|
|
|||||
|
(приведены результаты че- |
1 |
- |
|
0,9579 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
тырех опытов) |
0 |
0,1028 |
|
0,3790 |
|
|
|
|
|
|
|
|
|
|
|
2,2 |
- |
|
0,3279 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С6Н5С≡ССООNa + I2 → |
|
a |
|
|
|
СН3СООС2Н5+NaOН→ |
|
a – x |
|
b – x |
|
||
|
→ С6Н5IС=СICООNa |
0 |
24,29 |
|
|
→СН3СООNa+C2H5OH |
0 |
0,00980 |
|
0,00486 |
|
|||
|
29 |
8,32 |
|
|
|
|
||||||||
3, |
|
10, |
178 |
0,00892 |
|
0,00398 |
|
|||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
298 |
а и b – начальные кон- |
|
291 |
||||||
17 |
Исходные концентрации эк- |
|
|
|
|
24 |
273 |
0,00864 |
|
0,00370 |
||||
|
0 |
21,00 |
|
|
|
|
||||||||
вивалентны, |
|
центрации СН3СООС2Н5 |
531 |
0,00792 |
|
0,00297 |
|
|||||||
|
|
|
|
|
||||||||||
|
34,5 |
7,00 |
|
|
|
|
||||||||
|
|
|
866 |
0,00724 |
|
0,00230 |
|
|||||||
|
|
|
|
|
|
|
||||||||
|
а – количество 0,1 н рас- |
|
|
|
|
|
|
и NaOH, моль/л; х – |
|
|
||||
|
|
|
|
|
|
|
1510 |
0,00646 |
|
0,00151 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
93 |
|
|
|
|
|
|
|
|
твора Na2S2O3, израсходо- |
|
|
|
|
концентрации продуктов, |
1918 |
0,00603 |
|
0,00109 |
|
||||
|
ванное на титрование 25 |
|
|
|
|
моль/л |
2401 |
0,00574 |
|
0,00080 |
|
||||
|
|
|
|
|
|
|
|
|
|
||||||
|
мл пробы, |
см 3 (приведены |
|
|
|
|
|
|
|
|
|
|
|||
|
результаты двух опытов) |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0,102 |
|
|
С12Н22О11 + Н2О → |
|
с/с0 |
|
|||
|
|
|
|
|
70 |
0,062 |
|
|
→ С6Н12О6+С6Н12О6 |
0 |
|
1 |
|
||
|
|
|
|
|
110 |
0,044 |
|
|
1435 |
1,081 |
|
||||
|
|
|
|
|
|
|
|
|
|||||||
4, |
|
|
Rn → RaA |
140 |
0,033 |
|
11, |
с – концентрация сахара |
4315 |
1,266 |
|
||||
18 |
|
|
165 |
0,025 |
293 |
в данный момент време- |
7070 |
1,464 |
298 |
||||||
|
|
|
|
|
|||||||||||
|
|
а – объем газа Rn, мл |
200 |
0,019 |
25 |
11360 |
1,830 |
||||||||
|
|
|
|
|
|
||||||||||
|
|
|
250 |
0,016 |
|
ни, моль/л; с0 = 0,65 |
14170 |
2,117 |
|
||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
360 |
0,007 |
|
|
моль/л – начальная кон- |
16935 |
2,466 |
|
|||
|
|
|
|
|
450 |
0,003 |
|
|
19815 |
2,857 |
|
||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
600 |
0,002 |
|
|
центрация |
29925 |
4,962 |
|
|||
|
|
|
|
|
750 |
0,000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2С2Н5ОН+2Br2 → |
|
а |
|
|
СН3СООС2Н5 + NaOH → |
|
|
|
|
|
||||
|
0 |
4,24 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
a – x |
|
|||||
|
→ CН3СООС2Н5 + 4НBr |
4 |
3,14 |
|
|
→ CH3COONa + C2H5OH |
|
|
|||||||
|
|
|
0 |
0,0200 |
|
||||||||||
|
|
|
|
|
6 |
2,49 |
|
|
|
|
|||||
|
спирт в большом избытке, |
|
|
a = b – начальные концен- |
300 |
0,0128 |
|
||||||||
5, |
10 |
2,24 |
|
|
|
||||||||||
|
|
|
900 |
0,00766 |
|
||||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
15 |
1,78 |
298 |
12 |
трации СН3СООС2Н5 и |
293 |
||||||
|
а – концентрация брома × |
||||||||||||||
19 |
1380 |
0,00540 |
|||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
NaOH, моль/л; |
2100 |
0,00426 |
|
||||
|
10 |
3 |
, моль/л |
|
0 |
8,14 |
|
|
|
||||||
|
|
|
|
|
|
3300 |
0,00289 |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||
|
(приведены результаты |
4 |
6,10 |
|
|
х – концентрации про- |
|
||||||||
|
|
|
7200 |
0,00138 |
|
||||||||||
|
10 |
4,45 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
двух опытов) |
|
|
дуктов, моль/л |
|
|
|
|
|
||||||
|
15 |
3,73 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
6, |
|
|
2Н2О2 |
→ О2 + 2Н2 |
0 |
а |
303 |
13 |
N2O5 → N2O4 + ½O2 |
|
|
а |
298 |
||
|
|
11,5 |
23,89 |
0 |
2,33 |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||
94
20 |
(в водном растворе) |
27,1 |
19,30 |
|
|
а – концентрация N2O5, |
184 |
2,08 |
|
|
|
а – количество раствора |
42,5 |
14,50 |
|
|
моль/л |
319 |
1,91 |
|
|
|
|
10,95 |
|
|
526 |
1,67 |
|
|||
|
|
|
|
|
|
|
||||
|
КMnO4, израсходованное |
|
|
|
|
|
867 |
1,36 |
|
|
|
на титрование пробы, м л |
|
|
|
|
|
1198 |
1,11 |
|
|
|
|
|
|
|
|
1877 |
0,72 |
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
2315 |
0,55 |
|
|
|
|
|
|
|
|
|
3144 |
0,34 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
6 |
19,3 |
|
|
|
K2S2O8 + 2KI→ 2K2SO4 + I2 |
|
|
|
|
|
26,0 |
|
||
|
|
|
|
|
|
9 |
|
|||
|
а – количество мл 0,01н |
|
а |
|
|
|
12 |
32,6 |
|
|
|
9 |
4,52 |
|
|
|
36,0 |
|
|||
7, |
|
|
C6H5N2Cl → C6H5Cl + N2 |
14 |
|
|||||
|
|
|
|
|||||||
раствора Na2S2O3, израсхо- |
16 |
7,80 |
298 |
14 |
41,3 |
323 |
||||
21 |
а – объем N2, см3 |
18 |
||||||||
|
32 |
14,19 |
|
|
45,0 |
|
||||
|
дованное на титрование 25 |
∞ |
20,05 |
|
|
|
22 |
46.5 |
|
|
|
|
|
|
24 |
|
|||||
|
|
|
|
|
|
|||||
|
м л пробы |
|
|
|
|
|
48,3 |
|
||
|
|
|
|
|
|
26 |
|
|||
|
|
|
|
|
|
|
50,4 |
|
||
|
|
|
|
|
|
|
30 |
|
||
|
|
|
|
|
|
|
58,3 |
|
||
|
|
|
|
|
|
|
∞ |
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
95
а)
б)
в)
Рис. 4.5 Определение порядка реакции графическим методом:
а – первый порядок; б – второй порядок; в – третий порядок
96

|
|
|
|
Таблица 4.4 |
|
|
|
|
|
|
|
τ, c |
[C5H5N] ·103, |
ln[C5H5N], |
[C5H5N]-1, |
[C5H5N]-2, |
|
моль/л |
моль/л |
л/моль |
л2/моль2 |
||
|
|||||
|
|
|
|
|
|
0 |
100 |
-2,30 |
10,00 |
100,00 |
|
|
|
|
|
|
|
235 |
85 |
-2,47 |
11,76 |
138,41 |
|
|
|
|
|
|
|
465 |
74 |
-2,60 |
13,51 |
182,62 |
|
|
|
|
|
|
|
720 |
65 |
-2,73 |
15,38 |
236,69 |
|
|
|
|
|
|
|
1040 |
56 |
-2,88 |
17,86 |
318,88 |
|
|
|
|
|
|
|
1440 |
48 |
-3,04 |
20,83 |
434,03 |
|
|
|
|
|
|
|
1920 |
41 |
-3,19 |
24,39 |
594,88 |
|
|
|
|
|
|
|
2370 |
36 |
-3,32 |
27,78 |
771,60 |
|
|
|
|
|
|
Из |
рисунка видно, что зависимости |
ln([C H |
5 |
N]) f ( ) |
и |
||||
5 |
|
||||||||
([C H |
|
N] |
2 |
) f ( ) |
не являются линейными, следовательно, данная реак- |
||||
5 |
|
||||||||
5 |
|
|
|
||||||
ция не подчиняется кинетике первого или третьего порядка. А зависимость
([C H |
5 |
N] 1 ) f ( ) |
имеет линейный характер. Таким образом, порядок ре- |
|||||||||||
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
акции между пиридином и йодистым этилом равен 2. |
|
|
|
|||||||||||
По тангенсу угла наклона прямой в координатах |
([C H |
5 |
N] 1 ) f ( ) , |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
находят константу скорости реакции для реакции 2 порядка |
|
|
||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13,6 21,1 |
|
|
л |
|
|
|
tg |
|
|
[C5 H5 N ] |
k |
|
|
7,5 10 |
3 |
. |
|
|
|||
|
|
|
|
2 |
500 1500 |
|
моль с |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Второй способ определения порядка реакции – аналитический спо- |
||||||||||||||
соб подстановки. |
В интегральные кинетические уравнения реакций перво- |
|||||||||||||
го, второго и третьего порядков подставляют экспериментальные данные и проводят расчет констант скоростей в различные моменты времени от начала реакции (табл. 4.5). Как видно из полученных данных, константа скорости реакции первого порядка монотонно убывает со временем, а кон-
станта скорости реакции третьего порядка монотонно возрастает со време-
нем. Следовательно, они не являются собственно константами, и реакция
97
не подчиняется кинетике первого или третьего порядков. Значение кон-
станты скорости реакции 2 порядка колеблется около среднего значения
k |
|
7,52 10 |
3 |
2 |
|
||
|
|
|
л моль с
, значит, данная реакция протекает как реакция
второго порядка.
τ, [C5H5N] c ·103,
моль/л
235 85
465 74
720 65
1040 56
1440 48
1920 41
2370 36
k |
|
|
1 |
ln |
C |
0 |
|
|
|
|
|||||
1 |
|
C |
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
6,92 10 |
4 |
|
|||
|
|
|
|
|
|||
|
|
6,48 10 4 |
|
||||
|
|
5,98 10 |
4 |
|
|||
|
|
|
|
|
|||
|
|
5,56 10 |
4 |
|
|||
|
|
|
|
|
|||
|
|
5,10 10 |
4 |
|
|||
|
|
|
|
|
|||
|
|
4,64 10 4 |
|
||||
|
|
4,31 10 4 |
|
||||
k |
|
|
1 |
|
1 |
|
1 |
|
|
2 |
|
|
|
|
|
|
|||
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
0 |
|
|||
|
|
|
|
|
|
|
|||
|
|
|
7,51 10 |
3 |
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
7,56 10 3 |
|
|
|
|||
|
|
|
7,48 10 |
3 |
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
7,55 10 3 |
|
|
|
|||
|
|
|
7,52 10 |
3 |
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
7,49 10 3 |
|
|
|
|||
|
|
|
7,50 10 3 |
|
|
|
|||
Таблица 4.5
k |
|
|
1 |
|
1 |
|
|
1 |
|
|||
3 |
|
|
|
|
2 |
|
2 |
|
||||
|
|
2 |
|
|
C |
|
C |
|
||||
|
|
|
|
|
|
|
0 |
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
8,17 10 |
2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
8,88 10 2 |
|
|
|
|||||
|
|
|
|
9,49 10 |
2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
10,52 10 2 |
|
|
|
||||||
|
|
|
11,60 10 |
2 |
|
|
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
12,89 10 |
2 |
|
|
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
14,17 10 |
2 |
|
|
|
|||||
|
|
|
|
|
|
|
||||||
Результаты аналитического способа определения порядка реакции подтвердили данные, полученные при графическом определении порядка и константы скорости реакции. Метод подстановки позволяет найти соот-
ветствие между опытными данными и кинетическими уравнениями реак-
ций целочисленных порядков.
2. Определите порядок реакции взаимодействия брома и этилового спирта, если в двух опытах были получены следующие данные о кинетике процесса:
τ, мин |
Первый опыт |
Второй опыт |
|
|
|
||
С1, моль/л |
С2, моль/л |
||
|
|||
|
|
|
|
0 |
0,00814 |
0,00424 |
|
|
|
|
|
4 |
0,00610 |
0,00314 |
|
|
|
|
98

Для определения порядка реакции воспользуемся дифференциаль-
ным методом Вант-Гоффа. Подставим необходимые данные в уравнение
(4.15). Так как
|
|
|
C |
|
СР |
|
|||
|
|
|||
|
|
|
– средняя скорость реакции в данный промежу-
ток времени, то и концентрации С1 и С2 также необходимо взять средние.
C1
0,00814 0,00610 |
|
|
2 |
||
|
0,00712
,
C |
2 |
|
|
0,00424 0,00314 |
|
2 |
||
|
0,00369
,
|
|
|
|
C |
|
C |
2 |
|
|
|
|
|
||
|
|
lg |
1 |
|
lg |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
n |
|
|
|
|
|
|
|
|
|
|
||||
|
|
lg C1 |
lg C2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
lg |
0,00814 0,00610 |
lg |
0,00424 0,00314 |
|
|
||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
4 |
|
|
|
|
|
4 |
|
0,91 1. |
|
|
|
|
|
lg 0.00712 lg 0,00369 |
|
||||||||
|
|
|
|
|
|
|
|
|||||||
Следовательно, изучаемая реакция первого порядка.
3. При 298 К взаимодействуют эквивалентные количества йода и натриевой соли фенилпропиловой кислоты по уравнению:
C6H5C≡CCOONa + I2 → C6H5IC=CICOONa.
За ходом реакции следили по убыванию концентрации йода, опреде-
ляя ее титрованием раствором Na2S2O3. В двух параллельных опытах по-
лучены следующие результаты.
τ, с |
Опыт 1 |
Опыт 2 |
|||
|
|
|
|
||
|
0 |
29 |
0 |
34,5 |
|
|
|
|
|
|
|
Объем Na2S2O3, израсходованный на титрование |
24,96 |
8,32 |
21,00 |
7,00 |
|
250 мл пробы, мл |
|||||
|
|
|
|
||
|
|
|
|
|
|
Реакция протекала между эквивалентными количествами исходных реагентов, и к концу обоих экспериментов концентрация йода уменьши-
лась в 3 раза (одинаковая глубина протекания процесса). Поэтому порядок
99

этой реакции можно определить по уравнению Оствальда - Нойеса (4.10)
n
|
34,5 |
|
|
|
|
lg |
|
|
|
|
|
|
29 |
|
1 |
|
|
24,96 |
|||||
|
|
||||
lg |
|
|
|
|
|
21,00 |
|
|
|||
2
.
Рассчитаем константу скорости этой реакции по кинетическому
|
1 |
|
1 |
|
1 |
|
|
уравнению второго порядка k |
|
|
|
в |
|||
|
|
|
|
|
|||
|
|
||||||
|
C |
|
C |
|
|
||
|
|
|
|
|
0 |
|
|
первый опыт
с
л |
: |
|
г экв |
||
|
второй опыт
k 1
1 |
|
16,64 |
||
29 |
24,96 |
8,32 |
||
|
||||
2,763 10 |
3 |
|
,
k 1
|
1 |
|
14,00 |
||
34,5 |
21,00 |
7,00 |
|||
|
|
||||
2,761 10 |
3 |
|
.
Полученные результаты подтверждают порядок реакции, так как для первого и второго опытов значения констант полностью совпадают.
Для определения порядка рассматриваемой реакции можно исполь-
зовать и уравнение Вант-Гоффа (4.15), предварительно рассчитав средние концентрации.
C |
24,96 8,32 |
8,32 , |
|
||
1 |
2 |
|
|
|
C |
|
|
21,00 7,00 |
7,00 |
|
2 |
2 |
||||
|
|
|
|||
|
|
|
|
,
|
|
C |
|
|
C |
|
|
|
lg |
1 |
|
lg |
2 |
|
|
|
|
|
|
||||
n |
|
|
|
|
|
||
|
lg C1 |
lg C2 |
|
||||
|
|
|
|
||||
lg |
24,96 8,32 |
lg |
21,00 7,00 |
|
|
29 |
34,5 |
|
2 . |
||
|
|
|
|||
|
lg 8,32 lg 7,00 |
|
|||
|
|
|
|||
Таким образом, оба использованные метода позволяют сделать вы-
вод о протекании реакции по второму порядку.
100
