
Пособие для БМ-2013-2 PDF
.pdf
Так парциальная энергия Гиббса смешения в идеальном растворе
G |
mix |
|
|
|
0 |
RT ln x |
i , |
(2.25) |
|
|
|
|
|
|
|||
i |
|
i |
i |
i |
|
|
||
а парциальная мольная энтропия смешения
S |
|
|
|
|
|
mix |
|
|
i |
|
|
|
|
|
|
||
|
i |
|
T |
|
P |
|
|
|
|||
R ln
x |
i |
|
.
(2.26)
Изменение объема и тепловой эффект в случае идеальных растворов
отсутствуют ( |
V |
mix |
0 |
, |
H |
mix |
0 |
). |
|
|
|
|
|||||
i |
|
|
|
i |
|
Для определения парциальных молярных величии используют ана-
литические и графические методы.
• Аналитический метод – дифференцирование аналитической зави-
симости Ф=f(ni) интегрального свойства от состава раствора по количеству молей одного из компонентов.
Если экспериментально найденная зависимость Ф=f(n2) может быть аппроксимирована полиномом вида:
Ф a bn2 |
2 |
|
|
cn2 |
, |
(2.27) |
то парциальная мольная характеристика растворенного вещества опреде-
ляется как производная этой функции по числу молей n2
Ф2 |
|
Ф |
||
|
|
|
|
|
|
|
n |
|
|
|
|
2 |
|
|
|
|
|||
P,T
b
2cn |
2 |
|
,
(2.28)
а парциальная мольная характеристика растворителя может быть рассчи-
тана на основании свойства аддитивности (2.19):
Ф |
Ф n Ф |
|
|
2 |
2 |
||
|
|||
1 |
n |
|
|
|
|
||
|
1 |
|
.
(2.29)
• Графические методы – основаны на построении касательных к за-
висимости свойство раствора – состав (рис. 2.1). При этом состав раствора выражается в молях одного из компонентов, как правило, растворенного
31
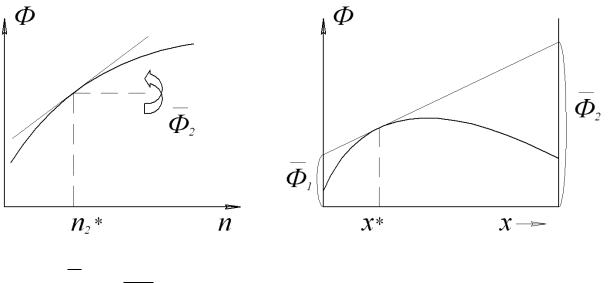
вещества, (метод касательных) или в мольных (массовых) долях одного из компонентов (метод пересечений).
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными. К ним относятся: понижение давления пара растворителя над раствором, повы-
шение температуры кипения и понижение температуры замерзания рас-
твора, а также осмотическое давление.
а)
Ф2 |
|
Ф |
||
|
|
|
|
|
|
|
n |
|
|
|
|
2 |
|
|
|
|
|||
tg
P,T ,n1
б)
Рис. 2.1 Графические методы определения парциальных мольных характе-
ристик: а) метод касательных; б) метод пересечений.
Понижение температуры замерзания ( Т ЗАМ Т ЗАМ |
0 |
Т ЗАМ ) и повыше- |
||||||||||||||||
ние температуры кипения ( Т КИП Т КИП Т |
0 |
) разбавленного раствора по |
||||||||||||||||
КИП |
||||||||||||||||||
сравнению с чистым растворителем: |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
RT 2 |
х |
|
|
RT 2 |
М |
1 |
|
|
|
|
|
|
|
|
||
ТЗ |
|
З |
2 |
|
|
|
З |
|
|
m2 КК m2 , |
|
(2.30) |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Н ПЛ |
|
HПЛ 1000 |
|
|
|
|
|
|
||||||||
ТКИП |
RT 2 |
х |
|
RT 2 |
|
М |
1 |
|
|
КЭm2 , |
|
|
||||||
|
КИП 2 |
|
|
КИП |
|
|
|
m2 |
|
(2.31) |
||||||||
|
НКИП |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
HКИП1000 |
|
|
|
|||||||||||
32

где |
Т |
0 |
и |
Т КИП |
0 |
– температуры замерзания и кипения чистого растворите- |
ЗАМ |
|
ля; М1 – молярная масса растворителя; х2 и m2 – мольная доля и моляль-
ность растворенного вещества; ∆Hпл и ∆Hкип – энтальпии плавления и ис-
парения растворителя; Кк и Кэ – криоскопическая и эбулиоскопическая по-
стоянные растворителя; 1000 – поправочный коэффициент, учитывающий массу растворителя в растворе с моляльностью m2 (g1=1000 г).
По понижению температуры замерзания (повышению температуры кипения) раствора можно определить молекулярную массу растворенного вещества М2 и установить наличие ассоциации или диссоциации частиц в растворе.
|
|
|
К |
|
g 10 |
3 |
|
М |
|
|
|
|
|||
|
|
К |
2 |
|
|
||
|
|
|
|
|
|
||
|
2 |
|
T g |
|
|
||
|
|
|
1 |
|
|||
|
|
|
|
|
З |
|
|
,
(2.32)
|
|
|
К |
|
g 10 |
3 |
||
М |
|
|
|
|
||||
|
|
Э |
2 |
|
|
|
||
|
|
|
|
|
|
|
||
|
2 |
|
T |
|
g |
|
|
|
|
|
|
КИП |
1 |
||||
|
|
|
|
|
|
|||
,
(2.33)
где g1 и g2 – массы растворителя и растворенного вещества в растворе,
соответственно.
Осмотическое давление π в разбавленных растворах можно рассчи-
тать по уравнению Вант-Гоффа: |
|
CRT , |
(2.34) |
где С – молярная концентрация раствора, моль/м3.
Уравнения, описывающие коллигативные свойства растворов не-
электролитов, можно применять и для описания свойств растворов элек-
тролитов, введя поправочный коэффициент Вант-Гоффа i, определяемый по уравнению (2.7)
iCRT |
|
|
, |
TЗАМ |
iK K m2 , |
TКИП iK Э m2 .
(2.35)
(2.36)
(2.37)
33

Растворимость твердого вещества в идеальном растворе при темпе-
ратуре Т описывается уравнением Шредера:
|
|
|
H |
ПЛ |
|
1 |
ln x |
|
|
|
|
|
|
2 |
|
|
|
|||
|
|
R |
|
Т ПЛ |
||
|
|
|
|
|||
|
1 |
|
Т |
||
|
,
(2.38)
где х2, ТПЛ, ∆НПЛ – мольная доля, температура плавления и молярная тепло-
та плавления растворенного вещества.
Зависимость растворимости газов в жидкостях от давления описыва-
ется уравнением Генри (2.8) где х2 – мольная доля газа в насыщенном рас-
творе, а зависимость растворимости газов от температуры - интегральным уравнением вида:
|
x |
) |
|
2(T |
|
ln |
2 |
|
x |
|
|
|
|
|
|
2(T ) |
|
|
1 |
|
|
H |
|
1 |
|
|
|
|
|
|
Р |
|
|
R |
|
T |
|
|
||
|
|
2 |
|
1 |
|
T |
||
|
||
|
1 |
,
(2.39)
где ∆НР – дифференциальная теплота растворения газа в насыщенном рас-
творе.
Растворение вещества в двух несмешивающихся друг с другом рас-
творителях выражается законом распределения:
С1 |
К , |
(2.40) |
|
С2 |
|||
|
|
где С1 и С2 – равновесные концентрации распределяющегося вещества в первом и втором растворителях, К – коэффициент распределения.
В реальных растворах концентрации в выражении закона распреде-
ления (2.40) следует заменять активностями.
При диссоциации (ассоциации) вещества в одном из растворителей используют уравнение Шилова-Лепиня:
С |
n |
|
|
1 |
|
С |
2 |
|
|
К
,
(2.41)
где n = M2/M1 , M1 и M2 – средняя молекулярная масса распределяющего-
ся вещества в первом и втором растворителях.
34
В случае если степень диссоциации α растворенного вещества в рас-
творителях 1 и 2 различна, то уравнение (2.40) преобразуется к виду:
C1 |
(1 1 ) |
K . |
(2.42) |
||
C2 (1 |
2 ) |
||||
|
|
||||
Закон распределения применяется для описания процесса экстрак-
ции. Масса вещества g, оставшегося в растворе после n-го шага экстраги-
рования, может быть рассчитана по формуле:
g g |
|
KV |
n |
|
|
|
|
|
, |
(2.43) |
|
|
|||||
0 |
KV v |
|
|
||
где g0 – начальная масса экстрагируемого вещества в растворе, V – объем этого раствора, ν – объем порции экстрагента, n – число стадий экстрак-
ции.
2.1.1 Примеры решения задач
Пример 1.
Рассчитайте состав раствора бензол-толуол, который при нормаль-
ном давлении кипит при температуре 1000С, а также состав образующегося пара. Раствор считайте идеальным. Давления пара чистых бензола и толу-
ола при 1000С равны 1350 Торр и 556 Торр соответственно.
Решение: Мольную долю бензола в растворе находим по закону Рауля
(2.5): 760 = 556 + (1350-556)х1, откуда х1 = 0,257.
Мольная доля толуола в растворе равна х2 = 1-х1 = 0,743.
Мольную долю бензола в газовой фазе находим по закону Дальтона (2.2):
х |
газ |
Р |
/ Р х Р |
0 |
/ Р 0,257 1350 / 760 0,456. |
|
|
|
|||||
1 |
1 |
1 |
1 |
|
||
Соответственно мольная доля толуола в паре: х2газ 1 х1газ 0,544.
35

Пример 2.
Мольные объемы CCl4 и C6H6 равны 0,09719 и 0,08927 л/моль соот-
ветственно, а их парциальные мольные объемы в эквимолярном растворе равны 0,10010 и 0,10640 л/моль. Рассчитайте мольный объем эквимолярно-
го раствора и изменение объема при смешении.
Решение: Объем 1 моля раствора определим по формуле (2.20): Vm = 0,5·0,10010 + 0,5∙0,10640 = 0,10325 (л/моль).
Объем до смешения: V0 = 0,5·0,09719 + 0,5∙0,089274 = 0,09323 (л/моль). ∆Vmix = V0 - Vm = 0,01002 (л/моль) – наблюдается увеличение объема
раствора при смешении, т. е. положительные отклонения от закона Рауля.
Пример 3.
Рассчитайте растворимость висмута в кадмии при 150 и 2000С. Эн-
тальпия плавления висмута при температуре плавления (2730С) равна 10,5
кДж/моль и не зависит от температуры. Считайте, что образуется идеаль-
ный раствор.
Решение: Воспользуемся формулой (2.38):
при 1500С |
ln x |
10500 |
|
1 |
|
1 |
|
х 0,51, |
|
|
|
|
|
|
|
||||
|
|
|
|
||||||
|
|
8,314 |
546 |
|
423 |
|
|
||
при 2000С
ln x |
10500 |
|
1 |
|
1 |
|
|
|
|
|
|
|
|||
|
8,314 |
|
546 |
|
473 |
|
|
х
0,70
.
Растворимость увеличивается с температурой, что характерно для эндотермического процесса.
Пример 4.
Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление
7,52·10-3 атм при 250С. Определите молярную массу гемоглобина.
Решение: В уравнении (2.34) выразим молярную концентрацию как
C MVm (m – масса гемоглобина в растворе, а М – его молекулярная мас-
36

са), следующее получим выражение:
|
mRT |
|
20 10 |
3 |
кг 0,08206л атм К |
1 |
моль |
1 |
298К |
||
M |
|
|
|
|
|||||||
V |
|
|
1л 7,52 10 |
3 |
атм |
|
|
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
65кг /
моль
.
Обратите особое внимание на соответствие размерностей всех величин в
формуле (2.34). При использовании величины R= 8,314 |
Дж |
|
следует |
|
моль |
К |
|||
|
|
|
моль |
|
выразить осмотическое давление в Па, а молярную концентрацию в |
м |
3 . |
|
|
|
Пример 5.
Проба нелетучей жирной кислоты с общей формулой CnH2n-3COOH
массой 1,263 г растворена в 500 г CCl4. Температура кипения раствора со-
ставила 76,8040С. Определите, какая кислота была исследована, если Ткип
для ССl4 равна 76,760С, а его эбуллиоскопическая постоянная 4,88.
Решение: По формуле (2.33)
М |
2 |
|
|
4,88 1,263 10 |
3 |
|
|
|
||
349,954 349,91 500 |
|||
|
|||
280,1
г/моль .
Индекс n находим, решая уравнение: 12n + 1(2n-3) + 12 + 2∙16 +1 = 280, от-
куда n = 17. Исследована линолевая кислота C17H31COOH (витамин F).
Пример 6.
Давление пара воды при 273 К равно 610,48 Па, а давление пара 10%
раствора NaNO3 589,28 Па. Определите активность, коэффициент активно-
сти и химический потенциал воды в растворе.
Решение: активность растворителя в неидеальном растворе можно рассчи-
тать по закону Рауля (2.4)
|
|
P |
|
589,28 |
0,965 |
|
a |
1 |
|
||||
|
0 |
|
||||
1 |
|
P |
|
610,48 |
|
|
|
|
|
|
|
||
|
|
1 |
|
|
|
|
, а коэффициент ак-
тивности из соотношения |
|
1 |
a |
/ x |
|
|
|
|
||||||||
|
1 |
1 . |
|
|
|
|
||||||||||
|
|
Мольная доля воды в растворе |
|
|
|
|
||||||||||
x1 |
|
|
n1 |
|
|
g1 / M1 |
|
|
|
|
90 /18 |
0,977 |
, |
тогда 1 |
0,988 . |
|
n1 |
n2 |
g1 |
/ M1 g2 / M 2 |
90 /18 10 / 85 |
||||||||||||
|
|
|
|
|
|
|
|
|||||||||
37

Химический потенциал воды в реальном растворе:
|
|
|
0 |
RT ln a |
G |
0 |
H O RT ln a 273 10 |
3 |
8,314 273 ln 0,965 |
|||
|
|
|
|
|
|
|
|
|
|
|||
|
1 |
|
1 |
|
|
1 |
|
298 |
2 |
1 |
|
|
273,08 |
кдж |
. |
|
|
|
|
|
|
||||
моль |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 7.
Молярную массу липида определяют по повышению температуры кипения. Липид можно растворить в метаноле или в хлороформе. Темпера-
тура кипения метанола 64,70 С, теплота испарения 262,8 кал/г. Температура кипения хлороформа 61.50 С, теплота испарения 59,0 кал/г. Рассчитайте эбуллиоскопические постоянные метанола и хлороформа. Какой раствори-
тель лучше использовать, чтобы определить молярную массу с большей точностью?
Решение: молярную массу липида можно рассчитать по формуле (2.33), а
эбуллиоскопические постоянные растворителей − из уравнения (2.31)
К |
Э |
|
|
RT |
|
|
|
2 |
|
|
КИП |
l |
КИП |
1000 |
|
|
|
, обращая внимание на соответствие размерностей.
|
CH |
O |
8,314 337,7 |
2 |
|
K кг |
К |
262,8 4,184 1000 |
0,86 |
|
|||
Э |
4 |
|
|
моль |
||
|
|
|
|
|||
и
|
|
CHCl |
|
|
8,314 334,5 |
2 |
||
|
|
|
|
|
|
|||
К |
Э |
3 |
59,0 |
4,184 |
1000 |
|||
|
|
|
||||||
|
|
|
|
|
||||
3,77
K кг моль
.
Так как |
Т |
КИП |
К |
Э |
m |
, то при одинаковой моляльности растворов |
|
|
2 |
повышение температуры кипения и молярная масса определяются точнее в растворителе с большей КЭ.
Пример 8.
Некоторое количество вещества, растворенное в 100 г бензола, по-
нижает точку его замерзания на 1,280С. То же количество вещества, рас-
творенное в 100 г воды, понижает ее точку замерзания на 1,3950С. Веще-
ство имеет в бензоле нормальную молекулярную массу, а воде полностью
38

диссоциировано. На сколько ионов вещество диссоциирует в водном рас-
творе? Криоскопические постоянные бензола и воды равны 5,12 и 1,86
К кг моль
соответственно.
Решение: из уравнений (2.30) и (2.37) следует, что отношение моляльных концентраций растворов в воде и в бензоле , а значит, и соотношение мо-
лекулярных масс растворенного вещества равно изотоническому коэффи-
циенту Вант-Гоффа. При подстановке α = 1 в формулу (2.7) получим i = ν.
В водном растворе: m TЗАМ |
|
1,395 |
0,75 . |
|
|
||||
2 |
КК |
1,86 |
|
|
|
|
|||
В бензольном растворе:
m |
T |
|
|
ЗАМ |
|||
|
|||
2 |
К |
|
|
|
К |
||
|
|
||
1,28
5,12
0,25
.
Следовательно, в бензоле растворенное вещество существует в форме молекул, а в воде диссоциирует на три иона 0,250,75 3.
2.1.2 Варианты индивидуальных заданий по теме «Растворы»
Таблица 2.2
№ |
|
|
|
|
Задачи |
|
|
|
|
|
в-та |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
1. Рассчитайте активность и коэффициент активности воды в растворе, образую- |
|||||||||
|
щемся при растворении 0,122 кг нелетучего вещества (М=241 г/моль) в 0,920 кг |
|||||||||
|
воды при 293 К, если известно, что давление пара чистой воды равно 0,02308 |
|||||||||
|
атм, а над раствором – 0,02239 атм. |
|
|
|
|
|||||
1 |
2. При распределении фенола между водой и бензолом получены данные: |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
С, моль/л |
в H2O |
|
0,0316 |
|
0,123 |
0,327 |
0,750 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в C6H6 |
|
0,077 |
|
0,159 |
0,253 |
0,390 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
Вычислите константу распределения К и показатель степени n в формуле, опи- |
|||||||||
|
сывающей закон распределения. |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
39

Продолжение таблицы 2.2
1. При распределении уксусной кислоты между тетрахлоридом углерода и водой
были получены следующие концентрации:
С, кг/м3 |
в H2O |
48,7 |
54,2 |
76,4 |
93,0 |
107,0 |
|
|
|
|
|
|
|
||
в CCl4 |
2,92 |
3,63 |
7,25 |
10,7 |
14,1 |
||
|
|||||||
|
|
|
|
|
|
|
Уксусная кислота в водном растворе имеет нормальную молекулярную массу
2
Определите молекулярную массу кислоты в растворе CCl4 и коэффициент рас-
пределения К.
2. Плотность 50% (по массе) раствора этанола в воде при 250С равна 0,914 г/см3.
Рассчитайте парциальный мольный объем этанола в растворе, если парциальный мольный объем воды 17,4 см3/моль
1. Давление пара чистых CHCl3 и CCl4 при 250С равны 26,54 и 15,27 кПа. Пола-
гая, что они образуют идеальный раствор, рассчитайте давление пара и состав (в
мольных долях) пара над раствором, состоящим из 1 моль CHCl3 и 1 моль CCl4.
3
2. Белок сывороточный альбумин человека имеет молярную массу 69 кг/моль.
Рассчитайте осмотическое давление раствора 2 г белка в 100 см3 воды при 250С в Па. Примите плотность раствора 1 г/см3.
1. При 800С плотность 12% раствора фенола в воде равна 0,9775 г/см3. Какое ко-
личество моль воды приходится на 1 моль фенола? Чему равен удельный объем фенола, если удельный объем воды 1,029 см3/г, и образование раствора происхо-
дит без изменения объема?
4
2. Давление пара воды при 293 К равно 2338,5 Па, давление пара раствора 2295,8
Па. Определите осмотическое давление при 313 К, если плотность раствора при этой температуре 1010 кг/м3. Молекулярная масса растворенного вещества равна
60 г/моль.
1. Плотность CS2 при 293 К равна 1,264 г/см3, плотность C2H5OH - 0,8040 г/см3.
Чему равна плотность смеси, содержащей 80% CS2, если удельный объем ее яв-
ляется аддитивной функцией состава?
2. Водный раствор некоторого вещества замерзает при 271,5 К. Определите его
5
температуру кипения и давление пара над раствором при 298 К, если криоскопи-
ческая константа воды 1,86, а эбуллиоскопическая константа воды 0,516. Давле-
ние пара чистой воды при 298 К равно 3168 Па.
40
