
И зотермы ионного обмена
Задачей как аналитического, так и графического описания ионообменного равновесия заключается в изображении зависимости между составами фаз ионита и раствора. В отличие от других гетерогенных систем ионообменные системы мало чувствительны к изменению температуры, поэтому изотермы ионного обмена не относятся к строго определенной температуре, а обычно характеризуют равновесие в области температур от 15 до 30 С. Изотермы ионного обмена графически изображают зависимость между эквивалентной долей иона в ионите и эквивалентной долей его в растворе при установлении равновесия между ионами, изменяющиеся в интервале от 0 до 1, так называемая квадратная диаграмма (рис.3.5.3.). Так для системы
![]()
при равенстве зарядов ионов А и В эквивалентные доли ионов А и В в ионите составят
(3.5.7)
а![]() эквивалентные доли их же в растворе
эквивалентные доли их же в растворе
(![]() 3.5.8)
3.5.8)
Ñ![]() и N
- суммарные концентрации ионов в фазе
ионита и в внешнем растворе соответственно.
и N
- суммарные концентрации ионов в фазе
ионита и в внешнем растворе соответственно.
Заменив в выражении 3.5.3 молярные концентрации на их эквивалентные доли, и принимая во внимание, что значение N в условиях квадратной диаграммы равно 1, а заряды ионов А и В равны, преобразуем его относительно иона В. В итоге получим следующее уравнение изотермы:
![]()
(3.5.9)
Форма изотермы определяется величиной концентрационной константы. При КВ/А=1 изотерма обмена представляет собой биссектрису угла, образованного осями координат, при КВ/А> 1 изотерма является кривой, лежащей выше диагонали квадрата (выпуклая кривая), если КВ/А < 1 - кривая лежит ниже диагонали (вогнутая кривая). Величина константы обмена может быть определена как отношение площадей заштрихованных прямоугольников (рис. 3.5.3):
(3.5.10)
3![]() .5.3.
КИНЕТИКА ИОННОГО ОБМЕНА
.5.3.
КИНЕТИКА ИОННОГО ОБМЕНА
М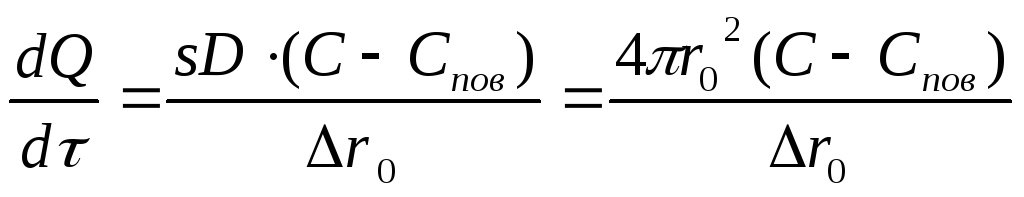 еханизм
ионообменного процесса включает
следующие стадии:
еханизм
ионообменного процесса включает
следующие стадии:
1) диффузия ионов, поглощаемых ионитом из сплошной фазы раствора электролита к пленке раствора, непосредственно прилегающей к зерну ионита,
2) диффузия поглощаемых ионов к поверхности зерна через пленку раствора, в которой не происходит перемешивания,
3) диффузия поглощаемых ионов к месту расположения функциональных групп в объеме зерна,
4) акт обмена поглощаемых ионов на противоионы ионита,
5) диффузия вытесняемых ионов в объеме зерна к поверхности,
6) диффузия вытесняемых ионов через пленку,
7) диффузия вытесняемых ионов в объем раствора.
И![]()
![]()
![]() онный
обмен, в целом, является хемосорбционным
процессом: обменные химические реакции
внутри ионитов обычно идут со скоростями
значительно большими, чем диффузия
ионов, наиболее медленными, а следовательно,
определяющими общую скорость процесса
являются стадии 2, 6 – пленочная диффузия
и стадии 3, 5 – гелевая диффузия. На
скорость ионного обмена значительное
влияние оказывает концентрация раствора
электролита. Взаимодействия между
электролитами с низкой концентрацией
поглощаемых ионов в растворе (менее
0,003 моль/л) и ионитами с большой обменной
емкостью при малой степени сшивки,
скорость обмена контролируется внешней
(пленочной) диффузией. В переходной
области существует смешанная кинетика,
где учитываются обе диффузионные стадии.
В концентрированных растворах (более
0,1 моль/л) и больших степенях сшивки
процесс лимитируется диффузией ионов
в зерне и описывается гелевой кинетикой.
Наиболее простой и надежный метод
экспериментального определения
лимитирующей стадии – метод прерывания
ионного обмена. При гелевой кинетике
после перерыва начальная скорость
обмена выше, чем до перерыва, так как
концентрация в зерне выравнивается и
начальный градиент концентраций
возрастает. В случае пленочной кинетики
кривая поглощения не имеет перегиба.
онный
обмен, в целом, является хемосорбционным
процессом: обменные химические реакции
внутри ионитов обычно идут со скоростями
значительно большими, чем диффузия
ионов, наиболее медленными, а следовательно,
определяющими общую скорость процесса
являются стадии 2, 6 – пленочная диффузия
и стадии 3, 5 – гелевая диффузия. На
скорость ионного обмена значительное
влияние оказывает концентрация раствора
электролита. Взаимодействия между
электролитами с низкой концентрацией
поглощаемых ионов в растворе (менее
0,003 моль/л) и ионитами с большой обменной
емкостью при малой степени сшивки,
скорость обмена контролируется внешней
(пленочной) диффузией. В переходной
области существует смешанная кинетика,
где учитываются обе диффузионные стадии.
В концентрированных растворах (более
0,1 моль/л) и больших степенях сшивки
процесс лимитируется диффузией ионов
в зерне и описывается гелевой кинетикой.
Наиболее простой и надежный метод
экспериментального определения
лимитирующей стадии – метод прерывания
ионного обмена. При гелевой кинетике
после перерыва начальная скорость
обмена выше, чем до перерыва, так как
концентрация в зерне выравнивается и
начальный градиент концентраций
возрастает. В случае пленочной кинетики
кривая поглощения не имеет перегиба.
