
- •Лабораторный практикум по физике
- •Введение
- •Раздел 1 механика
- •Определение ускорения свободного падения тел
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Начальные параметры траекторий
- •Контрольные вопросы
- •Движение тела под действием постоянной силы
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значения коэффициентов трения покоя
- •Результаты измерений
- •Контрольные вопросы
- •Свободные механические колебания
- •Краткая теория
- •Порядок выполнение лабораторной работы
- •Параметры эксперимента
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Упругие и неупругие соударения
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Начальные параметры
- •Результаты измерений и расчетов для абсолютно упругого удара
- •Результаты измерений и расчетов для абсолютно неупругого удара
- •Контрольные вопросы
- •Раздел 2 термодинамика и молекулярная физика
- •Адиабатический процесс
- •Краткая теория
- •Прядок выполнения лабораторной работы
- •Начальные значения температуры
- •Результаты измерений
- •Контрольные вопросы
- •Распределение молекул идеального газа по скоростям
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значения температуры газа
- •Масса одной молекулы некоторых газов
- •Контрольные вопросы
- •Изотермы реального газа
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Результаты измерений
- •Значения температуры
- •Контрольные вопросы
- •Содержание
Результаты измерений и расчетов для абсолютно неупругого удара
(количество измерений и строк – 10)
|
№ изм |
| ||||||||||
|
|
до удара |
после удара | |||||||||
|
|
|
|
|
|
|
|
|
|
| ||
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
10 |
… |
|
|
|
|
|
|
|
|
|
|
Определите тепловую энергию –
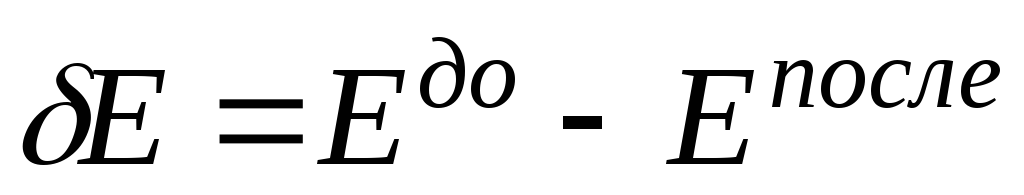 ,
отношение масс соударяющихся тел –
,
отношение масс соударяющихся тел –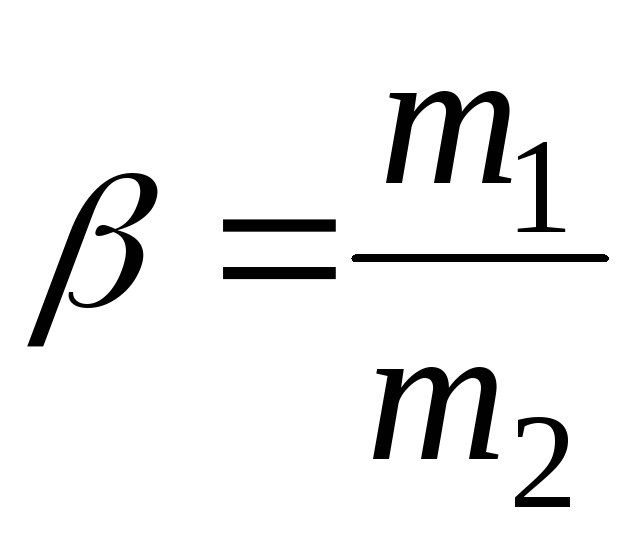 .
.Постройте график зависимости тепловой энергии от отношения масс соударяющихся тел:
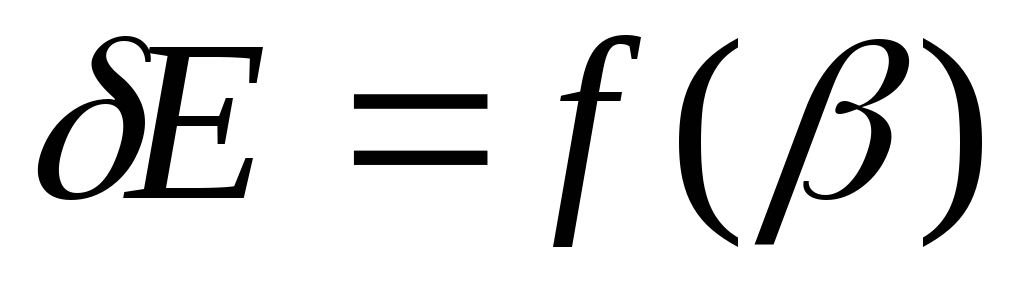 .
.
Контрольные вопросы
Дайте определения удара. Опишите фазы удара.
Дайте определения потенциальным силам, стационарным силам. Приведите примеры таких сил.
Какие системы называются замкнутыми, изолированными.
Сформулируйте закон сохранения механической энергии и импульса. В каких системах они выполняются. Перечислите виды механической энергии и дайте им определения.
Дайте определение диссипативным системам. Что такое диссипация энергии. Приведите примеры диссипативных сил.
Какой удар называется абсолютно упругим и абсолютно неупругим? Сформулируйте и запишите законы сохранения, выполняющиеся при абсолютно упругом и абсолютно неупругом ударах двух тел?
Что такое коэффициент восстановления? Чему он равен при абсолютно упругом и абсолютно неупругом ударах?
Что произойдет со скоростью и характером движения тел после удара в случаях:
абсолютно неупругого удара тел одинаковой массы, движущихся навстречу друг другу до удара с одинаковыми скоростями
абсолютно упругого удара тел одинаковой массы, если одно из соударяющихся тел до удара покоится?
Раздел 2 термодинамика и молекулярная физика
Лабораторная работа № 201
Адиабатический процесс
Цель работы:
определить отношения теплоемкости при постоянном давлении к теплоемкости при постоянном объеме с помощью виртуальной модели
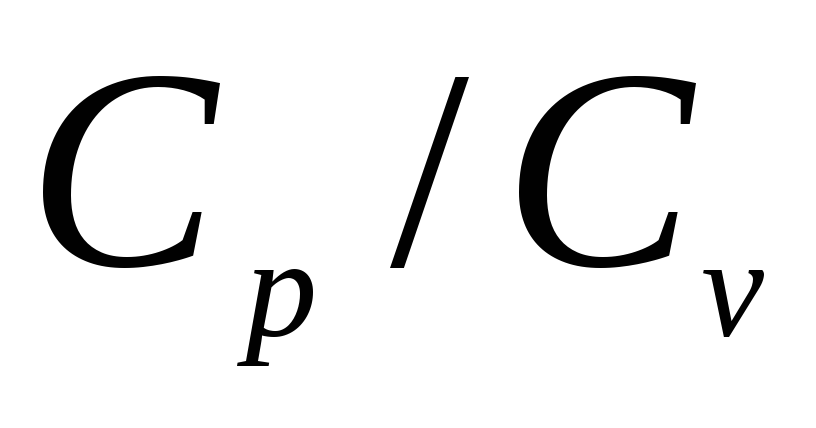 .
.
Приборы и принадлежности:
персональный компьютер
компьютерные модели «Открытая физика 1.1».
Краткая теория
Теплота есть форма беспорядочного (теплового) движения образующих тело частиц. Количественной мерой теплоты служит количество теплоты, т. е. количество энергии, получаемой или отдаваемой системой при теплообмене. В термодинамики для характеристики тепловых свойств тел используется понятие теплоёмкости.
Теплоёмкостью вещества называют количество теплоты, получаемое телом при нагревании на 1 градус. Определение теплоёмкости математически можно записать виде
![]() ,
,
![]() = 1
= 1
![]() ,
(1)
,
(1)
т. е. теплоёмкость вещества – отношение количества теплоты, поглощаемое телом при бесконечно малом изменении его температуры, к этому изменению.
Теплоёмкость единицы массы вещества называют удельной теплоёмкостью:
![]() ,
,
![]() =
=
![]() ,
(2)
,
(2)
теплоемкость одного моля – молярной (мольной) теплоёмкостью:
![]() ,
,
![]() =
=
![]() ,
(3)
,
(3)
![]() –количество
вещества,
–количество
вещества,
![]() = 1 моль;
= 1 моль;![]() – масса вещества
– масса вещества![]() = 1 кг, молярная масса вещества
= 1 кг, молярная масса вещества![]() = 1
= 1![]() .
.
По отношению к
газам различают две теплоёмкости:
теплоёмкость при постоянном объеме
![]() (изохорическая
теплоемкость)
и теплоёмкость при постоянном давлении
(изохорическая
теплоемкость)
и теплоёмкость при постоянном давлении
![]() (изобарическая
теплоёмкость).
(изобарическая
теплоёмкость).
Термодинамический
процесс, протекающий при постоянном
объеме (![]() ),
называетсяизохорным
(изохорическим).
Работа газа в этом процессе равна нулю,
т. к.
),
называетсяизохорным
(изохорическим).
Работа газа в этом процессе равна нулю,
т. к.
![]() ,
т. е. газ не совершает механической
работы. Тогдапервое
начало термодинамики
запишется в следующем виде:
,
т. е. газ не совершает механической
работы. Тогдапервое
начало термодинамики
запишется в следующем виде:
![]() ,
(4)
,
(4)
т.е. при изохорическом процессе вся подводимая к газу теплота затрачивается на увеличение внутренней энергии газа. Учитывая, что изменение внутренней энергии произвольного газа равно
![]() ,
(5)
,
(5)
где
![]() – число степеней свободы, т. е. число
независимых координат, определяющих
положения тела (молекулы газа) в
пространстве;
– число степеней свободы, т. е. число
независимых координат, определяющих
положения тела (молекулы газа) в
пространстве;![]() – количество вещества;
– количество вещества;![]() – универсальная газовая постоянная,
из выражения (2) получаем:
– универсальная газовая постоянная,
из выражения (2) получаем:
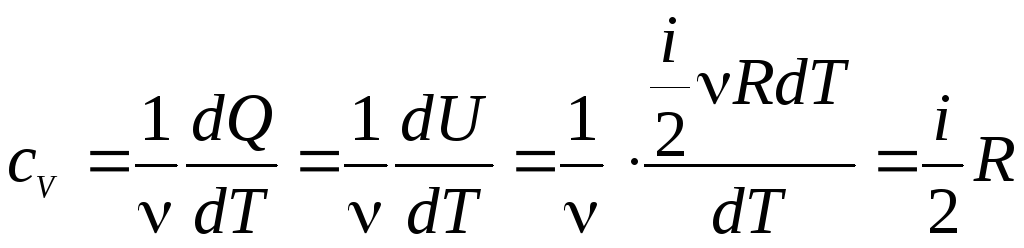 .
(6)
.
(6)
Термодинамический
процесс, протекающий при постоянном
давлении (![]() ),
называетсяизобарным.
Первое начало
термодинамики
в этом случае запишется в виде:
),
называетсяизобарным.
Первое начало
термодинамики
в этом случае запишется в виде:
![]() ,
(7)
,
(7)
т.е. теплота, переданная газу при изобарическом процессе, затрачивается на увеличение внутренней энергии газа и на совершение внешней работы.
Учитывая, что работа газа равна
![]() ,
,
из выражения (2) получаем:
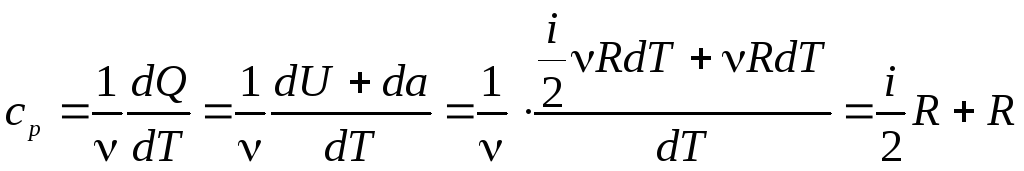 .
.
Или учитывая выражение (5) получаем:
![]() .
(8)
.
(8)
Это выражение
называется уравнением
Майера. Оно
показывает, что молярная изобарическая
теплоёмкость
![]() больше молярной изохорической теплоёмкости
больше молярной изохорической теплоёмкости![]() на величину универсальной газовой
постоянной
на величину универсальной газовой
постоянной![]() .
.
Адиабатическим (адиабатным) процессом называется термодинамический процесс, который осуществляется в системе без теплообмена её с внешними телами. Осуществить процесс близкий к адиабатному можно в том случае, если газ находиться внутри оболочки с очень хорошими теплоизоляционными свойствами. Адиабатными можно считать быстро протекающие процессы. Кратковременность процесса приводит к тому, что газы не успевают обмениваться теплотой с окружающей средой. Так, например, в звуковых волнах большие частоты колебаний газа приводят к сжатиям и разрежениям, которые могут считаться адиабатными. Вследствие большой скорости взрыва горючей смеси при работе двигателя внутреннего сгорания можно считать, что этот процесс происходит адиабатически.
Так как, передачи теплоты при адиабатическом процессе не происходит, то
![]() ,
,
и уравнение первого начала термодинамики для адиабатного процесса принимает вид
![]() ,
,
откуда
![]() ,
(9)
,
(9)
т.е.при адиабатическом процессе внешняя работа газа может производится вследствие изменения его внутренней энергии.
Предположим, что
взят 1 моль газа (![]() моль), тогда перепишем выражение (9) в
виде
моль), тогда перепишем выражение (9) в
виде
![]() .
(10)
.
(10)
Разделив это уравнение на уравнение состояние идеального газа (уравнение Клапейрона – Менделеева) для 1 моля газа
![]() ,
(11)
,
(11)
получим
![]() .
(12)
.
(12)
Из уравнения
Майера,
![]() ,
тогда уравнение (12) перепишем следующим
образом:
,
тогда уравнение (12) перепишем следующим
образом:
![]() .
(13)
.
(13)
Отношение теплоёмкостей обозначим
![]() ,
(14)
,
(14)
тогда выражение (13) примет вид:
![]() .
(15)
.
(15)
Интегрируя это уравнение, получим
![]() ,
(16)
,
(16)
где А – постоянная. Преобразуя уравнение (16) и потенцируя его, находим
![]() ,
,
![]() .
(17)
.
(17)
Используя уравнение состояния идеального газа (11), можно переписать полученное уравнение в виде:
![]() .
(18)
.
(18)
Это уравнение адиабатного процесса называется уравнение Пуассона.
Показатель степени
![]() в уравнении (18) называетсяпоказателем
адиабаты газа:
в уравнении (18) называетсяпоказателем
адиабаты газа:
![]() ,
(19)
,
(19)
и
![]() ,
так как
,
так как![]() .
.
Рассмотрим
адиабатный процесс перехода газа из
термодинамического состояния,
характеризующееся давлением
![]() и объёмом
и объёмом![]() ,
в термодинамическое состояние,
характеризующееся давлением
,
в термодинамическое состояние,
характеризующееся давлением![]() и объёмом
и объёмом![]() .
В этом случае уравнение состояние газа
запишется
.
В этом случае уравнение состояние газа
запишется
![]() ,
(20)
,
(20)
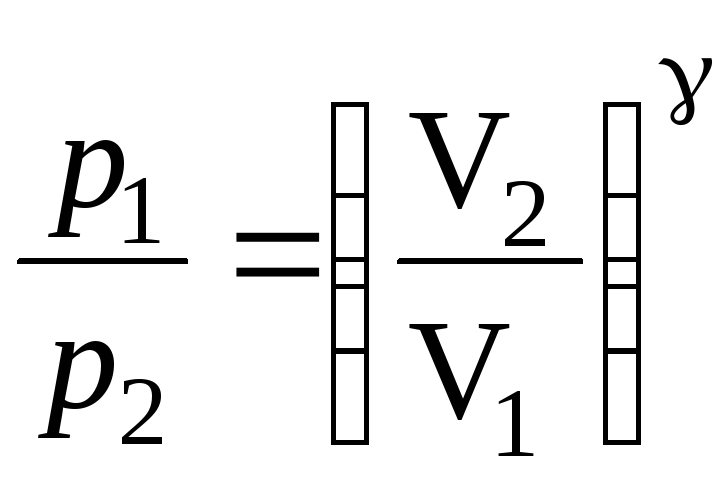 .
(21)
.
(21)
Логарифмируя полученное уравнение, находим, что
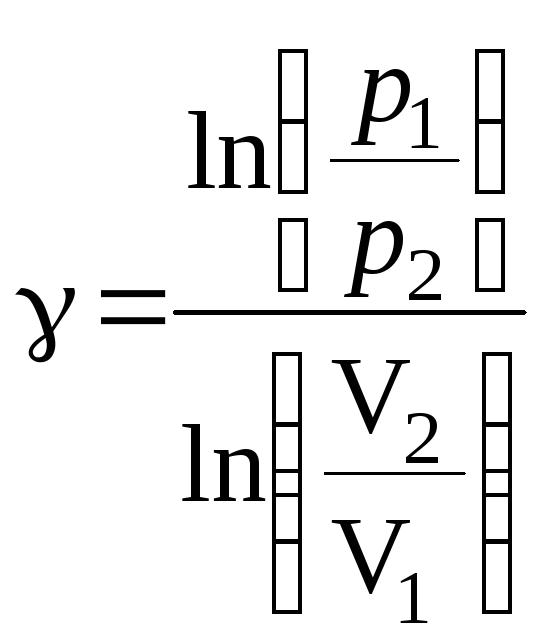 .
(22)
.
(22)
