- •Лабораторный практикум по физике
- •Введение
- •Раздел 1 механика
- •Определение ускорения свободного падения тел
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Начальные параметры траекторий
- •Контрольные вопросы
- •Движение тела под действием постоянной силы
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значения коэффициентов трения покоя
- •Результаты измерений
- •Контрольные вопросы
- •Свободные механические колебания
- •Краткая теория
- •Порядок выполнение лабораторной работы
- •Параметры эксперимента
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Упругие и неупругие соударения
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Начальные параметры
- •Результаты измерений и расчетов для абсолютно упругого удара
- •Результаты измерений и расчетов для абсолютно неупругого удара
- •Контрольные вопросы
- •Раздел 2 термодинамика и молекулярная физика
- •Адиабатический процесс
- •Краткая теория
- •Прядок выполнения лабораторной работы
- •Начальные значения температуры
- •Результаты измерений
- •Контрольные вопросы
- •Распределение молекул идеального газа по скоростям
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значения температуры газа
- •Масса одной молекулы некоторых газов
- •Контрольные вопросы
- •Изотермы реального газа
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Результаты измерений
- •Значения температуры
- •Контрольные вопросы
- •Содержание
Масса одной молекулы некоторых газов
(не перерисовывать)
|
Газ |
Водород |
Гелий |
Неон |
Азот |
Кислород |
|
Масса молекулы 10-27кг |
3,32 |
6,64 |
33,2 |
46,5 |
53,12 |
Контрольные вопросы
Какие особенности у графика функции распределения молекул по скоростям?
Что показывает числовое значение площади под кривой функции распределения молекул по скоростям? Может ли это значение быть дробным?
Запишите выражения для наиболее вероятной, средней квадратичной, средней арифметической скоростей. В чем их физический смысл? Определите процентное соотношение значений данных скоростей.
Почему для расчёта массы молекулы газа в данной лабораторной работе были справедливы формулы, приведённые в п. 6? Докажите их справедливость использования при вычислениях в данной работе.
Лабораторная работа №203
Изотермы реального газа
Цель работы:
исследовать изотермы реального газа на компьютерной модели
определить критические параметры вещества.
Приборы и принадлежности:
персональный компьютер
компьютерные модели «Открытая физика 1.1».
Краткая теория
Идеальный газ с молекулярной точки зрения представляет собой множество молекул, хаотически движущихся и несвязанных между собой. При этом предполагается, что собственный объем молекул относительно мал и его можно не учитывать, молекулы считать материальными точками, и что силы молекулярного взаимодействия между ними отсутствуют. Разреженные реальные газы (при невысоких давлениях и температурах) хорошо приближаются по свойствам к идеальному газу, так как принятые предположения достаточно точно соблюдаются. При больших давлениях возникает значительное сжатие газа и объем самих молекул становиться сравнимым с объемом газа. Кроме того, сжатие газа и сближение при этом молекул приводит к заметному проявлению сил взаимодействия. С увеличением плотности газа при обычных давлениях уменьшение межмолекулярных расстояний также вызывает проявление значительных сил притяжения.
Реальным газом называется газ, между молекулами которого существуют заметные силы межмолекулярного взаимодействия. При исследовании свойств реальных газов, особенно при высоких давлениях и больших плотностях, были обнаружены заметные отклонения.
Для реальных газов необходимо ввести поправки в уравнение состояния идеального газа, учитывающие объем молекул и силы их взаимодействия. Эти поправки были учтены голландским физиком Ван-дер-Ваальсом. Часть объема V газа занята самими молекулами. Поэтому объем, занимаемый газом, должен быть уменьшен на величину b, пропорциональную объему молекул:
![]() ,
(1)
,
(1)
где
![]() – постоянная Авогадро,
– постоянная Авогадро,![]() – диаметр молекулы. Теоретические
расчёты показывают, что величинаb
в четыре раза превосходит объем молекул.
– диаметр молекулы. Теоретические
расчёты показывают, что величинаb
в четыре раза превосходит объем молекул.
В реальных газах
имеются силы взаимного притяжения
молекул, которые действуют дополнительно
к силам внешнего давления и как бы
сжимают газ. Вследствие этого возникает
добавочное внутреннее давление ![]() ,
которое пропорционально квадрату
концентрации молекул или обратно
пропорционально квадрату объема газа:
,
которое пропорционально квадрату
концентрации молекул или обратно
пропорционально квадрату объема газа:
![]() ,
(2)
,
(2)
где
![]() ,
(3)
,
(3)
![]() –потенциальная
энергия притяжения двух молекул (
–потенциальная
энергия притяжения двух молекул (![]() ).
).
Принимая данные обстоятельства во внимание, уравнение состояния реального газа принимает следующий вид:
![]() ,
(4)
,
(4)
где а,
![]() – константы, определяемые экспериментальным
путём,
– константы, определяемые экспериментальным
путём,![]() –количество вещества,
–количество вещества,![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Исследование
уравнения (4) удобно производить,
рассматривая изотермы Ван-дер-Ваальса.
Анализируя графики
![]() на рис. 1, можно сделать три вывода.
на рис. 1, можно сделать три вывода.
При высоких температурах (например, T1, которой соответствует изотерма 1) изобара AD пересекает изотерму в одной точке. Уравнение Ван-дер-Ваальса имеет один вещественный корень, т.е. каждому значению T соответствует единственное значение объема. Из этого следует, что при высоких температурах вещество находится в однофазном – газообразном состоянии.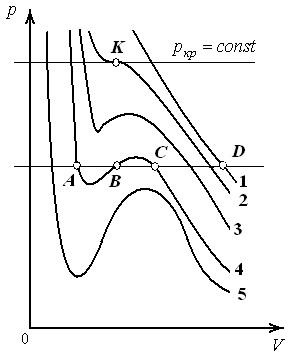
Рис. 1
Невысоким температурам соответствуют изотермы 2, 3, 4, на которых имеются перегибы. Изобара AD пересекает изотерму 4 в трех точках А, B, C. В уравнении Ван-дер-Ваальса это состояние соответствует трём вещественным значениям объема при данных p и T. Это означает, что вещество находится в трёх фазовых состояниях. Под фазой понимают совокупность всех частей системы, обладающих одинаковыми физическими и химическими свойствами.
Переход изотермы 5 к изотермам 4, 3 и т. д., соответствующий повышению температуры, приводит к тому, что изгибы на изотермах сглаживаются. Расстояние, например, между точками A и C уменьшается и уже на изотерме 2 они сливаются в одну точку – точку К перегиба. В точке перегиба изобара
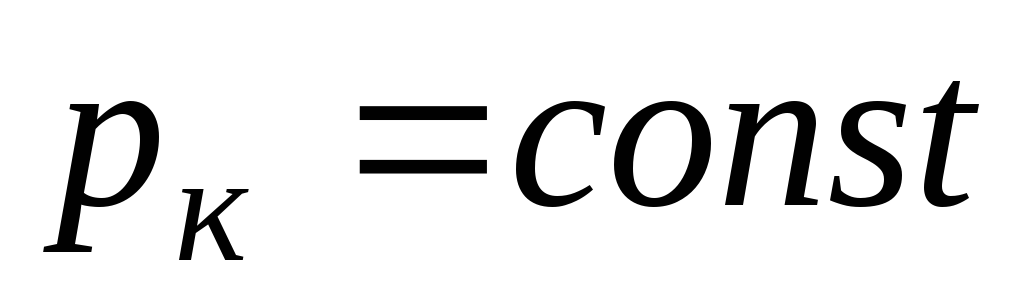 является касательной к изотерме.
ТемператураTк,
соответствующая этой изотерме называется
критической
температурой.
является касательной к изотерме.
ТемператураTк,
соответствующая этой изотерме называется
критической
температурой.
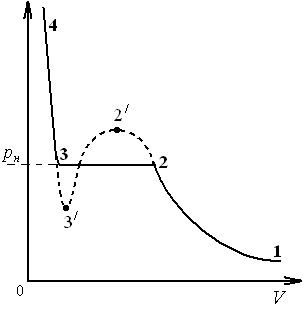
Экспериментальные изотермы (рис. 2) могут быть получены путём сжатия газа в изотермических условиях. Экспериментальные и теоретические изотермы на участках 1 – 2 и 3 – 4 с известным приближением можно считать совпадающими. При особых условиях эксперимента могут быть получены участок 2 – 2/, соответствующий пересыщенному пару, и участок 3 – 3/, относящийся к перегретой жидкости. Это малоустойчивые, метастабильные состояния.
|
|
|
Рис. 2 |
Вещество на участке 2 – 3 находиться в двухфазном состоянии, т. е. часть первоначального газообразного вещества превратилась в жидкость, а часть осталась в газообразном состоянии. Соответствующее участку 2 – 3 давление называется давлением насыщения. Точка 3 (рис. 2) соответствует состоянию, когда весь газ превращается в жидкость.
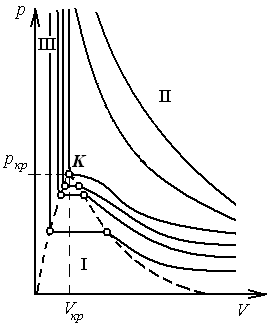
С ростом температуры участки, соответствующие двухфазному состоянию, становятся уже (рис. 3). Затем появляется изотерма, на которой этот участок превращается в точку перегиба К; ей соответствует критическая температура. При температурах ниже критической есть участок насыщения, и вещество может переходить из газообразного состояния в жидкое состояние (область I, рис. 3). Температурам выше критической соответствует только газообразное состояние (область II, рис. 3). Область III, примыкающая к оси ординат (рис. 3), относится к жидкому состоянию системы.
|
|
|
Рис. 3 |
![]() ,
,
![]() ,
,![]() ,
(5)
,
(5)
или
![]() ,
,
![]() .
(6)
.
(6)