
- •Лабораторный практикум по физике
- •Введение
- •Раздел 1 механика
- •Определение ускорения свободного падения тел
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Начальные параметры траекторий
- •Контрольные вопросы
- •Движение тела под действием постоянной силы
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значения коэффициентов трения покоя
- •Результаты измерений
- •Контрольные вопросы
- •Свободные механические колебания
- •Краткая теория
- •Порядок выполнение лабораторной работы
- •Параметры эксперимента
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Упругие и неупругие соударения
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Начальные параметры
- •Результаты измерений и расчетов для абсолютно упругого удара
- •Результаты измерений и расчетов для абсолютно неупругого удара
- •Контрольные вопросы
- •Раздел 2 термодинамика и молекулярная физика
- •Адиабатический процесс
- •Краткая теория
- •Прядок выполнения лабораторной работы
- •Начальные значения температуры
- •Результаты измерений
- •Контрольные вопросы
- •Распределение молекул идеального газа по скоростям
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значения температуры газа
- •Масса одной молекулы некоторых газов
- •Контрольные вопросы
- •Изотермы реального газа
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Результаты измерений
- •Значения температуры
- •Контрольные вопросы
- •Содержание
Распределение молекул идеального газа по скоростям
Цель работы:
исследовать законы распределения молекул газа по скоростям
определить массу молекулы газа.
Приборы и принадлежности:
персональный компьютер
компьютерные модели «Открытая физика 1.1».
Краткая теория
Газ называется идеальным, если при рассмотрении его свойств соблюдаются следующие условия: а) соударения молекул такого газа происходят как соударения упругих шаров; б) размеры молекул пренебрежимо малы; в) между молекулами не проявляются силы взаимного притяжения.
Скорости молекул
газа имеют различные значения и
направления, которые постоянно изменяются
вследствие огромного числа соударений
между молекулами газа. Невозможно
определить число молекул газа, обладающих
в данный момент времени определённой
скоростью ![]() ,
но можно посчитать число молекул,
скорости которых имеет значения, лежащие
между значениями некоторых данных
скоростей
,
но можно посчитать число молекул,
скорости которых имеет значения, лежащие
между значениями некоторых данных
скоростей ![]() и
и ![]() .
.
На основании теории
вероятности Максвелл установил
закономерность, по которой можно
определить число молекул газа, скорости
которых при данной температуре заключены
в некотором интервале скоростей. В
соответствии с законом распределения
скоростей Максвелла
число молекул, имеющих скорости в
интервале от ![]() до
до ![]() ,
равно
,
равно
![]() ,
(1)
,
(1)
где
![]() –
общее число молекул идеального газа;
–
общее число молекул идеального газа;![]() – основание натуральных логарифмов;
– основание натуральных логарифмов;![]() – относительная скорость движения
молекул;
– относительная скорость движения
молекул;![]() – скорость молекул
в данный момент времени,
– скорость молекул
в данный момент времени,
![]() –наиболее
вероятная скорость,
т.е. такая скорость, к которой близки
скорости большинства молекул газа.
–наиболее
вероятная скорость,
т.е. такая скорость, к которой близки
скорости большинства молекул газа.
Если по оси ординат отложить функцию распределения
![]() ,
,
а по оси абсцисс
скорость ![]() молекул, то функция распределения
графически изобразиться кривой,
представленной на рис. 1. Площадь
заштрихованной фигуры с основанием
молекул, то функция распределения
графически изобразиться кривой,
представленной на рис. 1. Площадь
заштрихованной фигуры с основанием
![]() показывает, какая часть от общего числа
молекул имеет скорости, лежащие в данном
интервале. Конкретный вид функции
распределения
показывает, какая часть от общего числа
молекул имеет скорости, лежащие в данном
интервале. Конкретный вид функции
распределения![]() зависит от рода
газа (массы молекул) и температуры T.
Давление и объем газа на распределение
молекул по скоростям не влияют.
зависит от рода
газа (массы молекул) и температуры T.
Давление и объем газа на распределение
молекул по скоростям не влияют.
Максимум кривой
распределения (рис. 1) соответствует
наиболее вероятной скорости
![]() .
Из закона распределения эта скорость
равна
.
Из закона распределения эта скорость
равна
![]() ,
(3)
,
(3)
где
![]() – молярная масса газа,k
– постоянная
Больцмана, R
– универсальная газовая постоянная.
– молярная масса газа,k
– постоянная
Больцмана, R
– универсальная газовая постоянная.
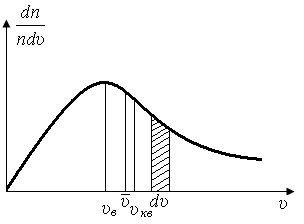
Рис. 1. Распределение Максвелла по скоростям
Кривая распределения скоростей Максвелла позволяет найти среднюю арифметическую скорость молекулы:
![]() ,
(4)
,
(4)
которая имеет расчётное значение
![]()
![]() .
(5)
.
(5)
Таким образом, существует три скорости, характеризующие состояние газа:
наиболее вероятная
![]() ,
,
средняя арифметическая
![]() ,
,
среднеквадратичная скорость
![]() .
(6)
.
(6)
Средняя квадратичная скорость молекулы газа определяется из зависимости средней кинетической энергии поступательного движения молекулы от температуры:
![]() ,
(7)
,
(7)
где
![]() – масса одной молекулы,
– масса одной молекулы,![]() = 1,38
= 1,38![]() Дж/К
– постоянная Больцмана (универсальная
постоянная отнесённая к одной молекуле).
Дж/К
– постоянная Больцмана (универсальная
постоянная отнесённая к одной молекуле).
С повышением температуры, как следует из формулы (3), наиболее вероятная скорость возрастает, поэтому максимум распределения молекул по скоростям сдвигается в сторону больших скоростей. Следовательно, с ростом температуры возрастает относительное число молекул, обладающих большими скоростями.
