
- •Физическая химия учебное пособие к лабораторным работам По курсУ «Физическая химия»
- •© Иркутский государственный университет
- •Содержание
- •Введение
- •1. Правила работЫ в химических лабораториях
- •1.1. Общие правила
- •1.2. Правила по технике безопасности
- •2. Основные понятия химии. Закон эквивалентов
- •2.1. Лабораторная работа № 1 «Определение эквивалентной массы магния»
- •3. Термохимия
- •3.1. Лабораторная работа № 2 «Определение теплоты нейтрализации»
- •3.2. Лабораторная работа № 3 «Тепловые эффекты реакций растворения»
- •4. Химическая кинетика
- •4.1. Лабораторная работа № 4 «Определение влияния концентрации веществ и температуры на скорость реакции и смещение равновесия»
- •4.2. Лабораторная работа № 5 «Определение влияния различных факторов на скорость химических реакций и смещение равновесия»
- •4.3. Лабораторная работа № 6 «Изучение влияния различных факторов на скорость химических реакций и смещение равновесия»
- •5. Поверхностные явления. Адсорбция
- •(А) колоночная; (б) газовая; (в) тонкослойная
- •5.1. Лабораторная работа № 7 «Изучение явления адсорбции»
- •5.2. Лабораторная работа № 8 «Адсорбция уксусной кислоты углем»
- •5.3. Лабораторная работа № 9 «Хроматографическое разделение аминокислот»
- •6. Взаимная растворимость жидкостей. Закон распределения. Экстрагирование
- •6.1. Лабораторная работа № 10 «Изучение процесса экстрагирования»
- •7. Рефрактометрия
- •7.1. Лабораторная работа № 11 «Рефрактометрическое определение массовой доли растворенного вещества в растворе»
- •7.2. Лабораторная работа № 12 «Определение строения молекулы и ее полярности по молекулярной поляризации и рефракции»
- •7.3. Лабораторная работа № 13 «Определение концентрации растворенного вещества»
- •8. Оптические методы. СветопоглОщение
- •8.1. Лабораторная работа № 14 «Фотометрическое определение содержания углерода в растворах глюкозы»
- •9. Потенциометрическое титрование
- •9.1. Лабораторная работа № 15 «Потенциометрическое определение рН растворов»
- •9.2. Лабораторная работа № 16 «Определение содержания щелочи и соды при совместном присутствии»
- •9.3. Лабораторная работа № 17 «Построение кривой титрования»
- •10. Электролиз
- •Закономерности катодных процессов
- •Закономерности анодных процессов
- •10.1. Лабораторная работа № 18 «Электролиз солей»
- •11. Коррозия металлов
- •11.1. Лабораторная работа № 19 «Коррозия металлов и методы защиты»
- •Давление насыщенного водяного пара при различных температурах
- •Показатели преломления жидкостей при 20 оС
- •Атомные рефракции rd
- •Инкрименты связей и циклов
- •Диэлектрическая проницаемость (ε) жидкостей
- •Кислотно-основные индикаторы
- •Стандартные электродные потенциалы Eo некоторых металлов (ряд напряжений)
- •Рекомендуемая литература
- •Библиографический список
- •Физическая химия учебное пособие к лабораторным работам
3.1. Лабораторная работа № 2 «Определение теплоты нейтрализации»
Цель работы. Научиться пользоваться техническими весами и работе с лабораторными термометрами. Определить теплоту нейтрализации сильной кислоты сильным основанием.
Приборы и реактивы. Химический стакан. Мерные цилиндры. Термометр. Растворы: 0,1 М HCl; 0,1 М NaOH.
Порядок выполнения работы
1. На технических весах взвесить и определить массу химического стакана.
2. Отмерить мерным цилиндром 25 мл 0,1 М раствора NaOH и перелить в химический стакан. Измерить температуру раствора щелочи с точностью до 0,1 оС.
3. Отмерить мерным цилиндром 25 мл 0,1 М раствора HCl. Быстро влить кислоту в химический стакан со щелочью, перемешать содержимое стеклянной палочкой или на магнитной мешалке и отметить максимальную температуру, которую покажет термометр после объединения растворов.
4. Определение повторить два раза и взять для дальнейших расчетов средний результат.
5. По результатам опыта заполнить таблицу.
|
Масса калориметрического стакана m, кг |
Объем жидкости в калориметрическом стакане V, мл |
Температура t, оС | |
|
начальная |
конечная | ||
|
|
|
|
|
|
|
|
|
|
6. Записать уравнение
реакции нейтрализации в молекулярном
и ионном виде между реагирующими
веществами и рассчитать
![]() ,
пользуясь следствием из закона Гесса.
,
пользуясь следствием из закона Гесса.
![]() ,
,
зная, что
![]() ;
;![]() кДж/моль;
кДж/моль;
![]() кДж/моль.
кДж/моль.
7. По полученным данным определить:
1) разницу температур: ∆t = tк – tн, K;
2) массу жидкости в калориметрическом стакане: m = ρ∙V, если
ρр–ра = 1,0 г/мл;
3) теплоемкость системы (∑С):
∑С = С1m1 + C2m2; [Дж/K],
где m1 и m2 – массы калориметрического стакана и жидкости в стакане, кг;
С1 и С2 – удельные теплоемкости стекла и жидкости.
Сстекла = 0,75∙103 Дж/кг∙K; Сжидкости = 4,18∙103 Дж/кг∙K;
4) количество теплоты Q, выделившейся при реакции
Q = ∑C∙∆t; [Дж];
5) число молей воды, учитывая, что из 1 моля щелочи получается 1 моль воды, а СNaOH = СHCl = 0,1 моль/л
![]() моль;
моль;
6) практическое изменение энтальпии реакции нейтрализации, кДж/моль
![]() ;
;
7) ошибку опыта α, % по формуле
α =
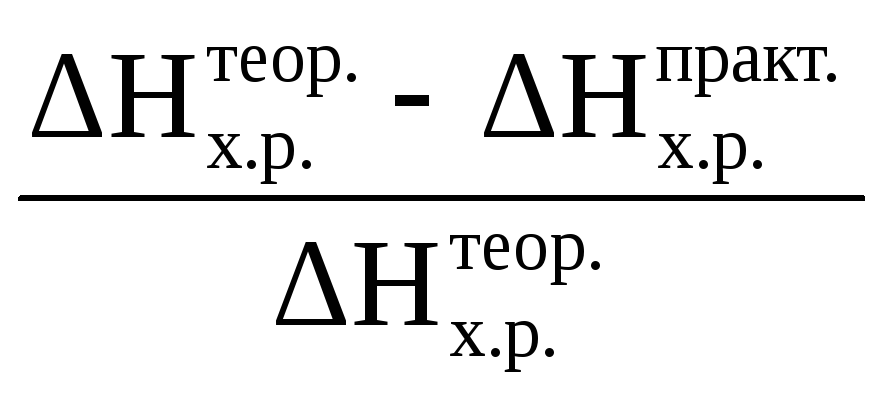 ∙100,
%;
∙100,
%;
8) изменение энтропии
реакции нейтрализации,
![]() ,
для чего воспользуемся следствием из
закона Гесса и табличными значениями
,
для чего воспользуемся следствием из
закона Гесса и табличными значениями
![]() ;
;
![]() ;
;
![]() Дж/моль∙K;
Дж/моль∙K;
![]() Дж/моль∙K;
Дж/моль∙K;
9) изменение энергии Гиббса ∆Gх.р. реакции нейтрализации по формуле
![]() S
S![]() ,
,
где Т – начальная температура, K.
8. Сделать вывод о соответствии величины и знака ∆Gх.р. самопроизвольному течению проделанной Вами реакции нейтрализации.
3.2. Лабораторная работа № 3 «Тепловые эффекты реакций растворения»
Цель работы. Экспериментально определить тепловые эффекты реакций растворения веществ. Составить термохимические уравнения.
Приборы и реактивы.
Технические
весы. Термометр. Химические стаканы.
Мерные цилиндры. Конические колбы.
Стеклянные палочки.![]() Медный
купорос (CuSO4).
Цинковая пыль (Zn).
Хлорид натрия (NaCl).
Нитрат аммония (NH4NO3).
Гидроксид натрия (NaOH).
Вода дистиллированная.
Медный
купорос (CuSO4).
Цинковая пыль (Zn).
Хлорид натрия (NaCl).
Нитрат аммония (NH4NO3).
Гидроксид натрия (NaOH).
Вода дистиллированная.
Порядок выполнения работы
Опыт 1. Определение теплового эффекта реакции замещения меди из раствора ее соли цинком.
1. Взвесить на технических весах 5 г медного купороса и растворить в 50 мл воды. Замерить и записать температуру полученного раствора (Тн).
2. Взвесить 1 г цинковой пыли и всыпать ее в раствор сульфата меди.
3. При помощи термометра определить максимальную температуру раствора (Тк). Количество выделившегося при реакции тепла рассчитать по формуле:
![]() ,
,
где ∆T – изменение температуры раствора (∆T = Tк – Tн), K;
C – удельная теплоемкость, Cводы = 4,18 кДж/кг∙K;
m – масса веществ, кг.
4. Полученный результат пересчитать на 1 моль цинка и записать термохимическое уравнение данной реакции.
Опыт 2. Тепловые явления при растворении твердых веществ.
1. Налить в три стакана или колбы по 25 мл воды. Измерить температуру воды (Тн).
2. Взвесить на технических весах по 5 г хлорида натрия, нитрата аммония и гидроксида натрия.
3. Всыпать: в первый стакан хлорид натрия, во второй – нитрат аммония, в третий – гидроксид натрия (осторожно).
4. Навески веществ размешать в воде до полного растворения и измерить температуры полученных растворов (Тк).
5. По полученным данным рассчитать количество выделившейся или поглощенной при реакции теплоты по формуле:
![]() ,
,
где ∆T – изменение температуры раствора, K (∆T = Тк – Тн);
m1 – масса воды, кг;
m2 – масса кристаллического вещества, кг;
C – теплоемкость воды, C = 4,18 кДж/кг∙K.
6. Полученный результат пересчитать на 1 моль кристаллического вещества, раствор которого готовили, и записать термохимическое уравнение данного процесса.
7. По полученным данным заполнить таблицу.
|
Вещество |
Температура Т, оС |
Q, кДж |
Выводы* | ||
|
начальная |
конечная |
∆Т | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Указать, является ли данный процесс растворения термохимическим, если да, то эндотермическим или экзотермическим.
8. По работе сделать вывод.
