
ОБЩАЯ ЭНЕРГЕТИКА_учебное пособие.pdf 5 семестр
.pdfответствует заданию составом по объему, так как мольная доля компонента равна его объемной доле.
9.2. Закон Дальтона
Основным физическим законом, определяющим состояние смеси газов, является закон Дальтона, по которому давление смеси газов, не взаимодействующих химически, равно сумме давлений отдельных компонентов, занимающих весь объем V смеси при температуре Т смеси. Давление рi отдельного компонента в смеси называется парциальным давлением. Полное давление р смеси равно сумме парциальных давлений:
n
p = p1 + p2 + … + pn = pi .
1
По уравнению для отдельного компонента в полном объеме смеси
рiV = miRiT,
где mi и Ri - масса и газовая постоянная отдельного компонента.
Если поместить отдельный компонент смеси в объем Vi, в котором давление и температура компонента равны давлению и температуре смеси, то
рVi = miRiT.
Объем Vi называется парциальным объемом. Из двух последних равенств следует, что
рiV = рVi.
Следовательно, парциальное давление отдельного компонента
рi = рVi / V = pri . |
(9.3) |
9.3. Средняя молекулярная масса и газовая постоянная смеси
Между массовыми и объемными долями смеси имеет место следующая зависимость:
gi = mi / m = Viρi / Vρ = riρi / ρ.
Следовательно,
gi = riρi / ρ и ri = giρ / ρi.
По закону Авогадро μυ =const, поэтому
μ / ρ = μi / ρi |
или ρi / ρ = |
μi / μ . |
|
При этом |
|
|
|
gi = ri |
μi / μ и ri = gi |
μ / μi. |
(9.4) |
|
|
|
41 |

|
|
|
n |
|
n |
|
Просуммировав эти равенства от 1 до |
n с учетом gi |
1 и |
ri |
1, полу- |
||
чим молекулярную массу: |
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|
n |
μ. |
1 |
|
|
|
|
μ = ri μ i и |
|
|
|
|
(9.5) |
|
n |
|
|
||||
1 |
gi /μi |
|
|
|
1 |
По (9.5) можно определить среднюю молекулярную массу смеси. Зная молекулярную массу смеси, по (9.4) можно пересчитать массовый состав на объемный и наоборот.
Пересчет массового состава на объемный производится по формуле
n
ri = gi μ / μi = (gi / μi) gi / i ,
1
а пересчет объемного состава на массовый по формуле
n
gi = ri μi / μ = ri μi ri i .
1
Газовая постоянная смеси может быть определена по составу смеси и газовым постоянным отдельных компонентов. Так как μR = const (универсальная газовая постоянная), то μiRi = μR и μi / μ = R / Ri или μ / μi = Ri / R.
Это позволяет равенства (9.4) представить в следующем виде:
gi = ri R / Ri и ri = gi Ri / R.
Суммируя правые и левые части этих равенств от 1 до n, получим
n |
|
n |
R = 1 ri /Ri |
|
и R = giRi . |
1 |
|
1 |
Газовую постоянную смеси можно определять по формуле, справедливой для отдельного компонента, используя значения молекулярной массы смеси
R = 8314,3 / μ.
9.4. Теплоемкость смеси газов
Теплоемкость смеси газов определяется по ее составу. Массовая теплоемкость смеси
n
c = g1c1 + g2c2 + … + gncn = gici ,
1
где с1, с2, ... , сn - массовые теплоемкости отдельных компонентов; g1, g2, … , gn - доли компонентов по массе.
Объемная теплоемкость смеси
n
C = r1С1 + С2r2 + … + Сnrn = riCi ,
1
42
где ri и Сi - соответственно доли компонентов по объему и объемные теплоемкости отдельных компонентов.
9.5. Определение параметров смеси при смешивании отдельных газов в объеме, равном сумме смешиваемых объемов
Пусть отдельные объемы Vi и параметры состояния отдельных газов рi и Тi в этих объемах известны. Требуется определить давление р и температуру Т смеси.
Так как при смешивании отдельные компоненты не производят работу (смешивание происходит в общем постоянном объеме), то внутренняя энергия смеси равна сумме внутренних энергий смешиваемых газов.
Принимая за уровень отсчета внутренней энергии 0 К, можно записать:
n |
|
micυi Ti = mсυT, |
(9.6) |
1 |
|
где mi, сυi, Тi - соответственно масса, изохорная теплоемкость и температура отдельных компонентов смеси; m, сυ, T - соответственно масса, теплоемкость и температура смеси.
Из равенства (9.6)
|
n |
|
|
T = micυi Ti /mcυ . |
|
|
1 |
|
|
n |
n |
|
сυ = gi cυi |
|
Так как |
= mi /mcυi , |
|
|
1 |
1 |
|
|
n |
то |
mсυ = mi cυi . |
|
|
|
1 |
Следовательно,
n n
T = micυiTi / micυi .
1 1
Масса отдельного компонента
mi = рiVi / RiTi.
n
Давление смеси определяется по уравнению для полного объема V= Vi ,
1
pV = mRT.
Следовательно,
|
p = mRT / V. |
|
n |
n |
|
. Таким образом, с учетом V = Vi |
||
Произведение mR = miRi |
||
1 |
1 |
43

n |
n |
n |
n |
|
p = miRi |
Vi micυiTi |
micυi |
. |
|
1 |
1 |
1 |
1 |
|
При смешивании газов одинаковой атомности или когда в смеси преобладают газы одинаковой атомности
|
|
|
|
n |
|
n |
n pV |
piVi |
|||
T = piVi |
|
i i |
; р = |
1 |
. |
|
|||||
|
n |
||||
1 |
1 Ti |
Vi |
|||
|
|
||||
|
|
|
|
1 |
|
10.ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
10.1.Классификация основных термодинамических процессов
Вобщем случае в термодинамическом процессе могут изменяться три параметра состояния. Особое значение при теоретическом исследовании и практическом использовании явлений энергетического воздействия на рабочее тело тепловых двигателей, холодильных машин, компрессоров и других теплотехнических устройств имеют термодинамические процессы, происходящие при определенных ограничениях, например при постоянстве одного из параметров состояния, при отсутствии внешнего теплообмена рабочего тела с окружающей средой, при постоянстве теплоемкости рабочего тела и др.
Основными термодинамическими процессами в технической термодинамике приняты изохорный (при постоянном объеме), изобарный (при постоянном давлении), изотермический (при постоянной температуре), адиабатный (без внешнего теплообмена), политропный (при постоянной теплоемкости газа).
Состояние рабочего тела в каждый момент термодинамического процесса должно удовлетворять уравнению состояния идеального газа. Соотношение между теплотой процесса, изменением внутренней энергии рабочего тела и совершаемой или получаемой им работой должно соответствать первому закону термодинамики. Поэтому исследование термодинамических процессов базируется на уравнениях состояния идеального газа и первого закона термодинамики. Необходимо составить уравнение термодинамического процесса, установить характер изменения внутренней энергии в процессе, получить математические выражения для определения механической и располагаемой работы процесса, а также количества внешней теплоты, подводимой или отводимой в процессе. Для каждого процесса устанавливают соотношение между параметрами состояния в начале и конце процесса и представляют графическое изображение в рυ-координатах. Графики основных термодинамических процессов соответственно называются изохо-
рой, изобарой, изотермой, адиабатой и политропой.
10.2.Изохорный процесс
Изохорный процесс происходит при нагревании или охлаждении газа в постоянном объеме. Это может быть цилиндр с неподвижным поршнем или резервуар постоянного объема.
44

Уравнение изохорного процесса υ = const. Соотношение между параметрами состояния в изохорном процессе в соответствии с законом Шарля для идеальных газов
p1 /T1 = p2/T2.
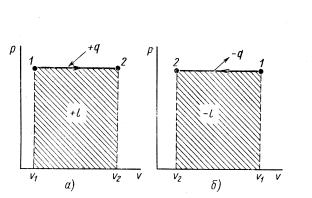
В рυ- координатах изохорный процесс изображают отрезком прямой, параллельной оси ординат (рис. 10.1). При нагревании газа его давление и температура повышаются, а при охлаждении уменьшаются.
а б
Ри с. 10.1. Диаграмма изохорного процесса:
а– с подводом теплоты; б- с отводом теплоты
Механическая работа l газа в изохорном процессе равна нулю, так как нет изменения объема:
υ2
υ = const; dυ = 0; pdυ= 0.
υ1
По первому закону термодинамики теплота изохорного процесса
q Δu l Δu.
Так как l =0, то подводимая к газу теплота идет на изменение его внутренней энергии. Поэтому в изохорном процессе с подводом теплоты внутренняя энергия газа, а следовательно, и его температура повышаются, а в процессе с отводом теплоты - снижаются. При теплоемкости тела, не зависящей от температуры, теплота q изохорного процесса
q cυ(T2 T1 ). |
(10.1) |
Из равенства (10.1) следует, что изменение внутренней энергии
Δu u2 u1 cυ (T2 T1 ).
Так как изменение внутренней энергии не зависит от характера процесса, то по данной формуле можно определять изменение внутренней энергии в любом термодинамическом процессе.
45
10.3. Изобарный процесс
Изобарный процесс происходит при нагревании или охлаждении газа с постоянным давлением. Такой процесс может быть получен в цилиндре с поршнем, на который действует постоянная нагрузка. Уравнение изобарного процесса р=const. При изобарном подводе теплоты объем газа и его температура увеличиваются, при отводе - уменьшаются. По закону Гей-Люссака изменение объема газа в процессе с постоянным давлением прямо пропорционально изменению его абсолютной температуры, т. е.
υ2/υ1 T2/T1 .
Изменение внутренней энергии в изобарном процессе
u c (T2 T1).
В рυ-координатах изобарный процесс изображается отрезком прямой, параллельной оси абсцисс (рис. 10.2).
Работа газа в изобарном процессе
l p υ2 υ1 R T2 T1 ,
так как по уравнению состояния рυ = RТ.
Учитывая, что р2= р1, располагаемая работа 10 в изобарном процессе
l0 υ(p2 p1 ) 0.
Теплота, необходимая для совершения процесса, по первому закону термодинамики
q Δu l cυ(T2 T1 ) R(T2 T1 ) cp(T2 T1 ).
Ри с. 10.2. Диаграмма изобарного процесса:
а- с подводом теплоты; б – с отводом теплоты
46

10.4. Изотермический процесс
Изотермический процесс происходит при расширении или сжатии газа при постоянной температуре, т. е. при постоянной внутренней энергии. Для получения постоянной температуры при расширении газа необходимо подвести теплоту, а при сжатии отвести, так как в процессе расширения газ совершает полезную работу, а в процессе сжатия работа совершается над газом. Уравнение изотермического процесса pυ = const. В pυ - координатах изотермический процесс соответствует отрезку равнобокой гиперболы (рис. 10.3), чем выше температура, тем выше
(или правее) лежит изотерма. |
|
|
|
|
|
Соотношение между начальными и |
конечными |
переменными параметрами |
|||
в процессе вытекает из его уравнения (pυ = const): |
|
|
|
||
p1υ1 = p2υ2 |
или |
p2/p1 = υ2/υ1. |
|
|
|
Так как температура в изотермическом процессе не изменяется, то не изменя- |
|||||
ется и внутренняя энергия газа, т. е. |
u = 0. |
|
|
|
|
Работа газа в изотермическом процессе |
|
|
|
||
l RTln(υ2 /υ1 |
) RTln(p1/p2 ). |
|
|
||
Так как по уравнению (1) RT = pυ, |
то формула для определения работы |
||||
может иметь несколько вариантов. |
|
|
|
q = l, |
|
Теплота изотермического процесса по первому закону термодинамики |
|||||
так как в изотермическом процессе u = 0. |
|
|
|
||
Располагаемая работа 10 в изотермическом |
процессе |
равна механиче- |
|||
ской работе, так как изотерма в pυ-координатах представляет |
равнобокую |
ги- |
|||
перболу (pυ = const): |
|
|
|
|
|
l0 RTln(υ2 /υ1 ) RTln(p1/p2 ). |
|
|
|||
.
Ри с. 10.3. Диаграмма изотермического процесса:
а- с подводом теплоты; б - с отводом теплоты
10.5. Адиабатный процесс
Адиабатный процесс происходит при расширении или сжатии газа без внешнего теплообмена. Уравнение адиабаты pυk = const. Так как k всегда больше единицы, то в рυ - координатах адиабата соответствует отрезку смещенной гипербо-
47

лы, проходящей круче изотермы (рис. 10.4). При изотермическом расширении газ совершает работу, равную подводимой теплоте. Температура газа не изменяется. Так как pυ = const, то при увеличении объема давление понижается по закону гиперболы. При адиабатном расширении также совершается полезная работа, но теплота к газу не подводится и работа совершается за счет внутренней энергии газа. Температура газа понижается. Это приводит к более быстрому, чем в изотермическом процессе, понижению давления газа.
Ри с. 10.4. Диаграмма адиабатного процесса:
а- с уменьшением внутренней энергия;
б- с увеличением внутренней энергии
Таким образом, адиабатное расширение газа происходит с увеличением объема и уменьшением давления и температуры. При адиабатном сжатии изменение этих параметров состояния обратное.
Соотношение между параметрами состояния в адиабатном процессе может быть получено по уравнению адиабаты с учетом уравнения (1):
p2 /p1 (υ1 /υ2 )k ; |
T2 /T1 (υ1/υ2 )k 1; T2 /T1 |
(p2/p1 )(k 1)/k. |
Работа газа в адиабатном процессе
lΔu cv (T1 T2 ), так как q = 0.
Сучетом формулы (8.5), получим
l R(T1 T2 ) /(k 1).
Так как RT = pυ, то
l (p1υ1 p2υ2 )/(k 1).
Механическая работа в адиабатном процессе
(k 1)/k (k 1)/k .
l p1υ1 1 (p2/p1 ) RT1 1 (p2/p1 )
Располагаемая работа в адиабатном процессе в k раз больше механической, т.
е. l0 = kl.
48

10.6. Политропные процессы
Политропными процессами называются процессы, происходящие при постоянной теплоемкости и удовлетворяющие уравнению pυn = const, где n - показатель политропы; он может быть любым, но постоянным для данного процесса числом (все рассмотренные ранее процессы являются частными случаями политропных процессов).
Уравнение политропы pυn = const можно представить и в виде
1
p nυ const.
При определенных значениях n уравнение политропы соответствует уравнениям четырех основных термодинамических процессов:
n ; υ const;
n 0; p const;
n 1; pυ const;
n k; pυk const.
Так как уравнение политропного процесса сходно с уравнением адиабатного процесса, то соотношения между параметрами состояния в политропном процессе будут такими же, как в адиабатном:
p |
2 |
/p |
1 |
(υ |
1 |
/υ |
2 |
)n ; |
T /T (υ /υ )n 1 |
; |
T T |
1 |
( p |
2 |
p |
1 |
)(n 1) n . |
|||
|
|
|
|
|
2 |
1 |
1 |
2 |
|
2 |
|
|
|
|||||||
Аналогичным будет и уравнение работы газа в политропном процессе:
l = (p1υ1 p2υ2 ) (n 1) R(T1 T2 )
(n 1) R(T1 T2 ) (n 1).
(n 1).
Располагаемая работа политропного процесса l0 nl . Так как сν R (k 1) и R=cν (k 1), теплота политропного процесса по первому закону термодинамики
(k 1) и R=cν (k 1), теплота политропного процесса по первому закону термодинамики
q =Δu l cν(T2 T1 ) R(T1 T2 ) (n 1) cν [(n k) (n 1)](T2 T1 ). |
(10.2) |
Теплота политропного процесса |
|
q = c(T2 T1 ), |
(10.3) |
где с - теплоемкость политропного процесса. Из сравнения равенств (10.2) и (10.3) следует, что
c=cν [(n k) (n 1)]. |
(10.4) |
|
49 |

Из уравнения (10.4)
n=(с сp ) (с сν ). |
(10.5) |
Если все рассмотренные термодинамические процессы представить в системе координат pυ (рис. 10.5), то можно установить следующее. Термодинамические процессы (процессы расширения) при - <n<1 характеризующиеся кривыми, расположенными на рисунке выше изотермы (n = 1), протекают с повышением температуры, а при 1<n<+ - с понижением температуры. Следовательно, семейство политропных процессов по знаку температуры подразделяется на две группы.
Процессы расширения при - <n<k характеризуются кривыми, расположенными выше адиабаты (n=k), и происходят с подводом теплоты, а процессы расширения при k<n<+ - с отводом теплоты. Следовательно, семейство политропных процессов по знаку теплоты также подразделяется на две группы.
Необходимо учитывать, что знаки изменения температуры, теплоты и работы при переходе от процесса расширения к процессу сжатия изменяются на обратные. Например, в процессе расширения между изобарой и изотермой температура повышается (знак +), теплота подводится (знак +) и работа положительная (знак +). В обратном процессе (сжатия) температура понижается (знак - ), теплота отводится (-) и работа отрицательная (-).
Р и с. 10.5. Диаграмма политропных процессов
Политропные процессы при 1<n<k имеют различные знаки изменения температуры и теплоты. Это значит, что если в таком процессе расширения к газу подводится теплота, то температура его понижается, так как совершаемая газом работа больше подводимой теплоты и на совершение работы затрачивается часть внутренней энергии. Для аналогичного процесса сжатия, наоборот, если работа сжатия больше отводимой теплоты, то температура тела повышается. Политропные процессы этой группы при 1<n<k происходят при отрицательной теплоемкости рабочего тела. Так как теплоемкость с=dq/dT, то при различных знаках dq и dT теплоемкость процесса отрицательна. По уравнению (10.4) при значениях n,
50
