
ОБЩАЯ ЭНЕРГЕТИКА_учебное пособие.pdf 5 семестр
.pdf
соответствующих частным случаям политропных процессов, можно определить теплоемкость для основных термодинамических процессов.
Если уравнение |
(10.4) представить в виде с =cν (1 k n) (1 1 n), то при |
n= (υ const) и c=c |
получим теплоемкость изохорного процесса; при n = 0 (p |
=const) по (10.4) c=c p - теплоемкость изобарного процесса, при n = 1 (p =const)
и с = - теплоемкость изотермического процесса, а при n = k (pυk const ) и с = 0 - теплоемкость адиабатного процесса.
Теплоемкость изотермического процесса равна бесконечности: теплота подводится (при расширении) или отводится (при сжатии), но изменения температуры не происходит. Так как cm q ΔT , то при T = 0 теплоемкость равна бесконечности. В адиабатном процессе теплообмена не происходит, q=0, поэтому теплоемкость cm 0.
ΔT , то при T = 0 теплоемкость равна бесконечности. В адиабатном процессе теплообмена не происходит, q=0, поэтому теплоемкость cm 0.
Основные термодинамические процессы являются частным случаем политропных процессов. Теплоемкость политропных процессов изменяется от - до +. Однако в определенном политропном процессе она должна быть постоянной.
Так как показатель политропы по (10.5) обусловлен теплоемкостью с, то показатель политропы может иметь любую величину в пределах - и + . В рассматриваемом термодинамическом процессе этот показатель должен быть постоянным.
Определение изменения энтальпии в термодинамическом процессе. Эн-
тальпия i=u+p . Для идеального газа i = u + RT. Изменение энтальпии в термодинамическом процессе
Δi i2 i1 u2 u1 R(T2 T1 ) cν (T2 T1 ) R(T2 T1 ).
Так как cν R cp , то
Δi cp(T2 T1 ).
11.ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
11.1.Основные положения второго закона термодинамики
Второй закон термодинамики устанавливает направление протекания самопроизвольных тепловых процессов в природе и определяет условия превращения теплоты в работу. Он утверждает, что теплота в природе самопроизвольно переходит только от тел более нагретых к телам менее нагретым. Второй закон термодинамики не является абсолютным законом (как первый закон термодинамики), он является опытным статистическим законом и справедлив только для тел, содержащих большое число молекул. Для тел, имеющих малое число молекул, он может нарушаться. В таких системах возможно самопроизвольное повышение температуры отдельных частей объема, что может быть вызвано значительной вероятностью одновременной концентрации молекул с большей энергией в одной части объема и с меньшей энергией - в другой. Но в макросистемах такое явление
51
практически не может наблюдаться, так как, несмотря на то, что оно теоретически возможно, но вероятность его бесконечно мала.
Вотношении превращения теплоты в механическую работу второй закон термодинамики устанавливает следующее условие. Для превращения теплоты в работу необходимо иметь два тела с различными температурами. Более нагретое тело является источником теплоты для получения работы, менее нагретое - теплоприемником.
Всоответствии со вторым законом термодинамики теплота горячего источника может превращаться в работу только частично, так как процесс превращения теплоты в работу обязательно сопровождается переходом части теплоты к теплоприемнику. При этом КПД теплового двигателя всегда меньше единицы. Это условие превращения теплоты в работу иногда называют невозможностью создания вечного двигателя второго рода.
Вечный двигатель первого рода - это такой двигатель, который производит работу без затраты энергии, что противоречит первому закону термодинамики. Вечный двигатель второго рода - это двигатель, который всю подводимую к нему теплоту превращает в работу (КПД = 1). Это противоречит второму закону термодинамики. Поэтому вечный двигатель второго рода также невозможен, как и вечный двигатель первого рода.
11.2. Цикл теплового двигателя
Превращение теплоты в механическую работу в тепловом двигателе происходит в процессе расширения рабочего тела. После совершения процесса расширения запас энергии в рабочем теле уменьшается, а объем его увеличивается. Для непрерывного получения работы после каждого процесса расширения требуется возвращать рабочее тело в исходное состояние. Для этого необходимо сжимать рабочее тело до начального объема и восстанавливать его энергию до начального состояния посредством подвода теплоты. Однако процесс возвращения рабочего тела в исходное состояние нельзя совершить без отвода теплоты теплоприемнику, поэтому в полезную работу в результате совершения всей совокупности процессов расширения и сжатия превращается только часть подводимой теплоты. Совокупность процессов расширения и сжатия, в результате которых получается полезная работа и рабочее тело возвращается в исходное состояние, называется циклом теплового двигателя или прямым циклом. В цикле теплового двигателя, представляющем, в pυ-координатах замкнутый контур термодинамических процессов, совершаемых по часовой стрелке, на одних участках будет подводиться теплота и на других отводиться. Участки с подводом и отводом теплоты можно выделить проведением касательных адиабат к кривой, характеризующей термодинамический цикл (рис. 11.1). Подводимая в цикле теплота обозначается Q1, а отводимая - Q2 . Так как рабочее тело после совершения цикла возвращается в исходное состояние, то изменение внутренней энергии рабочего тела в цикле равно нулю. Поэтому разность между подводимой и отводимой теплотой превращается в полезную работу цикла:
52

L Q1 Q2
или для 1 кг рабочего тела
l q1 q2 .
Полезная работа цикла в p -координатах изображается площадью, ограниченной совокупностью кривых, характеризующих цикл.
Основной характеристикой цикла теплового двигателя является его термический коэффициент полезного действия (КПД):
ηt L Q1 (Q1 Q2 ) Q1 1 Q2 Q1 . |
(11.1) |
Для 1 кг рабочего тела
ηt 1 q2  q1 .
q1 .
11.3. Цикл холодильной машины
Самопроизвольный переход теплоты от менее нагретого тела к более нагретому невозможен. Такой процесс требует затраты определенного количества энергии. Перенос теплоты от менее нагретого тела к более нагретому возможен при совершении обратного цикла или цикла холодильной машины (рис. 11.2).
Цикл холодильной машины должен совершаться таким образом, чтобы процессы с подводом теплоты осуществлялись при низкой температуре, а процессы с отводом теплоты - при более высокой.
Р и с. 11.1. Диаграмма |
Р и с. 11.2. Диаграмма |
прямого цикла |
обратного цикла |
В pυ-координатах такой цикл изображается замкнутым контуром; он совершается против часовой стрелки. Ограничив цикл двумя касательными адиабатами, можно выделить в цикле участки с подводом теплоты Q2 и отводом теплоты Q1. Для совершения такого цикла необходимо затратить работу
L Q1 Q2.
Основной характеристикой цикла холодильной установки является холодильный коэффициент , представляющий отношение теплоты Q2 к величине затрачиваемой работы L:
ε Q2 |
L Q2 |
(Q1 Q2 ). |
(11.2) |
Отводимая в цикле теплота Q1 Q2 L.
53

11.4.Идеальный цикл теплового двигателя
В1824 г. французский инженер Сади Карно рассмотрел цикл теплового двигателя, названный впоследствии его именем. Цикл Карно состоит из двух изотерм
сподводом и отводом теплоты и двух адиабат (расширения и сжатия). Из начального состояния, соответствующего точке а на рис. 11.3, а, в цикле Карно газ изо-
термически расширяется с увеличением объема от υa до υb. При этом к газу от внешнего источника с температурой Т1 подводится теплота
q1 RT1 ln(υb  υa ).
υa ).
В точке b подвод теплоты к рабочему телу прекращается и газ адиабатно расширяется с увеличением объема от υb до υc.Для повторения процесса расширения необходимо рабочее тело возвратить в исходное состояние (точка а). Для этого газ сначала сжимается изотермически с отводом теплоты q2 при более низкой температуре цикла Т2 с уменьшением объема от υс до υd и далее адиабатно, т. е. без теплообмена до возвращения рабочего тела в исходное состояние.
Отводимая в цикле теплота по абсолютной величине
q2 RT2 ln(υc  υd ).
υd ).
Полезная работа цикла
l q1 q2 RT1 ln(υb 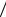 υa )-RT ln(υc
υa )-RT ln(υc 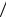 υd ).
υd ).
Термический КПД цикла
ηt 1 q2  q1 1 (T2
q1 1 (T2  T1 )[ ln(υc
T1 )[ ln(υc  υd )/ln(υb
υd )/ln(υb  υa )].
υa )].
Для адиабатных процессов b-с и d-а, в которых Tc Td T2 и Ta Tb T1 , тогда
T2  T1 (υb
T1 (υb  υc )k 1 (υa
υc )k 1 (υa  υd )k 1.
υd )k 1.
Следовательно,
υb υc υa υd |
или υc υd υb υa . |
При этом
ηt 1 T2  T1.
T1.
Из полученной формулы следует, что термический КПД цикла Карно не зависит от природы рабочего тела, а зависит только от предельных значений температур в цикле.
Термический КПД любого термодинамического цикла, составленного из обратимых процессов, в котором подвод и отвод теплоты происходит при переменных температурах
ηt 1 Tсротв  Tсрподв ,
Tсрподв ,
где Tсротв — средняя температура в процессе отвода теплоты Q2 ;
Tсрподв — средняя температура в процессе подвода теплоты Q1 .
54

Так как средняя температура подвода теплоты |
Tподв <T |
, а Tотв >T , то КПД |
||||
|
|
|
ср |
max |
ср |
min |
любого цикла, совершаемого в тех |
же граничных температурах, |
что и цикл |
||||
Карно, меньше, так как |
|
|
|
|
|
|
ηk 1 T T 1 T T . |
|
|
|
|||
t |
2 1 |
min |
max |
|
|
|
Цикл Карно является эталоном для оценки степени совершенства других термодинамических циклов. Степень совершенства любого термодинамического цикла теплового двигателя оценивается относительным термическим КПД, представляющим отношение термического КПД рассматриваемого цикла t к терми-
ческому КПД цикла Карно ηtk для тех же граничных температур (Tmax и Tmin ):
η0t ηt  ηtk .
ηtk .
11.5. Идеальный цикл холодильной машины
Идеальным циклом холодильной машины является обратный цикл Карно представленный на рис. 11.3, б.
а |
б |
Р и с. 11.3. Прямой (а) и обратный (б) циклы Карно
Теплота q2 , отводимая от охлаждаемого тела, подводится в цикле к его рабочему телу при постоянной низшей температуре T2 :
q2 RT2 ln(υc  υb ).
υb ).
Теплота q1 , отводимая в цикле при постоянной высшей температуре T1 ,
q1 RT1 ln(υd  υa ).
υa ).
Следовательно,
ε q2  l q2
l q2  (q1 q2 ) T2
(q1 q2 ) T2  (T1 T2 ),
(T1 T2 ),
так как
υc  υb υd
υb υd 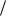 υa.
υa.
Работа, затрачиваемая на совершение обратного цикла Карно
l q2(T1 T2 ) T2.
T2.
Так как в заданном интервале температур T2 T1 обратный цикл Карно обусловливает максимальное значение , то работа, затрачиваемая в цикле Карно на
55
получение холода q2 , будет минимальной по сравнению с работой любого другого цикла холодильной машины в том же интервале температур.
12.ЭНТРОПИЯ
12.1.Понятие об энтропии и ее изменение
втермодинамических процессах
Энтропией S называется функция состояния рабочего тела, изменение которой в обратимом термодинамическом процессе удовлетворяет равенству
dS = dQ/T. |
(12.1) |
Для 1 кг рабочего тела
ds = dq T ,
T ,
где dQ (dq) и Т - соответственно теплота и температура элементарного процесса.
В любом обратимом термодинамическом процессе с подводом или |
отводом |
||||||
теплоты изменение энтропии |
|
|
|
|
|
|
|
Δs s |
|
s |
|
2 |
dq |
. |
(12.2) |
|
|
||||||
|
2 |
1 |
|
1 T |
|
||
|
|
|
|
|
|
||
Отношение dQ/T называют элементарной приведенной теплотой. Теплота Q не является функцией состояния рабочего тела, так как она зависит от характера процесса. Поэтому dQ не представляет дифференциала функции состояния, но отношение dQ/T представляет дифференциал функции состояния тела, называемой энтропией.
Энтропия является экстенсивным свойством вещества и обладает свойствами аддитивности. Энтропия единицы массы, или удельная энтропия
s S m.
m.
Для сложной системы общее значение энтропии S определяется суммированием значений энтропии отдельных ее составляющих:
n
S mtst .
1
Энтропия изолированной системы не изменяется, если в ней происходят обратимые процессы. Если в изолированной системе происходят необратимые процессы, то ее энтропия увеличивается. Для элементарного необратимого процесса изменение энтропии dS > dQ/T. Следовательно, при отсутствии внешнего теплообмена при dQ = 0 в элементарном необратимом процессе ds > 0. Таким образом, необратимость процесса вызывает возрастание энтропии и, следовательно, энтропия является такой функцией состояния рабочего тела, которая при любых процессах в изолированной системе не может уменьшаться. Все реальные процессы необратимы, поэтому энтропия изолированной системы может только возрастать. Степень возрастания энтропии соответствует степени необратимости происходящих в ней процессов; энтропия характеризует степень необратимости реальных процессов.
56
Так как одним из основных проявлений необратимости термодинамических процессов является самопроизвольный переход теплоты от тел более нагретых, к телам менее нагретым, то энтропия также является критерием оценки направления реальных процессов, происходящих в изолированной системе.
Переход неравновесной изолированной системы в равновесное состояние при самопроизвольных необратимых процессах будет сопровождаться возрастанием энтропии. Поэтому численное значение энтропии изолированной системы характеризует степень приближения ее к равновесному состоянию, при котором значение энтропии системы достигает своего максимума.
Если в равенство (11.2) подставить величину dq по дифференциальному выражению (9) первого закона термодинамики, то с учетом уравнения (2) можно по-
лучить расчетные соотношения для определения изменения |
энтропии в обра- |
тимых процессах: |
|
s = s2 – s1 = cυ ln (T2/T1) + R ln (υ2/υ1); |
(12.3) |
s = cp ln (T2/T1) - R ln (p2/p1); |
(12.4) |
s = cυ ln (p2/p1) + cp ln (υ2/υ1). |
(12.5) |
Для политропного процесса |
|
s = [cυ (n - k)/(n - 1)] ln (T2/T1).
Абсолютное значение энтропии как функции состояния рабочего тела не определяется. Однако если принять за уровень отсчета энтропии произвольное состояние тела, то можно определить энтропию рабочего тела в любом состоянии.
В технических расчетах за уровень отсчета энтропии принимают нормальные физические условия pн = 101325 Па и Тн = 273 К. При этом по уравнениям (12.3) - (12.5), принимая значения T1, p1, υ1 равными соответственно Тн, pн, υн, а параметры Т2, р2, υ2 равными параметрам произвольного состояния тела Т, р, υ, можно получить расчетные соотношения для определения значения энтропии 1 кг рабочего тела:
s = cυ ln (T/273) + R ln [(µυ)/22,4]; |
(12.6) |
s = cp ln (Т/273) – R ln (р/рн); |
(12.7) |
s = cυ ln (p/рн) + cp ln [(µυ)/22,4]. |
(12.8) |
Как следует из формул (12.6) - (12.8), каждым значениям параметров состояния рабочего тела соответствует вполне определенное значение энтропии.
12.2. Энтропия и работоспособность. Закон возрастания энтропии
Если в изолированной системе, состоящей из рабочих тел, имеющих различную температуру, теплота будет самопроизвольно переходить от тела более нагретого к менее нагретому, то это не будет вызывать изменения энергии изолиро-
57
ванной системы, однако работоспособность системы будет изменяться, так как в этом случае будет возрастать энтропия системы.
Допустим, что имеется система из трех рабочих тел A, В и С с температурами соответственно Т1 > Т2 > То. Если теплота Q от тела А с температурой Т1 самопроизвольно перейдет к телу В с температурой Т2, то считая теплоемкость этих тел будет столь значительной, что при переходе теплоты от тела A к телу В их температуры не изменяются, то изменение энтропии этих тел таково:
SA = - Q/T1 (теплота Q от тела А отводится);
SB = Q/T2 (теплота Q подводится к телу В).
Общее изменение энтропии S изолированной системы определится алгебраической суммой изменений энтропии отдельных тел:
S = SA + SB = (Q/T2 - Q/Т1) = Q (Т1 – Т2)/T1T2..
Множитель (T1—T2)/(T1T2)>0, так как Т1>T2. Следовательно, энтропия изолированной системы при самопроизвольном переходе теплоты от более нагретого тела к менее нагретому, являющемся необратимым процессом, возрастает (ΔS > 0). Так как процесс перехода теплоты от тел более нагретых к телам менее нагретым является естественным процессом, то в этом случае энтропия будет возрастать. Совершенно очевидно, что возрастание энтропии исключено в изолированных равновесных системах, так как при переходе неравновесных систем в равновесное состояние их энтропия достигает максимума. Можно показать, что необратимый процесс перехода теплоты от более нагретого тела к менее нагретому в
изолированной системе приводит к потере работоспособности данной |
неравно- |
весной системы. |
|
В качестве примера рассмотрим ту же систему из трех тел А, В и С с темпера- |
|
турами соответственно T1 > Т2 > Т0. |
|
L = L1 - L2 = T0 [(Q/T2) - (Q/T1)] = Т0 (S2 – S1) = Т0 Sн,, |
|
где Sн — возрастание энтропии вследствие необратимости процесса. Для 1кг |
|
рабочего тела |
|
l = Т0 Sн. |
(12.9) |
Формула (12.9) является универсальной, так как при возрастании энтропии вследствие необратимости в любом термодинамическом процессе потеря работоспособности определяется по этой формуле.
При исследовании технических систем в качестве T0 принимают температуру окружающей среды. Так как в природе все самопроизвольные процессы идут с переходом теплоты от тел более нагретых к менее нагретым, то процесс возрастания энтропии является основным естественным процессом.
Немецкий ученый Р. Клаузиус, установивший понятие энтропии в термодинамике, перенес общий закон возрастания энтропии изолированной системы на Вселенную и пришел к выводу, что процессы перехода теплоты от тел более нагретых к менее нагретым приведут Вселенную в равновесное состояние, при котором жизненные процессы в ней должны прекратиться. Ошибочность Клаузиуса
58

в том, что он перенес закон, наблюдаемый в изолированной системе, на неизолированную Вселенную. Кроме того, принимая возможность конца развития Вселенной, следует признавать и ее начало, когда энтропия Вселенной равнялась нулю. Это противоречит учению диалектического материализма, в соответствие с которым Вселенная существует вечно и бесконечно. Материя, составляющая Вселенную, вечна, как вечно ее движение. Поэтому, наблюдая процессы в природе с возрастанием энтропии, ученые утверждают о возможности существования во Вселенной процессов с убыванием энтропии.
12.3. Ts-диаграмма
Так как энтропия однозначно определяется состоянием тела, т. е. является функцией состояния, то она может приниматься в качестве одного из параметров при графическом исследовании процессов. В технической термодинамике широко применяется система координат Ts, в которой площадь под графиком, характеризующим процесс, соответствует теплоте процесса. По оси ординат откладывают значение абсолютных температур, а по оси абсцисс - энтропию
(рис. 12.1).
По определению энтропии dS = dQ/T. Следовательно, dQ = TdS или dq=Tds.
Произведение TdS в системе TS-координат соответствует заштрихованной
2
площадке, а вся площадь, т.е. TdS, равна Q.
1
На рис. 12.2. приведены графики основных термодинамических процессов в Ts-координатах.
Уравнения основных термодинамических процессов в системе координат Ts: изохорный
2 |
dq |
2 |
c dT |
T |
- в Ts-координатах логарифмическая кривая; изобар- |
|||||||
Δs |
T |
|
|
T |
|
cυlnT |
||||||
|
|
|
υ |
|
|
2 |
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
ный |
|
|
2 cpdT |
|
|
|
|
|
|
|||
|
|
|
T |
|
- в |
Ts-координатах |
логарифмическая кривая; |
|||||
|
Δs |
T |
cplnT |
|
||||||||
|
|
|
|
|
|
|
2 |
|
|
|
||
|
|
|
1 |
|
|
|
1 |
|
Ts-координатах |
|
||
изотермический |
Т=const - в |
прямая, параллельная оси абс- |
||||||||||
цисс; |
|
|
|
|
|
|
|
|
|
|
|
|
адиабатный |
|
|
|
|
|
|
|
|
||||
2
Δs dq 0 ; s = const - в Ts-координатах прямая, параллельная оси ординат.
1 T
Изменение энтропии в элементарном процессе ds = dq/T. Учитывая, что абсолютная температура тела всегда положительна, знак приращения энтропии соответствует знаку теплоты. Следовательно, в Ts-координатах обратимые процессы с подводом теплоты всегда изображаются с возрастанием энтропии, а процессы с отводом теплоты - с убыванием энтропии.
59

Р и с. 12.1. TS-диаграмма |
Р и с. 12.2. Диаграмма |
Р и с. 12.3. Цикл Карно |
термодинамического |
политропных процессов |
в Ts-координатах |
процесса |
в Ts-координатах |
|
Обратимый цикл Карно, состоящий из двух изотерм и двух адиабат, в Ts- координатах изображается прямоугольником (рис. 12.3). Площадь abc'd' соответствует теплоте q1, площадь cdd'c' - теплоте q2, а площадь abcd - теплоте, преобразованной в полезную работу.
13.ВОДЯНОЙ ПАР
13.1.Основные понятия и рυ - диаграмма водяного пара
Паром называется реальный газ, находящийся в состоянии близком к конденсации. Водяной пар получается при испарении или кипении воды. При кипении температура кипящей жидкости ts зависит от давления ps. Пар, находящийся над поверхностью кипящей воды, имеет температуру кипения ts и называется насыщенным паром. Насыщенный пар, содержащий капельную взвешенную влагу, называется влажным паром. Доля массы сухого насыщенного пара во влажном паре называется степенью сухости пара и обозначается х. Доля влаги во влажном паре называется влагосодержанием пара (1-х).
Если испарить всю взвешенную в паре влагу, то пар становится сухим насыщенным. Сухой насыщенный пар имеет температуру ts. Состояние сухого насыщения неустойчиво, так как охлаждение пара приводит к появлению в нем капель конденсата, т.е. делает его влажным. Нагревание сухого насыщенного пара вызывает повышение его температуры и пар становится перегретым.
Процесс получения водяного пара может быть рассмотрен в рυ-координатах (рис. 13.1). На изобаре p1 = const нанесены точки: 0 - состояние воды при t = 0° С; a - состояние кипящей воды; m - состояние влажного пара со степенью сухости хm; b - состояние сухого насыщенного пара и d - состояние перегретого пара. Обозначения с индексами «штрих» соответствуют более высокому давлению р2=const.
При давлении рs = 10 кПа температура кипения ts = 99,64 °С, удельный объем кипящей воды υ' = 0,0010432 м3/кг и удельный объем сухого насыщенного пара υ"
=1,694 м3/кг.
Свозрастанием давления температура кипения повышается, объем кипящей воды увеличивается, а объем сухого насыщенного пара уменьшается. При параметрах так называемого критического состояния, соответствующего точке К на
60
