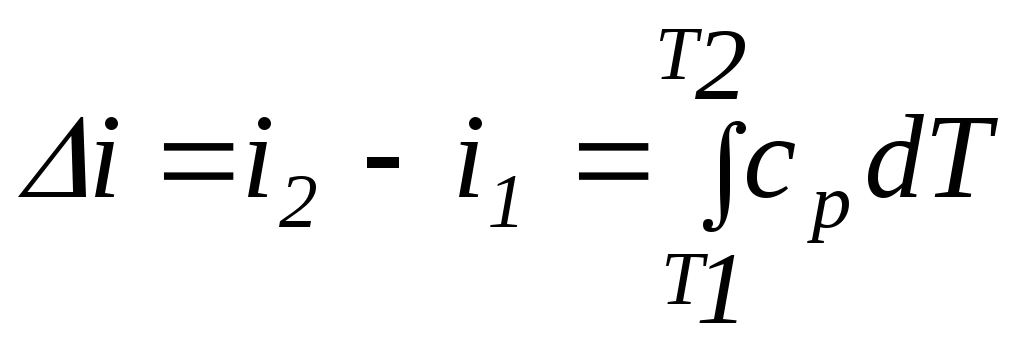- •Техническая тЕрмодинамика
- •Содержание
- •Введение
- •Основные понятия и определения
- •Предмет технической термодинамики и ее методы
- •Рабочее тело. Основные параметры состояния.
- •Термодинамическая система и окружающая среда.
- •Уравнение состояния
- •Термодинамический процесс. VP-диаграмма и термодинамические процессы в ней /равновесные и неравновесные, обратимые и необратимые, круговой процесс/.
- •Теплота и работа как формы передачи энергии.
- •Идеальные и реальные газы
- •2.1 Определения и основные законы идеальных газов.
- •Уравнение состояния идеальных газов. Газовая постоянная.
- •Газовая постоянная одного килограмма газа:
- •Смеси идеальных газов
- •Основные определения. Способы задания газовых смесей
- •Вычисление параметров состояния смеси
- •Реальные газы
- •Первый закон термодинамики
- •Сущность первого закона термодинамики
- •Основные формулировки 1 закона
- •3.2 Внутренняя энергия. Аналитическое выражение 1 закона термодинамики.
- •3.3 Энтальпия. Энтропия.
- •4 Теплоемкость газов
- •4.1 Основные определения. Массовая, объемная и молярная теплоемкости
- •4.2 Теплоемкость при постоянном давлении и при постоянном объеме. Уравнение Майера.
- •Теплоемкость смеси газов
- •Основные термодинамические процессы идеальных газов.
- •Общие принципы исследования термодинамических процессов.
- •Вычисление энтропии идеального газа.
- •Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропный процесс
- •6. Второй закон термодинамики
- •Термодинамические циклы тепловых машин. Прямые и обратные циклы, обратимые и необратимые
- •Термический кпд и холодильный коэффициент циклов
- •Прямой и обратный циклы Карно и их свойства
- •Прямой цикл Карно
- •Обратный цикл Карно
- •Аналитическое выражение iIзакона термодинамики.
- •Определение термического кпд цикла через среднеинтегральные температуры.
- •Методы сравнения термических кпд обратимых циклов
- •Обобщенный цикл Карно
- •Водяной пар
- •Фазовые переходы веществ
- •Диаграммы воды и водяного пара в vPиvTкоордината. Пограничные кривые. Критические точки
- •7.3 Определение параметров состояния воды и водяного пара
- •Основные параметры сухого насыщенного пара
- •Основные параметры перегретого пара
- •Основные параметры влажного насыщенного пара
- •Диаграмма sTдля водяного пара
- •7.8 Термодинамические процессы изменения состояния водяного пара
- •7.8.1.1Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •7.8.4Адиабатный процесс
- •8.Влажный воздух
- •Основные понятия и определения
- •Расчет основных параметров влажного воздуха
- •Течение газов
- •Уравнения движения
- •Уравнение первого закона термодинамики для потока газа
- •Располагаемая работа газа в потоке
- •Уравнение неразрывности
- •Скорость истечения
- •Секундный расход идеального газа через сопло
- •Истечение газа из сосуда неограниченной емкости
- •Основные условия течения идеального газа по каналам переменного сечения
- •Сопло Лаваля
- •При дозвуковом и сверхзвуковом течении
- •Истечение газов и паров с учетом трения
- •Дросселирование газов и паров
- •Дросселирование водяного пара
- •Компрессоры
- •Классификация и принципы действия компрессоров
- •Одноступенчатый поршневой компрессор
- •Ротационный (пластинчатый) компрессор
- •10.1.3 Центробежный компрессор
- •Компрессора
- •10.2 Теоретическая индикаторная диаграмма поршневого компрессора
- •Компрессора
- •10.3 Влияние процесса сжатия на величину работы одноступенчатого компрессора
- •В компрессоре в зависимости от способа сжатия:
- •Действительная индикаторная диаграмма компрессора
- •Многоступенчатое сжатие
- •Охлаждением рабочего тела
- •Циклы поршневых двигателей внутреннего сгорания (двс)
- •1Цикл двс с подводом теплоты при постоянном объеме (цикл Отто)
- •Теплоты при постоянном объеме:
- •С подводом теплоты при и
- •11.2 Цикл двс с подводом теплоты при постоянном давлении (цикл Дизеля)
- •С подводом теплоты при постоянном давлении:
- •Цикл со смешанным подводом теплоты (цикл Тринклера)
- •Сравнение циклов двс
- •Сравнение циклов поршневых двс с подводом теплоты при и
- •При одинаковой степени сжатия
- •С различной степенью сжатия .
- •При и регенерацией теплоты:
- •Циклы паросиловых установок
- •Обратные термодинамические циклы
- •14.1 Цикл воздушной холодильной установки
- •14.2 Цикл парокомпрессорной холодильной установки
- •Список использованной и рекомендуемой литературы
Теплоемкость смеси газов
При расчетах тепловых установок приходится встречаться со смесями газов, а в таблицах приводятся значения теплоемкости только для отдельно взятых идеальных газов, поэтому важно уметь определять теплоемкость газовой смеси.
Если смесь газов задана массовыми долями, то удельная теплоемкость смеси определяется как сумма произведений массовых долей и удельной теплоемкости каждого газа:
![]() ;
(4.15)
;
(4.15)
![]() .
(4.16)
.
(4.16)
Если смесь газов задана объемными долями, то объемная теплоемкость смеси равна сумме произведений объемных долей и объемной теплоемкости каждого газа:
![]() ;
(4.17)
;
(4.17)
![]() .
(4.18)
.
(4.18)
Молярная теплоемкость смеси газов равна произведению объемных долей и молярных теплоемкостей составляющих смесь газов:
![]() (4.19)
(4.19)
![]() (4.20)
(4.20)
Удельная теплоемкость смеси газов может быть определена, если известны плотность и удельный объем смеси газов при нормальных физических условиях:
![]() ;
(4.21)
;
(4.21)
![]() (4.22)
(4.22)
Основные термодинамические процессы идеальных газов.
Общие принципы исследования термодинамических процессов.
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работой газа, причем, количество теплоты, участвующее в процессе, зависит от характера протекания этого процесса:
![]() .
.
К основным термодинамическим процессам, имеющим большое как теоретическое, так и практическое значение, относятся:
Изохорный, протекающий при постоянном объеме (v= const; dv=0);
Изобарный, протекающий при постоянном давлении (P=const; dP=0);
Изотермический (изотермный), протекающий при постоянной температуре (T=const; dT=0);
Адиабатный, протекающий при отсутствии теплообмена с внешней средой (dq=0);
Политропный, характеризующийся тем, что он протекает при постоянной теплоемкости (сп=const).
Политропный процесс может рассматриваться в качестве обобщенного по отношению ко всем перечисленным выше термодинамическим процессам.
Для всех процессов может быть применен общий метод исследования, приведенный в таблице 5.1.
Таблица 5.1 - Общий метод исследования политропных процессов
|
Метод исследования |
Формулы |
|
|
|
|
|
|
|
|
|
|
|
|
Продолжение таблицы 5.1
|
Метод исследования |
Формулы |
|
где сх – теплоемкость процесса
|
|
|
|
|
|
|
|
|

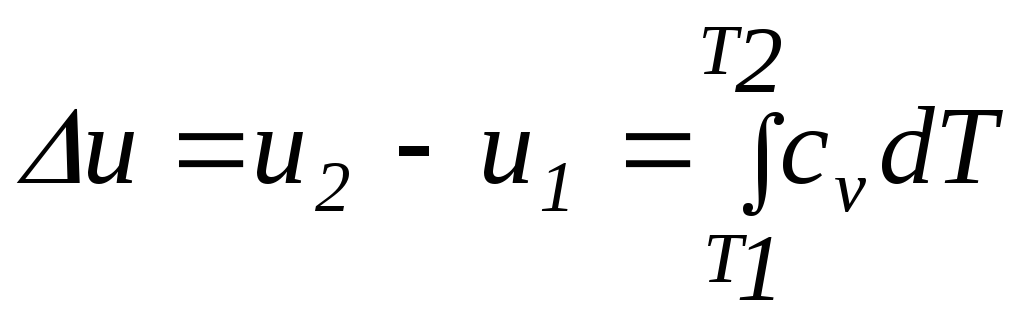
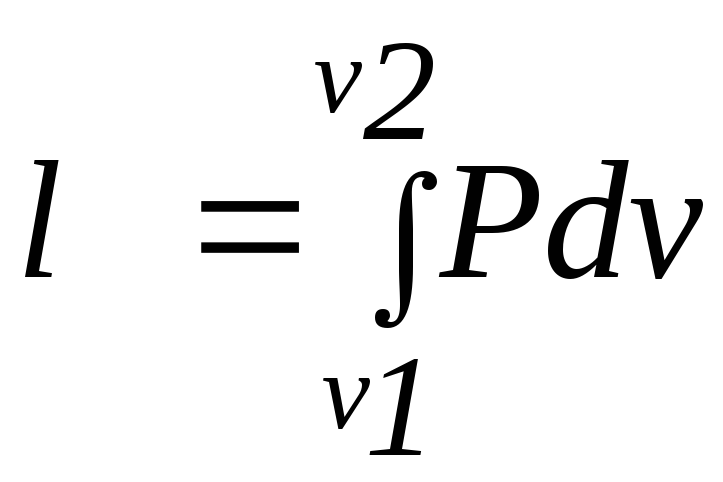
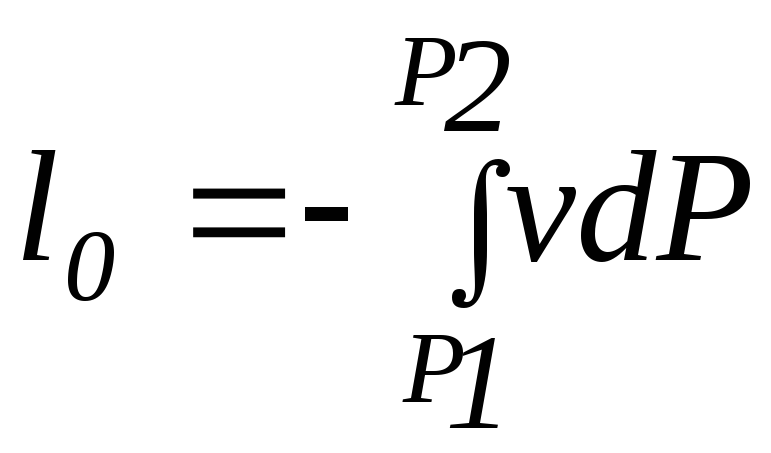
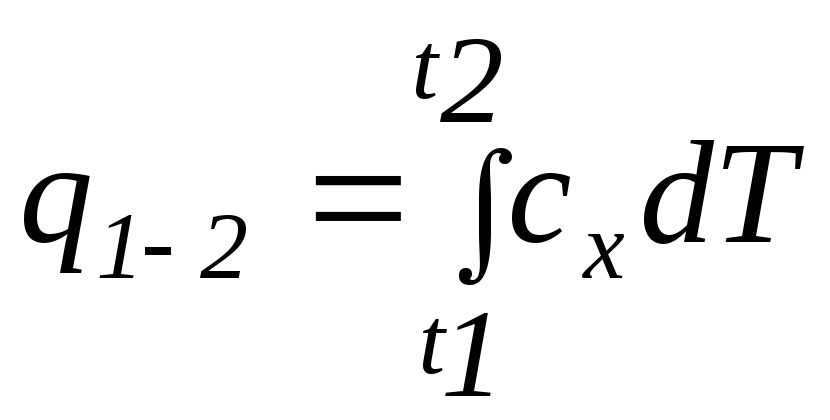 ,
,