
Методичка
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
ЗАТВЕРДЖУЮ
Ректор ____________ С.В. Іванов
(підпис)
«___» ________________2014 р.
БІОЛОГІЯ КЛІТИН
ЛАБОРАТОРНИЙ ПРАКТИКУМ
для студентів напряму підготовки 6.051401 «Біотехнологія» денної та заочної форм навчання
Всі |
цитати, |
цифровий |
та |
СХВАЛЕНО |
|
фактичний |
матеріал, |
|
бібліографічні |
на засіданні кафедри |
|
відомості |
перевірені. |
Написання |
біотехнології і мікробіології |
||
одиниць відповідає стандартам. |
|
Протокол № 10 |
|||
Підпис(и) автор(ів) |
|
|
від 27.02.2014 р. |
||
Красінько В.О. ________________
Волошина І.М. ________________
«___» _______________2014 р.
Реєстраційний номер електронного лабораторного практикуму у НМВ
_69.34 – 06.03.2014___________
Київ НУХТ 2014
Біологія клітин [Електронний ресурс]. Лабораторний практикум для студ. напряму підготовки 6.051401 «Біотехнологія» ден. та заоч. форм навчання / уклад.: В.О. Красінько, І.М. Волошина. – К.: НУХТ, 2014. – 147 с.
Рецензент: С.М. Тетеріна, канд. техн. наук
Укладачі: В.О. Красінько, канд. техн. наук І.М. Волошина, канд. техн. наук
Відповідальний за випуск Т.П. Пирог, д-р біол. наук, проф.
Подано в авторській редакції
© В.О. Красінько, 2014 © І.М. Волошина, 2014
© НУХТ, 2014
2
ЗАХОДИ БЕЗПЕКИ
Заходи безпеки під час виконання лабораторних робіт з дисципліни “Біологія клітин” збігаються з розділом “Загальні положення” “Інструкції з техніки безпеки під час роботи в лабораторних приміщеннях кафедри біотехнології і мікробіології”, узгодженої з начальником відділу охорони праці
ітехніки безпеки НУХТ та затвердженою ректором НУХТ.
1.Перед початком роботи кожен студент повинен ознайомитися з технікою безпеки у мікробіологічній лабораторії і поставити свій підпис у журналі з техніки безпеки.
2.У лабораторію забороняється входити у верхньому одязі. Усі студенти повинні працювати в чистих халатах з незаймистого матеріалу, наприклад бавовни, халати мають бути застебнуті на всі ґудзики. Волосся необхідно прибрати з обличчя та сховати під шапочку.
3.Під час роботи в лабораторії бажано знаходитися без косметики на обличчі та з коротко підстриженими нігтями.
4.Кожен студент в мікробіологічній лабораторії працює на постійному місці, виконує завдання індивідуально. На робочому місці потрібно підтримувати зразковий порядок. Особисті речі повинні зберігатися в спеціально відведеному місці.
5.У лабораторії забороняється вживати напої і їжу.
6.До роботи не допускаються студенти, які мають пошкодження на відкритих ділянках шкіри не оброблені та не заклеєні бактерицидним пластиром.
7.Під час виконання лабораторної роботи категорично забороняється користуватися мобільними телефонами та залишати їх увімкненими.
8.Під час виконання лабораторної роботи студентам заборонено пересуватися по лабораторії без зайвої потреби. Всі рухи повинні бути спокійними та виваженими.
9.Працюючи з відкритим полум’ям (газовий пальник, спиртівка), потрібно дотримуватися таких вимог: запалювати спиртівку та газовий пальник лише за допомогою сірника. Забороняється запалювати запальничкою та іншою запаленою спиртівкою (газовим пальником). Гасити запалену спиртівку потрібно, закривши доступ повітря спеціальним ковпачком, а газовий пальник – перекриттям доступу газу. Розташовувати спиртівку потрібно на відстані не меншій, ніж 20 см від краю робочого стола. Запалену спиртівку заборонено пересувати з місця на місце. По закінченні роботи з газовими пальниками необхідно перевірити, що вихід газу перекрито.
10.У разі випадкового займання ватно-марлевого корку необхідно терміново загасити його, закривши доступ повітря.
11.Під час роботи з живими культурами мікроорганізмів необхідно слідкувати за наявністю запобіжних ватних тампонів у піпетках та ватномарлевих корків у пробірках.
12.Роботу з культурами мікроміцетів можна проводити лише за наявності індивідуальних засобів захисту дихальних шляхів.
3
13.У разі випадкового потрапляння мікробного матеріалу на шкіру дослідника або стіл чи підлогу це місце треба ретельно обробити дезінфікуючим розчином.
14.Роботу у мікробіологічному боксі дозволено проводити лише за проходження додаткового інструктажу з техніки безпеки, наявності відповідного захисного одягу (халат, шапочка, захисна маска та захисні окуляри) та супроводу викладача або лаборанта. Категорично забороняється заходити у бокс при увімкненій бактерицидній лампі.
15.Всі предмети, використані під час роботи з живими мікроорганізмами, повинні бути знезаражені фламбуванням (петлі, голки), кип’ятінням (пробірки, чашки Петрі), обробкою дезінфікуючими розчинами (шпателі, предметні і покривні скельця).
16.За умови стерилізації лабораторних інструментів (шпателі, скальпелі, голки, петлі тощо) у розчині спирту необхідно слідкувати, щоб інструменти, що стерилізуються, були охолоджені.
17.У разі випадкового займання спирту необхідно терміново загасити його, закривши доступ повітря до ємкості, у якій він знаходиться.
18.Забороняється користуватися скляним посудом, що має сколи, тріщини, гострі краї.
19.Необхідно суворо дотримуватися вимог електробезпеки. Забороняється використовувати несправне електрообладнання і вмикати прилади без дозволу викладача або лаборанта, а також торкатися поверхні приладу вологими руками.
20.По закінченні роботи студент повинен привести у порядок робоче місце, руки варто ретельно вимити, а при необхідності обробити дезінфікуючим розчином. Необхідно мати індивідуальний рушник або салфетки для витирання рук.
ЛАБОРАТОРНА РОБОТА № 1
Організація мікробіологічної лабораторії. Будова мікроскопа, техніка мікроскопії.
Мета роботи: ознайомлення з організацією мікробіологічної лабораторії та робочого місця мікробіолога; засвоєння правил роботи з мікроскопом; опануванні методів мікроскопічного дослідження біологічних об’єктів.
Матеріали та обладнання: мікроскопи; предметні та покрівні скельця; бактеріологічні петлі; спиртівки; крапельниці з дистильованою водою; картопляний та кукурудзяний крохмаль; розчин Люголя, сіль поварена, цукорпісок, суспензія хлібопекарських дріжджів.
Загальні відомості 1.1. Організація мікробіологічної лабораторії
Навчальна мікробіологічна лабораторія є прототипом аналогічної лабораторії будь-якого біотехнологічного, фармацевтичного або харчового
4
підприємства, а також науково-дослідного закладу і складається з кількох приміщень: кімнати для мікробіологічних досліджень, боксу, біохімічної лабораторії, препараторської, стерилізаційної, мийної, термостатної кімнат.
Приміщення лабораторії має виходити вікнами на північ або північний захід для створення рівної освітлюваності під час роботи з мікроскопом. Стіни повинні бути світлих кольорів, підлога та робочі поверхні столів покриті матеріалом, що легко миється та дезинфікується.
У лабораторії двічі на день проводять вологе прибирання. Один раз на тиждень у приміщенні лабораторії проводять опромінення бактерицидними переносними лампами протягом 0,5...2 годин.
Деякі роботи з мікроорганізмами виконують у спеціальному ізольованому приміщенні – боксі, площею 3...5 м2. У боксі встановлені стіл, газові пальники, бактерицидні лампи.
Біохімічну лабораторію обладнують хімічними столами, витяжними шафами, необхідними контрольно-вимірювальними приладами (технічними та аналітичними терезами, фотоелектроколориметрами, спектрофотометрами, рНметрами тощо), шафами для посуду та реактивів.
Упрепараторській встановлюють робочі столи для підготовки посуду та поживних середовищ, шафи для зберігання реактивів та мікробіологічного обладнання, холодильники для зберігання культур мікроорганізмів у стані спокою.
В окремій стерилізаційній кімнаті розміщують автоклави для стерилізації поживних середовищ і посуду.
Стерилізація (від лат. sterilis – безплідний) – це повне знищення усіх вегетативних форм та форм спокою мікроорганізмів у поживних середовищах, посуді тощо. Цей прийом широко використовується в мікробіологічній практиці. Відомо кілька методів стерилізації. Найчастіше застосовують стерилізацію під дією високої температури (термічну). Прийоми термічної стерилізації: фламбування (прожарювання у полум’ї), стерилізація сухим жаром, автоклавування тощо (докладніше про прилади й методи стерилізації див. лаб. роботу №10).
Мийну обладнують зручними раковинами з підведенням гарячої та холодної води, стелажами для сушіння посуду.
Утермостатній кімнаті розміщують стелажі для встановлення засіяних колб і пробірок. Термостатна кімната може бути замінена спеціальними приладами – термостатами – в яких підтримується постійна температура, оптимальна для вирощування певних мікроорганізмів (докладніше див. лаб. роботу №10).
1.2.Організація робочого місця мікробіолога
Унавчальній лабораторії за кожним студентом закріплено постійне робоче місце і прилади. На лабораторному столі встановлені освітлювач для мікроскопа, спиртовий пальник, набір барвників, мікробіологічні петлі та голки, штатив для пробірок, предметні та покривні скельця, промивалки з дистильованою водою, олівець по склу, фільтрувальний папір, сірники.
5

Мікроскоп для роботи розміщують на столі, а зберігають – у сейфі. Робоче місце слід тримати в чистоті. Поверхню стола протирають ватним тампоном, змоченим 70%-вим етанолом або іншим дезінфектантом.
1.3. Правила роботи в мікробіологічній лабораторії
Робота в мікробіологічній лабораторії вимагає суворого дотримання спеціальних правил роботи, які продиктовані двома основними положеннями:
І. У мікробіологічній практиці використовуються, як правило, чисті культури мікроорганізмів (вирощені з однієї клітини). Оскільки у повітрі, на поверхні оточуючих предметів, на одязі, на руках, волоссі завжди знаходиться велика кількість різноманітної мікрофлори, то для забезпечення стерильності досліджень і запобігання забруднення культур робота повинна проводитися з дотриманням правил асептики.
ІІ. У ході дослідження неідентифікованих мікроорганізмів, за їх виділення з об’єктів навколишнього середовища і техногенних потоків, можуть бути виділені патогенні і умовно патогенні мікроорганізми. Крім того, клітини як патогенних, так і сапрофітних мікроорганізмів можуть бути алергенами для деяких макроорганізмів. Тому для одержання достовірних даних досліджень, для забезпечення особистої безпеки і безпеки оточуючих необхідно дотримуватися певних правил, наведених на початку даного лабораторного практикуму.
1.4. Будова оптичного мікроскопу
Мікроскоп — інструмент, який дає можливість одержувати збільшене зображення малих об'єктів та їх деталей, що невидимі неозброєним оком.
Оптичний мікроскоп (рис. 1) складається з двох частин: механічної — підсобної і оптичної — головної. До механічної частини відносять: штатив (1), предметний столик (2), тубус (16) з револьверною голівкою (17), макрометричний (12) і мікрометричний (13) гвинти. Нижня частина штатива є опорою мікроскопа, верхня (у формі дуги) — тубусотримачем (11). У верхній частині тубусотримача міститься револьвер (14), що обертається навколо своєї осі і має З – 4 різьбові отвори, куди вгвинчуються об'єктиви (15). Центрування об'єктива по осі мікроскопа точно фіксується пружиною. Револьвер також має гніздо для кріплення тубуса. Тубусотримач разом із тубусом можна переміщувати вертикально на 50 мм за допомогою механізму, змонтованого в основі штатива. Механізм приводять у дію
обертанням макрометричного і мікрометричного гвинтів. Макрометричний гвинт використовують для швидкого переміщення тубуса вгору і вниз уздовж оптичної осі мікроскопу і для початкового грубого наведення на фокус. Одне його обернення відповідає лінійному переміщенню тубуса на 1 мм. Мікрометричний гвинт призначений для тонкого фокусування. Повне його
6
обернення переміщує тубус на 0,1 мм. Барабан гвинта має 50 поділок, кожна з яких відповідає переміщенню тубуса на 0,002 мм (2 мкм). Мікрометричний гвинт дуже тендітний, тому працювати з ним слід дуже обережно.
Предметний столик мікроскопа (2) має круглу або прямокутну форму, в його центрі є отвір для проходження променів, що освітлюють препарат. Під предметним столиком на штативі закріплено кронштейн конденсора (6), що переміщується у межах 20 мм за допомогою спеціального гвинта (8).
Оптична частина мікроскопа складається з основного оптичного вузла (об'єктива й окуляра) і допоміжної освітлювальної системи (дзеркала і конденсора).
Усі частини оптичної системи чітко центровані по відношенню одна до одної.
Освітлювальний апарат міститься під предметним столиком. Він складається з дзеркала (10) і конденсора (5) з діафрагмою (9).
Дзеркало зафіксовано при основі штатива, має два боки (увігнутий та плоский) і використовується для збирання променів у паралельні пучки. За умов денного світла зазвичай користуються плоским боком дзеркала, в умовах місцевому освітлення – увігнутим боком. Замість дзеркала у сучасних конструкціях мікроскопу може бути встановлена електрична освітлювальна система, яка також знаходиться під предметним столиком. Вона складається з колекторної лінзи в корпусі, який угвинчується в отвір підставки мікроскопа і патрона з встановленою в нього лампою. Патрон з лампою встановлюється в шарнір, при налаштуванні їх можна переміщувати уздовж осі в горизонтальній площині. Живлення освітлювача мікроскопа забезпечуютьється від мережі змінного струму через настільне джерело живлення.
Конденсор, закріплений над дзеркалом, складається з двох лінз: верхньої
– плосковипуклої, нижньої – двовипуклої. Паралельні пучки променів, що відбиваються дзеркалом, збираються за допомогою конденсора в одній точці – фокусі, яка має бути в площині препарату. За допомогою конденсора можна покращити контрастність зображення.
Під конденсором містяться ірис-діафрагма і відкидна оправа для світлофільтра. Ірис-діафрагма затримує зайві промені світла і складається із сталевих пелюсток (за будовою нагадує зіницю ока). Її отвір можна розширити або звузити за допомогою важеля.
Кожен об'єктив (15) складається з системи шліфованих лінз, склеєних канадським бальзамом і вміщених у металеву оправу. Одне з позначень на оправі відповідає ступеню власного збільшення об'єктивів - в 8×, 40×, 90× разів. Робочою лінзою об'єктива є передня, або фронтальна лінза. Це єдина лінза об'єктива, що має здатність збільшувати об'єкти. Величина цього збільшення залежить від фокусної відстані, або від кривизни лінзи (чим більша кривизна, тим коротша фокусна відстань і тим більше збільшення об'єктива). Цю обставину потрібно враховувати у практичній роботі. Так, для об'єктива 8× відстань від фронтальної лінзи до об'єкта дослідження становить приблизно 10 мм, для об'єктива 40× — вже в межах 1 мм, а для об'єктива 90× — приблизно 0,1 мм. Інші лінзи об'єктива (всього лінз може бути від 6 до 12) розміщені вище за фронтальну і мають різну кривизну поверхні. Вони виготовляються із скла з
7

різними оптичними властивостями. Ці лінзи не збільшують предмети, вони призначені для корекції зображення.
Крім власного збільшення на металевій оправі об'єктивів зазначені її числові апертури (0,20; 0,65; 1,25).
Числова апертура А об’єктива (конденсора) визначається добутком сінуса половини стрімкого кута U на показник заломлення n середовища, що межує з лінзою об’єктива (конденсора) (рис. 2):
|
А = і sin U |
(1.1). |
|
||
|
Іншими |
словами, |
числова |
|
апертура – це |
|
«охоплення» |
лінзи, |
вона |
характеризується |
|
Рис. 2. Схема ходу променів за |
кількістю променів, |
що попадають у лінзу. |
|||
різної величини кута U |
Використовуючи об'єктиви з більшою апертурою і |
||||
|
освітлюючи |
препарат |
світлом |
з коротшою |
|
довжиною хвилі, можна побачити дрібніші об'єкти або розрізнити в клітині тонші структури.
Числова апертура будь-якої лінзи, що межує з повітрям, не може бути більше 1, оскільки показник заломлення повітря дорівнює 1, а кут U не може бути більше 90° (тобто sin < 1). Практично підвищити роздільну здатність можна двома шляхами: або освітлюючи об'єкт ще більш короткими променями світла, наприклад, ультрафіолетовими (люмінесцентна мікроскопія), або збільшуючи показник заломлення середовища, що межує з лінзою, для того, щоб наблизити його до показника заломлення скла, на якому знаходиться об'єкт
(робота з імерсійною системою). |
|
|
|
|
|
|
Для дослідження мікроорганізмів найчастіше |
||||
|
застосовують імерсійні об'єктиви (лат. іmmеrsіоn- |
||||
|
занурення). |
|
|
|
|
|
Імерсійні об'єктиви відрізняються від сухих |
||||
|
за зовнішнім виглядом: на їх оправі є чорна кругова |
||||
|
нарізка. Крім того, там вигравіруване позначення: |
||||
|
МІ – масляна імерсія. |
|
|
||
|
Оптична будова імерсійних об'єктивів |
||||
Рис. 3. Хід променів |
передбачає |
їх |
роботу |
при зануренні в рідке |
|
середовище |
на |
відміну |
від сухих |
об'єктивів, при |
|
у імерсійній системі |
роботі з якими між |
клітинами |
мікроорганізму, |
||
|
|||||
розташованими на предметному склі, і лінзою об'єктива знаходиться повітря (рис. 3). Між лінзою (6) імерсійного об'єктиву (1) і препаратом (2) знаходиться рідина (4) з показником заломлення, близьким до показника заломлення скла. Роль такої рідини може виконувати, наприклад, кедрова олія (показник заломлення кедрової олії – 1,515, скла – 1,52). Промені, проходячи крізь скло й олію, не змінюють напрямку, залишаючись, в оптично однорідному (гомогенному) середовищі.
8

Сучасні світлові мікроскопи – це складні оптичні системи. До основних характеристик мікроскопа належать загальне збільшення і роздільна здатність.
Загальне збільшення, яке дає мікроскоп, визначається як добуток збільшення об'єктиву Vоб на збільшення окуляра Vок (табл. 1), і виражається формулою:
V = Vоб Vок |
(1.2) |
Таблиця 1
Оптичні дані окулярів до мікроскопа МБР-1
Окуляри |
Фокусна |
Лінійне поле |
Власне |
Загальне збільшення з |
||||
|
відстань, мм |
зору, мм |
збільшення |
|
об’єктивами |
|
||
|
|
|
|
8× |
|
40× |
|
90× |
7× |
36 |
19 |
7× |
56 |
|
280 |
|
630 |
10× |
25 |
14 |
10× |
80 |
|
400 |
|
900 |
15× |
17 |
8 |
15× |
120 |
|
600 |
|
1350 |
Однак збільшення не характеризує якості зображення, воно може бути чітким і нечітким. Чіткість одержуваного зображення характеризується роздільною здатністю мікроскопа, тобто тією найменшою величиною об’єктів або їх деталей, які можна побачити за допомогою цього приладу. Отже, роздільна здатність – це величина, зворотньо пропорційна найменшій відстані між двома крапками, за якої вони під мікроскопом з даними оптичними характеристиками не зливаються в одну. Чим більше роздільна здатність мікроскопа чи об’єктива, тим менший об’єкт за його допомоги можна побачити.
Роздільна здатність мікроскопа залежить від довжини хвилі використовуваного світла і суми числових апертур об’єктива і конденсора:
L = |
λ |
|
A1 + A2 |
(1.3) |
де L - мінімальна відстань між двома крапками: A1 - числова апертура об'єктива,
A2; - числова апертура конденсора,
λ - довжина хвилі використовуваного світла.
Збільшити роздільну здатність (тобто зменшити абсолютну величину L, оскільки це зворотні величини) можна наступними шляхами: освітлювати об’єкт світлом з коротшою довжиною хвилі λ (наприклад, ультрафіолетовими або короткохвильовими променями), використовувати об’єктиви з більшою апертурою А1 або підвищувати апертуру конденсора А2.
Імерсійні об'єктиви дають найвищу роздільну здатність мікроскопа. Максимальна роздільна здатність світлового мікроскопа 0,2 мкм.
Крім звичайного світлового мікроскопа, який залишається основним інструментом при вивченні клітин і тканин, для спеціальних цілей
9
використовують фазовоконтрастний, інтерференційний, поляризаційний та інші мікроскопи.
1.5. Методи мікроскопії
Метод фазово-контрастної мікроскопії дозволяє перетворити невидимі фазові зміни, яких набувають світлові хвилі при проходженні через мікробну клітину, у видимі амплітудні і тим самим підвищити контрастність зображення. Оптична система, що використовується для одержання фазового контрасту, складається з фазової пластинки (5) і кільцевої діафрагми (1) (рис. 4).
|
Фазова пластина – це коло напилювання із солей |
|
рідких металів на одну з лінз об'єктива, вона забезпечує |
|
зміну фази хвилі світла, що проходить, на 1/4, що |
|
приводить до перетворення фазових розходжень в |
|
амплітудні. Кільцева діафрагма – це непроникна для |
|
світла пластина, що має прозору щілину у вигляді |
|
кільця, через яку надходить світло в конденсор. |
|
Фазовий ефект виходить лише при точному сполученні |
|
фазового кільця з проекцією кільцевої діафрагми. |
|
Фазовоконтрастний пристрій складається з набору |
|
фазових об’єктивів (4), що мають на металевій оправі |
|
крім указаного збільшення ще і позначку «Ф», |
|
револьверного конденсора (2) з набором кільцевих |
|
діафрагм, кожна з яких відповідає фазовій пластинці |
Рис. 4. Схема проходження |
визначеного об'єктиву, і допоміжного мікроскопа, |
променів при використанні |
призначення якого центрування кільцевої діафрагми |
фазово-контрастного |
стосовно фазової пластинки об'єктива. |
пристрою |
|
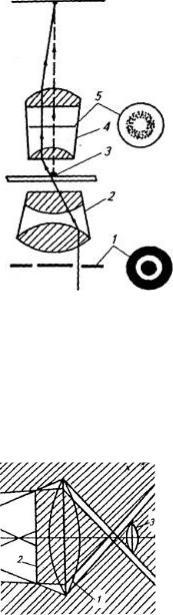
Мікроскопія в темному полі заснована на висвітленні об'єкта косими променями світла. Ці промені не потрапляють в об'єктив, тому поле зору виглядає темним. Якщо препарат містить клітини мікроорганізмів, то косі
промені, проходячи через |
такий |
препарат, у значній мірі відбиваються від |
||||
|
|
поверхні клітин і настільки ухиляються від свого |
||||
|
|
первісного напрямку, що потрапляють в об'єктив (3). |
||||
|
|
Тоді спостерігач бачить на чорному тлі інтенсивно світні |
||||
|
|
об'єкти, навіть якщо їхній діаметр у 10 разів менший, ніж |
||||
|
|
роздільна здатність об'єктива. Таке висвітлення |
||||
|
|
препарату |
досягається |
застосуванням |
спеціального |
|
|
Рис. 5. Схема |
|||||
|
конденсора (1). Темнопольний конденсор має затемнену |
|||||
|
проходження променів |
|||||
|
у конденсорі темного |
середню частину (2), тому центральні промені світла, що |
||||
|
|
йдуть |
від |
дзеркала, |
затримуються, а |
в площину |
|
|
|||||
препарату попадають тільки бічні промені, відбиті від дзеркальних поверхонь, розташованих усередині конденсора (рис. 5).
При мікроскопіюванні в темному полі можна побачити об'єкти, величина яких вимірюється сотими частками мікрометра, тобто лежить за межами видимості звичайного мікроскопа. Однак спостереження об'єктів у темному
10
