
- •Применение закона действующих масс к растворам электролитов Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Гетерогенные равновесия Константа растворимости. Правило растворимости осадков
- •1. Если стехиометрическое произведение молярных концентраций ионов труднорастворимого электролита в растворе равно величине егоKs (или пр) при данной температуре
- •2. Если стехиометрическое произведение молярных концентраций ионов в растворе электролита меньше величины его ks
- •3. В перенасыщенном растворе стехиометрическое произведение молярных концентраций труднорастворимого электролита больше величины его ks
- •Образование и растворение осадков
- •Однотипные и разнотипные конкурирующие равновесия в гетерогенных системах
- •Определение комплексных соединений и их общая характеристика
- •Строение комплексных соединений
- •Классификация комплексных соединений
- •Диссоциация комплексных соединений
- •Гидролиз солей
- •3. Соли, образованные сильной кислотой, но слабым основанием:
- •Количественный анализ основы титриметрического метода анализа Химический эквивалент
- •Молярная масса эквивалентов вещества
- •Химическое количество эквивалентов вещества
- •Молярная концентрация эквивалентов вещества
- •Закон эквивалентов
- •Титриметрический анализ Общая характеристика метода
- •Требования, предъявляемые к реакциям, которые используют в титриметрии
- •Способы титрования
- •Способы приготовления рабочих растворов
- •Правила работы с мерной посудой при проведении аналитических измерений
- •Мерные колбы
- •Пипетки
- •Бюретки
- •Проведение титрования
- •Кислотно-основное титрование Общая характеристика метода
- •Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
- •Подбор индикаторов при кислотно-основном титровании
- •Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
- •Применение кислотно-основного титрования
- •Редоксиметрия Общая характеристика и классификация методов
- •Кривые титрования в редоксиметрии
- •Способы определения точки эквивалентности
- •Перманганатометрия
- •Иодометрия
- •Физико-химические методы анализа Практическое применение электропроводности
- •Потенциометрия
- •Хроматография Общая характеристика метода
- •Классификация хроматографических методов анализа
- •Методика разделения и идентификации компонентов смеси
- •Содержание
Министерство здравоохранения Республики Беларусь
Учреждение образования «ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
Кафедра общей и биоорганической химии
В.В. БОЛТРОМЕЮК
ЛЕКЦИИ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Пособие для студентов медико-диагностического факультета
Гродно
ГрГМУ
2012
УДК
ББК
Б79
Автор: зав. каф. общей и биоорганической химии, канд. хим. наук, доц. В.В. Болтромеюк.
Рецензенты: декан ф-та биологии и экологии, проф. каф. химии и химической технологии УО «ГрГУ им. Я. Купалы», д-р хим. наук, проф. В.Н. Бурдь;
|
Б79 |
Болтромеюк, В.В. Лекции по аналитической химии : пособие для студентов медико-диагностического факультета/ В.В. Болтромеюк. – Гродно : ГрГМУ, 2012. – _____ с. ISBN |
В пособии рассматриваются равновесные процессы, протекающие в растворах электролитов, условия их смещения в ту или иную сторону, а также основы титриметрического и физико-химических методов количественного анализа.
УДК
ББК
|
ISBN |
Болтромеюк В.В., 2012 УО «ГрГМУ», 2012 |
Применение закона действующих масс к растворам электролитов Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
Все вещества делятся на 2 большие группы: электролитыинеэлектролиты.
Электролитами называются вещества (исключая металлы), растворы или расплавы которых проводят электрический ток. К электролитам относятся соединения, образованные ионными или ковалентными полярными связями. Это сложные вещества: соли, основания, кислоты, оксиды металлов (проводят электрический ток только в расплавах).
Неэлектролитаминазываются вещества, растворы или расплавы которых электрический ток не проводят. К ним относятся простые и сложные вещества, образованные малополярными или неполярными ковалентными связями.
Свойства растворов и расплавов электролитов впервые объяснил в конце XIXвека шведский учёный Сванте Аррениус. Им была создана специальнаятеория электролитической диссоциации, основные положения которой, доработанные и развитые другими учёными, в настоящее время формулируются следующим образом.
1. Электролиты в растворах или расплавах распадаются на положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. Общая сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов, поэтому растворы или расплавы электролитов в целом остаются электронейтральными.Ионы могут быть какпростые, состоящие только из одного атома (Na+,Cu2+,Cl–,S2-), так исложные, состоящие из атомов нескольких элементов (SO42–,PO43–,NH4+, [Al(OH)4]–).
Простые ионы по своим физическим, химическим и физиологическим свойствам существенно отличаются от нейтральных атомов, из которых они образовались. В первую очередь, ионы являются гораздо более устойчивыми частицами, чем нейтральные атомы, и могут существовать в растворах или расплавах неограничено долгое время, не вступая в необратимое взаимодействие с окружающей средой.
Такое различие в свойствах атомов и ионов одного и того же элемента объясняется разным электронным строением этих частиц.
Так, простые ионы s- иp-элементов находятся в более устойчивом состоянии, чем нейтральные атомы, потому что имеют завершённую электронную конфигурацию внешнего слоя, например:
|
Nao |
– 1ē |
Na+ | |
|
1s22s22p63s1 |
|
1s22s22p6 | |
|
нейтральный атом натрия; на внешнем электронном слое находится один электрон |
|
положительно заряженный ион натрия; на внешнем электронном слое находится 8 электронов (как у ближайшего благородного газа неона) | |
|
Fo |
+ 1ē |
F– | |
|
1s22s22p5 |
|
1s22s22p6 | |
|
нейтральный атом фтора; на внешнем электронном слое находится 7 электронов |
|
отрицательно заряженный ион фтора; на внешнем электронном слое находится 8 электронов | |
Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя.
Особенностью ионных соединений является то, что в узлах их кристаллической решётки имеются уже готовые ионы, и в процессе растворения таких веществ диполям растворителя (воды) остаётся только разрушить эту ионную решётку (рис. 18).
Вещества, образованные полярными ковалентными связями, переходят в раствор в виде отдельных молекул, которые, как и молекулы Н2О, представляют собой диполи, например:
![]()

![]() + –
+ –
В этом случае диполи Н2О, ориентируясь соответствующим образом вокруг растворенной молекулы электролита, вызывают в ней дальнейшую поляризацию ковалентной связи, а затем и её окончательный гетеролитический разрыв (рис. 29).
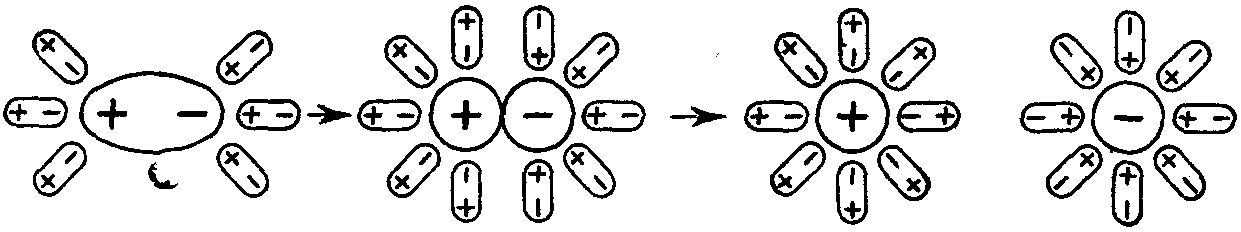
H–ClH++Cl
Рис. 29. Схема электролитической диссоциации в растворе полярной молекулы HCl
Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О).
Однако для простоты в уравнениях химических реакций ионы изображаются без окружающих их гидратных оболочек: H+,NO3–,K+и т.д.
2. Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами).
Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т.к. проводят электрический ток за счёт направленного движения электронов.
3. Процесс
электролитической диссоциации обратим.
Наряду с распадом электролитов на ионы,
может протекать обратный процесс –
соединение ионов в молекулы или
ассоциации. Поэтому в уравнениях реакций
электролитической диссоциации веществ
вместо знака равенства «=» ставят знак
обратимости «![]() »,
например:
»,
например:
HF ![]() H+ +
F–
H+ +
F–
CH3COOH
![]() CH3COO–
+ H+
CH3COO–
+ H+
