
- •Материаловедение и технология материалов
- •Часть II. Материаловедение
- •Материаловедение и технология материалов
- •Часть II. Материаловедение
- •Введение
- •Содержание
- •Практическая работа №7
- •Теоретическая часть
- •Кристаллографические обозначения атомных плоскостей и направлений
- •Расчет теоретической плотности кристаллических веществ
- •Сведения об атомных весах и плотности металлов
- •Формулы для расчета объема элементарной ячейки
- •Теоретическая часть
- •Содержание отчета
- •Виды диаграмм растяжения металлических материалов с различным типом кристаллических решеток
- •Испытания на твердость
- •Деформация
- •Фазы и структура в металлических сплавах
- •Диаграммы состояния двойных систем
- •Метод построения диаграмм состояния
- •Правило отрезков
- •Диаграмма состояния системы с неограниченной растворимостью компонентов в твердом состоянии
- •Диаграмма состояния системы с механической смесью компонентов в твердом состоянии
- •Диаграмма состояния системы с образованием ограниченных твердых растворов
- •Диаграмма состояния системы с химическим соединением
- •Диаграмма состояния системы, компоненты которой претерпевают полиморфные превращения
- •Диаграмма состояния сплавов, образующих ограниченные твердые растворы и претерпевающих перитектическое превращение
- •Пример выполнения практической работы «Построение и анализ диаграмм состояния двойных систем»
- •Работа №10
- •Теоретическая часть
- •Компоненты и фазы в железоуглеродистых сплавах
- •Основные линии и точки на диаграмме железо – углерод
- •Анализ процессов охлаждения железоуглеродистых сплавов различного состава
- •Пример кристаллизации сплава
- •На структуру железо-углеродистых сплавов
- •Превращения в стали при нагреве и охлаждении
- •Отжиг стали
- •Нормализация
- •Закалка стали
- •Отпуск стали
- •Старение
- •Нормализация
- •Термомеханическая обработка
- •Отжиг I рода
- •Отжиг II рода
- •Нормализация
- •Закалка
- •Способы закалки
- •Отпуск закаленных сталей
- •Работа №12
- •Часть II. Материаловедение.
Теоретическая часть
На диаграмме состояния железо – углерод (рис. 1) представлены фазовый состав и структура сплавов с концентрацией по углероду от чистого железа до цементита – химического соединения железа с углеродом при концентрации последнего 6,67 % (вертикальная линия на диаграмме).
Система Fe-Fe3C метастабильна и при определенных условиях цементит может распадаться с образованием железа и чистого углерода в виде графита.
Компоненты и фазы в железоуглеродистых сплавах
Железо (Fe) – металл сероватого цвета, имеет атомный номер 26, атомную массу 55,85, атомный радиус 0,127 нм. Чистое железо, которое может быть получено в настоящее время, содержит 99,999 % Fe, технические сорта 99,8 - 99,9 % Fe (железо – армко). Температура плавления железа 1539 °С (рис.2). Железо имеет две полиморфные модификации α и γ. Модификация α - железа существует при температурах ниже 910 °С и выше 1392 °С (рис. 82). В интервале температур 1392 - 1539 °С α - Fe нередко обозначают как δ - Fe.
Кристаллическая решетка α - Fe - объемноцентрированный куб с периодом решетки 0,28606 нм. До температуры 768 °С α - Fe магнитно (ферромагнитно).
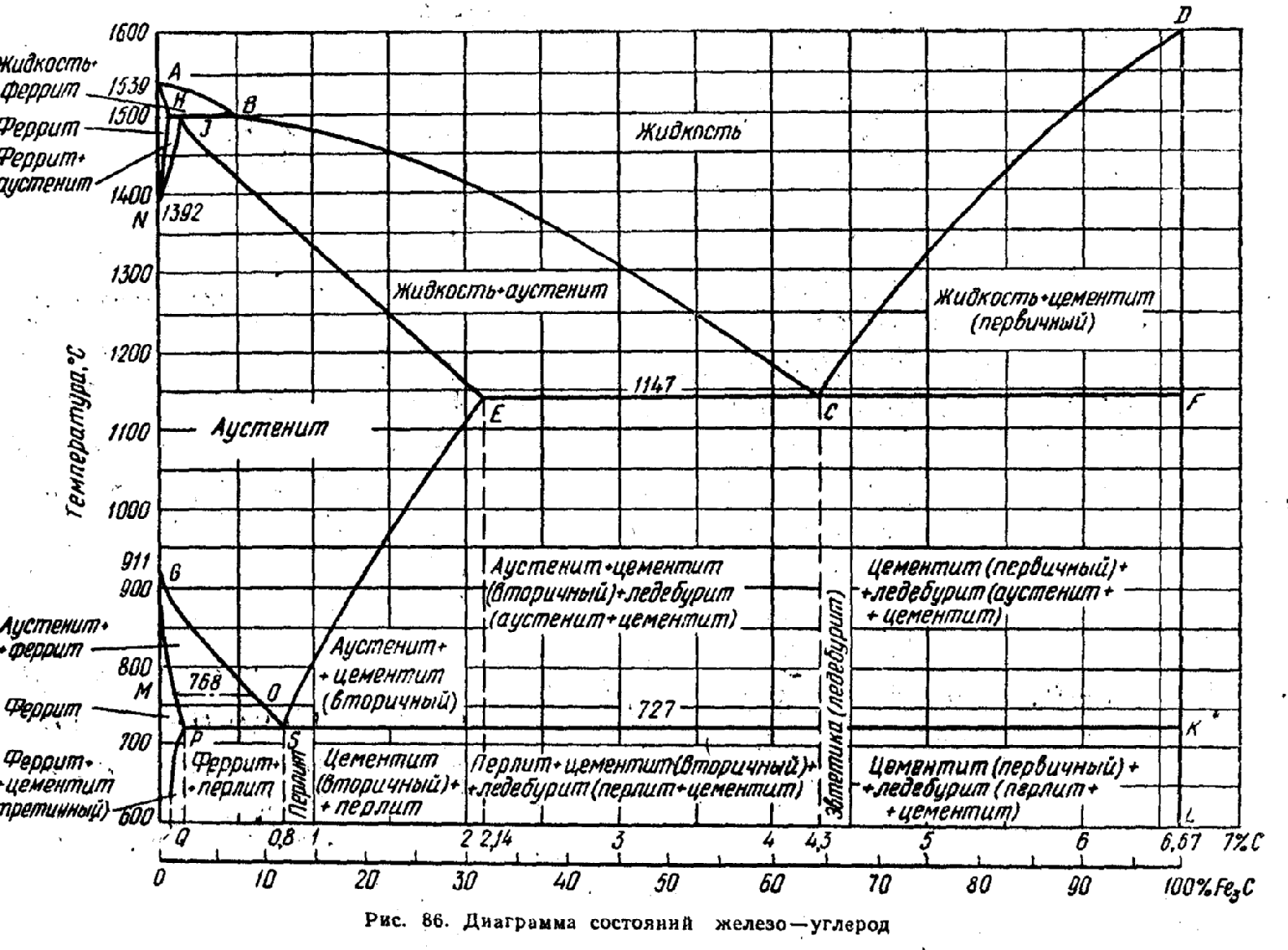
Рис. 1 Диаграмма железо – углерод (структурная)

Рис. 2 Кривая охлаждения чистого железа
Температуру 768 °С, соответствующую магнитному превращению, т. е. переходу из ферромагнитного состояния в парамагнитный, называют точкой Кюри. Плотность α - Fe 7,68 г/см8.
γ - Fe существует при температуре 910 - 1392 °С; оно парамагнитно. Кристаллическая решетка γ - Fe гранецентрированный (ГЦК) с периодом решетки 0,3645 нм при 910 °С.
Критическую точку превращения α ↔ γ при 910 °С обозначают со ответственно Аc3 (при нагреве) и Аr3 (при охлаждении). Критическую точку перехода γ ↔ δ при 1392 °С обозначают Aс4 (при нагреве) и Ar4 (при охлаждении).
Углерод является неметаллическим элементом II периода IV группы периодической системы. Его атомный номер 6, плотность 2,5 г/см3, температура плавления 3500 °С, атомный радиус 0,077 нм. Углерод полиморфен, причем в обычных условиях он находится в виде модификации графита, но может существовать и в виде метастабильной модификации алмаза. Углерод растворим в железе в жидком и ограничено в твердом состояниях, образуются твердые растворы внедрения. При определенной концентрации (6,67%) образует химического соединение Fe3C – цементита. В высокоуглеродистых сплавах может присутствовать в чистом виде в виде графита.
В полном соответствии с диаграммой железо – углерод в системе могут существовать следующие фазы:
Жидкость – жидкий раствор углерода в железе, существует выше линии ликвидус ABCD и обозначается буквой L;
Цементит – химическое соединение. Однофазная область существования которого представляет собой вертикальную линию DFKL и обозначается в дальнейшем химической формулой Fe3C или буквой Ц. цементит очень твердая, хрупкая фаза со сложной ромбической решеткой и твердостью НВ 800 кг/мм2.
Феррит – твердый раствор внедрения углерода в α- или в -железе с решеткой ОЦК. Соответственно различают низкотемпературный α-феррит с максимальной растворимостью углерода до 0,02% при Т = 727 °С и высокотемпературный δ – феррит с максимальной растворимостью углерода 0,1% при Т = 1499 °С. При концентрированной температуре растворимость углерода в α - фазе не превышает 0,006 %. Область α-феррита в системе железо-углерод расположена левее линии GPQ , а - феррита – левее линии AHN; феррит обозначается буквой Ф, или в виде фаз α, δ. Феррит мягкая пластичная фаза с твердостью НВ 80 кг/мм2.
Аустенит – твердый раствор внедрения углерода в γ-железе с решеткой ГЦК. Максимальная растворимость углерода в γ-железе 2,14% при Т = 1147 °С. Область аустенита на диаграмме ограничена линией – NJESG. Обозначается аустенит A или γ.
Графит имеет гексагональную решетку с периодами а = 0,245 нм и с = 0,678 нм. Он относительно легок (плотность 2,22 г/см3), мягок, пластичен, химически стоек.
