
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
алКалОИДЫ
41
33.5.1. хИнИн
в основе структуры молекулы хинина лежит ядро хинолина, связанное через вторичную спиртовую группу с хинуклидиновым ядром.
хинин является бесцветным кристаллическим веществом (т. пл. 177 с), горького вкуса, малорастворимым в воде, оптически активен (вращает плоскость поляризации влево).
являясь двутретичным двукислотным основанием, хинин образует с минеральными кислотами два ряда солей. хинин с одним эквивалентом минеральной кислоты образует соль по атому азота хинуклидинового ядра, с двумя эквивалентами — по обоим атомам азота.
хинин — специфическое средство для лечения малярии. в акушерской практике его применяют для усиления родовой деятельности. фармакопейными пре-
паратами являются хинина гидрохлорид, хинина дигидрохлорид и хинина сульфат.
33.6. алКалОиды груППы иЗОХинОлина и ФенанТрениЗОХинОлина
важное значение из этой группы соединений имеют алкалоиды папаверин, морфин и кодеин, которые широко применяются в качестве лекарственных средств. основным источником получения указанных алкалоидов является опий, представляющий собой загустевший млечный сок незрелых головок мака (Papaver somniferum).
33. .1. ПаПаВерИн
алкалоид папаверин [6,7-диметокси-1-(3 ,4 -диметокси- бензил)изохинолин] впервые был выделен в 1884 году из опия, а в 1910-м — получен синтетически.
Папаверин — бесцветное кристаллическое вещество (т. пл. 147 с), нерастворимое в воде, растворимое в горячем этаноле и хлороформе.
в виде хлороводородной соли папаверин применяется в медицине в качестве спазмолитического и сосудорасширяющего средства.
33. .2. мОрФИн
алкалоид морфин впервые выделен из опия в 1804 году французским фармацевтом сегэном. среди алкалоидов он был открыт первым. Молекула морфина
Глава 33
42
имеет сложное строение. над установлением структуры
морфина работали многие химики в течение более ста
лет. только в 1925 году английским химиком-органи-
ком робертом робинсоном строение его молекулы было
установлено.
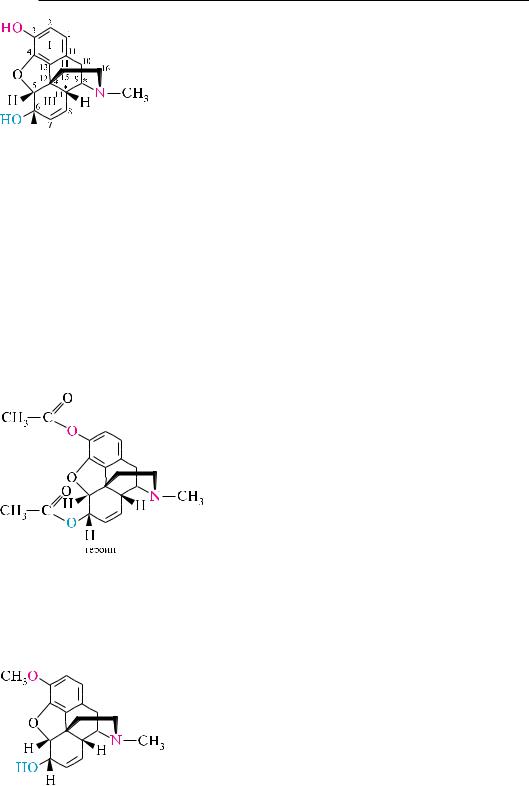
По химической структуре морфин является произ-
водным фенантренизохинолина. частично гидрирован-
 ные ядра фенантрена и изохинолина соединены в молекулы морфина таким образом, что один шестичленный карбоцикл (III) является общим как для фенантренового, так и изохинолинового
ные ядра фенантрена и изохинолина соединены в молекулы морфина таким образом, что один шестичленный карбоцикл (III) является общим как для фенантренового, так и изохинолинового
циклов.
Морфин — бесцветное кристаллическое вещество (т. пл. 254 с), малорастворим в воде, этаноле, диэтиловом эфире, хлороформе, бензоле; оптически активен (вращает плоскость поляризации влево).
Молекула морфина содержит две гидроксильные группы, которые обладают разными свойствами. Гидроксильная группа в положении 3 является фенольной, так как находится в бензольном ядре, а гидроксильная группа в положении 6 связана с частично гидрированным кольцом и поэтому является вторичной спиртовой. у атома азота находится метильная группа.
в отличие от большинства алкалоидов, морфин обладает не только основными, но и слабыми кислотными свойствами. с минеральными кислотами он образует соли по атому азота, с участием фенольного гидроксила — растворяется в щелочах. аналогично фенолу, морфин с железа (III) хлоридом образует хелатный комплекс
синего цвета.
в виде хлороводородной соли морфин используется в качестве обезболивающего средства. При длительном применении к нему быстро развивается болезненное пристрастие — нар-
комания. Это свойство морфина в ряде случаев
ограничивает его использование.
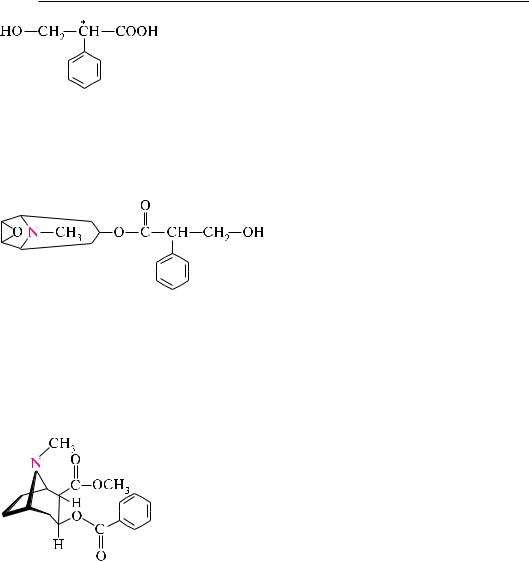
диацетильное производное морфина — ге-
роин является наиболее распространенным наркотиком.
33. .3. КОДеИн
По химическому строению кодеин представляет собой метиловый эфир морфина, образованный с участием фенольного гидроксила.
содержание кодеина в опии невелико (0,5—1 %), поэтому значительную часть его производства осуществляют полусинтетически — путем метилирова-
ния морфина.
кодеин представляет собой бесцветное кристаллическое вещество (т. пл. 154—157 с), горького вкуса, плохо растворимое в воде, хорошо растворимое
в этаноле, диэтиловом эфире, оптически активное (вращает плоскость поляризации влево).

алКалОИДЫ
43
вотличие от морфина, кодеин нерастворим в щелочах и не дает окрашивания
сжелеза (III) хлоридом. незначительное изменение структуры молекулы кодеина по сравнению с морфином приводит к изменению фармакологической активности. болеутоляющее действие кодеина в 6—7 раз слабее, чем морфина. кодеин, в отличие от морфина, уменьшает возбудимость кашлевого центра, что позволяет использовать его в основном как противокашлевое средство. При длительном применении кодеин вызывает к себе привыкание.
33.7. алКалОиды груППы ТрОПана
в основе структуры алкалоидов этой группы лежит бициклическая система тропана, состоящая из пирролидинового и пиперидинового колец, имеющих общий атом азота.
алкалоиды группы тропана являются производными аминоспиртов — тропина и скопина, а также гидроксикислоты — экгонина.
Главные представители тропановых алкалоидов — атропин, скополамин и кокаин.
33.7.1. аТрОПИн
алкалоид атропин [тропиновый эфир (±)-тропо- вой кислоты] содержится в растениях красавке (Atropa belladonna), дурмане (Datura stramonium) и др.
По химической структуре атропин представляет собой сложный эфир, образованный спиртом тропином и троповой кислотой ( -гидрокси- -фенилпропионовая кис-
лота).
Троповая кислота содержит асимметрический атом углерода, поэтому существует в виде двух оптически активных изомеров (D- и L-) и оптически неактивной ра-
цемической формы. атропин оптически неактивен, так как в его молекуле спирт тропин этерифицирован рацемической троповой кислотой.
в растениях содержатся лишь следы атропина. Главной же формой, в которой находится алкалоид в растениях, является гиосциамин, представляющий собой сложный эфир тропина и левовращающего изомера троповой кислоты. При получении из растений гиосциамин подвергают рацемизации нагреванием до 114— 116 с. в этих условиях левовращающий гиосциамин превращается в рацемат, то
Глава 33
44
есть атропин. атропин является одним из сильнейших ядов. в очень малых дозах в виде сернокислой соли он применяется в медицине в качестве холинолитического и спазмолитического средства. кроме того, атропин проявляет мидриатический эффект, то есть
способность расширять зрачок, что широко используется в глазной практике для обследования глазного дна. атропин также применяется в качестве противоядия при отравлениях ацетилхолином и фосфорорганическими соединениями.
33.7.2. СКОПОламИн
алкалоид скополамин [скопиновый эфир (–)-троповой кислоты] содержится вместе с атропином и гиосциамином в растениях (красавке, белене, дурмане). По химической структуре он имеет сходство с атропином. Молекула представляет собой сложный эфир,
образованный аминоспиртом скопином и троповой кислотой.
Cкополамин напоминает атропин и по фармакологическому действию. он тоже относится к холинолитическим средствам, так же, как атропин, способен расширять зрачок, но мидриатический эффект скополамина менее продолжительный. в медицине скополамин применяется в виде бромоводородной соли.
33.7.3. КОКаИн
алкалоид кокаин (метиловый эфир бензоилэкгонина) содержится в листьях кустарника кока (Erythroxylon coca), произрастающего в южной америке. По хими-
ческой структуре кокаин представляет собой сложный
эфир, образованный гидроксикислотой экгонином, ме-
тиловым спиртом и бензойной кислотой.
кокаин оказывает сильное местноанестезирующее действие. однако из-за высокой токсичности и способности вызывать кокаинизм (наркомания) он имеет
ограниченное применение. в виде хлороводородной соли кокаин используют главным образом в качестве местноанестезирующего средства в глазной практике, а также для местного обезболивания слизистых оболочек полости рта, носа, горла, анестезии пульпы зуба.
33.8. алКалОиды груППы индОла
конденсированная система индола входит в состав многих алкалоидов. большинство алкалоидов группы индола содержит два атома азота, один из которых входит в индольное ядро, а другой — находится на расстоянии двух углерод-уг- леродных связей от -положения индольного цикла. наибольшую практическую ценность из этой группы представляют алкалоиды резерпин и стрихнин.

алКалОИДЫ
45
33.8.1. реЗерПИн
алкалоид резерпин содержится в корнях растения раувольфия змеиная (Rauwolfia serpentina), произрастающего в индии.
резерпин — желтоватый мелкокристаллический порошок, малорастворим в воде, этаноле и диэтиловом эфире, легкорастворим в хлороформе и уксусной кислоте. резерпин обладает гипотензивным действием и оказывает успокаивающее действие на центральную нервную систему. Применяется в медицине преимущественно для лечения гипертонической болезни и психических расстройств.
33.8.2. СТрИхнИн
алкалоид стрихнин содержится в семенах тропическо-
го растения чилибухи (Strychnos nux vomica). он является
сложным конденсированным многоядерным соединени-
ем, состоящим из семи колец. из двух атомов азота в мо-
лекуле стрихнина основными свойствами обладает только
атом азота в положении 19. с участием этого атома азота
стрихнин образует соли с кислотами. атом азота в поло-
жении 9 входит в состав лактамного кольца, которое под действием растворов щелочей размыкается. из-за наличия
в структуре стрихнина двойной связи 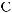

 он способен гидрироваться, обесцвечивать бромную воду и калия перманганат. стрихнин является очень ядовитым веществом. в малых дозах он действует возбуждающе на центральную нервную систему, тонизирует скелетную мускулатуру, мышцу сердца, в больших дозах вызывает судороги. в виде соли с азотной кислотой применяется в качестве тонизирующего средства.
он способен гидрироваться, обесцвечивать бромную воду и калия перманганат. стрихнин является очень ядовитым веществом. в малых дозах он действует возбуждающе на центральную нервную систему, тонизирует скелетную мускулатуру, мышцу сердца, в больших дозах вызывает судороги. в виде соли с азотной кислотой применяется в качестве тонизирующего средства.

глава 34
углевОды
термин «углеводы» предложен в 1844 году русским химиком карлом Генриховичем шмидтом на основании данных элементного состава первых представителей этого класса соединений, так как было установлено, что их молекулы состоят из атомов углерода, водорода и кислорода, причем соотношение атомов водорода и кислорода такое же, как в молекуле воды [Cx(H2O)y].
дальнейшее изучение строения этих соединений и открытие веществ с составом, не отвечающим указанной эмпирической формуле (метилпентоза, дезоксисахара), показали, что отнесение их к «гидратам углерода» является лишь формальным, но принятое название «углеводы» сохранилось.
Углеводы (сахара, карбогидраты) — обширная группа природных и синтетических соединений, являющихся по химическому строению полигидроксильными веществами, содержащими альдегидную или кетонную группы, или образующие их в результате гидролиза.
углеводы (сахара) составляют основную массу органических веществ нашей планеты. в растительном и животном мире они широко распространены главным образом в виде различных производных и значительно реже — в свободном виде. углеводы, выполняя различные жизненно важные функции, служат исходным материалом для биосинтеза многих органических соединений живых организмов.
в природе углеводы образуются в результате фотосинтеза, осуществляемого растениями с участием углерода (IV) оксида, воды и поглощающих солнечный свет пигментов (хлорофилл и др.).
для растений одни виды углеводов служат строительным материалом, выполняя опорную функцию (целлюлоза), другие — источником резервной энергии (крахмал, инулин). для человека и животных углеводы являются продуктами питания с высокой энергетической ценностью. в организме крахмал, дисахариды, а в некоторых случаях и целлюлоза под влиянием ферментов распадаются с образованием в основном глюкозы, которая окисляется в тканях до углерода (IV) оксида и воды с выделением энергии. избыток глюкозы превращается в гликоген, запасаемый в печени и мышцах. Гликоген снабжает организм глюкозой при выполнении физических нагрузок, а также при недостатке или отсутствии пищи. углеводы входят в состав гликолипидов, гликопротеидов, нуклеотидов, нуклеозидов и нуклеиновых кислот, составляющих, как известно, основу живой материи.
углеводы составляют сырьевую базу для текстильной, целлюлозно-бумажной, пищевой, деревообрабатывающей и других отраслей промышленности.
углеводы делят на простые и сложные в зависимости от количества моносахаридных единиц, связанных в молекулу.
Простые углеводы, или моносахариды (монозы), не способны гидролизоваться.
сложные углеводы при гидролизе образуют моносахариды. Сложные углеводы, в свою очередь, хотя и условно, подразделяют на олигосахариды, образующие при


|
|
|
|
34.1.2. СТереОИЗОмерИя |
|
||
|
|
|
Молекулы моносахаридов содержат не- |
||||
|
|
|
сколько |
асимметрических |
атомов |
углеро- |
|
|
|
|
да и поэтому существуют в виде различных |
||||
|
|
|
пространственных изомеров. альдопентоза |
||||
|
|
|
имеет три асимметрических атома углерода, |
||||
Эмиль Герман ФИШер |
а следовательно, одной и той же структур- |
||||||
ной формуле соответствует восемь |
стерео- |
||||||
(1852—1 1 ) |
|
||||||
|
изомеров (23), альдогексоза содержит четыре |
||||||
немецкий химик-органик. науч- |
|||||||
асимметрических углеродных атома и может |
|||||||
ные работы посвящены химии углево- |
существовать в виде 16 стереоизомеров (24) |
||||||
дов, белков, пуриновых соединений. |
(N = 2n, где n — количество асимметрических |
||||||
открыл реакцию образования озазо- |
атомов углерода). |
|
|
||||
нов (1884). Предложил (1890) класси- |
для |
изображения стереоизомеров на |
|||||
фикацию и номенклатуру углеводов. |
|||||||
плоскости используют проекционные фор- |
|||||||
синтезировал (1890) маннозу, глюко- |
мулы фишера (см. с. 74 ). |
|
|
||||
зу и фруктозу. впервые синтезировал |
|
|
|||||
(1893) - и -глюкозиды, а также при- |
изомеры моносахаридов подразделяют на |
||||||
менил ферменты в органическом син- |
D- и L-стереохимические ряды, принадлеж- |
||||||
тезе. Положил начало (1902) синтезам |
ность к которым определяется по конфи- |
||||||
полипептидов и получил первый чис- |
гурации асимметрического атома углерода, |
||||||
тый дипептид. |
|
|
максимально удаленного |
от карбонильной |
|||
лауреат |
нобелевской |
премии |
группы (для пентоз — с-4, для гексоз — |
||||
(1902). немецкое химическое обще- |
с-5). если конфигурация этого хирального |
||||||
ство учредило |
(1912) медаль |
Эмиля |
атома углерода совпадает с конфигурацией |
||||
48 |
|
|
|
|
|
Глава 34 |
|
галактоза, рибоза и др. номенклатура IUPAC в названии углеводов практически не применяется.
фишера за выдающиеся достижения |
D-глицеринового альдегида, то моносахарид |
|
в области органической химии. |
||
относят к D-ряду, если же с конфигурацией |
||
|
||
|
L-глицеринового альдегида — то к L-ряду: |
УГлеВОДЫ |
4 |
|
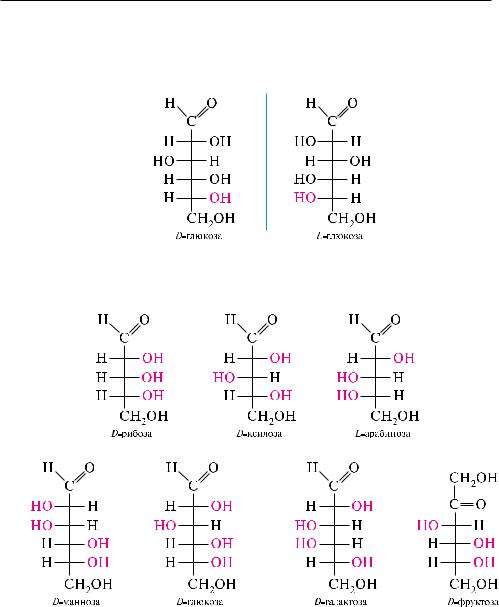
так, из 16 стереоизомеров альдогексозы восемь относятся к D-ряду, а восемь — к L-ряду. Представители D-ряда являются оптическими антиподами L-ряда, то есть альдогексоза существует в виде восьми пар энантиомеров. D-Глю- коза и L-глюкоза являются энантиомерами.
большинство природных моносахаридов относится к D-ряду.
Важнейшие представители природных моносахаридов:
Пространственные изомеры моносахаридов, отличающиеся конфигурацией одного или нескольких атомов углерода и не являющиеся зеркальными изомерами (энантио-
мерами), называются диастереомерами. так, D-глюкоза и D-галактоза, D-манноза
иD-глюкоза, D-манноза и D-галактоза составляют пары диастереомеров.
Диастереомеры, различающиеся конфигурацией только одного асимметрическо-
го атома углерода, называются эпимерами. например, D-глюкоза и D-галактоза,
а также D-глюкоза и D-манноза составляют пары эпимеров. таким образом, эпимерия является частным случаем диастереомерии.
важнейшим свойством веществ, молекулы которых имеют асимметрический атом углерода или асимметричны в целом, является их способность вращать

Глава 34
плоскость поляризованного луча света. Моносахариды обладают оптической активностью. вращение плоскости поляризованного света вправо обозначают знаком (+), а вле-
во — знаком (–). Однако следует помнить,
что направление вращения определяется экспериментально и никаким образом не связано с конфигурацией, то есть принадлежностью к D- или L-ряду. так, встречающаяся
в природе форма D-глюкозы является правовращающей, а природная форма D-фруктозы — левовращающей.
34.1.3. СТрОенИе мОнОСахарИДОВ
долгое время в науке господствовало представление, что моносахариды являются соединениями с открытой углеродной цепью, содержащие в своем составе альдегидную или кетонную группу и несколько спиртовых гидроксилов. однако при более глубоком изучении их строения было установлено, что ряд свойств моносахаридов не согласуется с существовавшими представлениями. так, оказалось,
что моносахариды, являясь альдегидами, не дают некоторых характерных реакций на альдегидную группу. в частности, они не образуют при обычных условиях гидросульфитные производные, не дают окрашивания с фуксинсернистой кислотой. При нагревании моносахаридов со спиртами в присутствии сухого хлороводорода в реакцию вступает только одна гидроксильная группа углевода, хотя, исходя из линейной структуры, в этих условиях должно образоваться соединение типа простого эфира по всем гидроксильным группам. не имело объяснения характерное для моносахаридов явление мутаротации (от лат. muto — изменяю, rotatio —вра-
щение) — изменение величины оптического вращения свежеприготовленных раство-
ров. для объяснения этих фактов русским химиком александром андреевичем колли (1870), а позднее — немецким химиком бернгардом христианом толлен-
сом (1883) было высказано предположение о циклическом строении моносахаридов.
как известно, альдегиды реагируют со спиртами с образованием полуацеталей
(см. с. 399).
Моносахариды, являясь полигидроксиальдегидами или полигидроксикетонами, образуют циклические полуацетали в результате внутримолекулярного взаимодействия карбонильной и пространственно сближенной с ней спиртовой групп. Причем, в соответствии с теорией напряжения циклов, наиболее благоприятно взаимодействие, если оно приводит к образованию пятиили шестичленных циклов. При взаимодействии оксогруппы с гидроксильной группой при с-5 альдогексоз или с-6 кетогексоз образуется пира-
нозный шестичленный цикл (от названия шестичленного гетероцикла пиран + окончание -оза).
