
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf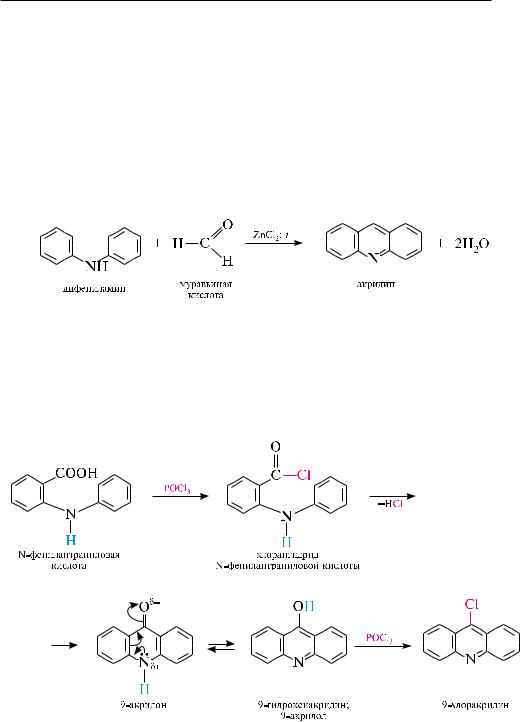


ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
13
вреакции электрофильного замещения акридин вступает с большим трудом
инеоднозначно. так, при нитровании образуется смесь изомерных нитроакридинов с содержанием преимущественно 2-нитроакридина. реакции нуклеофильного замещения для акридина идут достаточно легко в положении 9. например, при действии на акридин натрия амидом образуется 9-аминоакридин.
акридиновое ядро весьма устойчиво к окислению. Под действием калия дихромата в уксуснокислой среде акридин окисляется в 9-акридон, который является таутомерным веществом и существует в двух формах — гидрокси- и оксоформе.
в присутствии органических пероксикислот акридин окисляется по гетероатому с образованием N-оксида.
При окислении в жестких условиях происходит частичное разрушение акридинового ядра, а продуктом окисления является 2,3-хинолиндикарбоновая кислота (акридиновая кислота):
восстановление акридина протекает аналогично антрацену, то есть по положениям 9 и 10. так, под действием натрия в спиртовом растворе или при каталитическом гидрировании акридин превращается в 9,10-дигидроакридин (акридан).
Глава 32
14
ВажнеЙШИе ПрОИЗВОДнЫе аКрИДИна
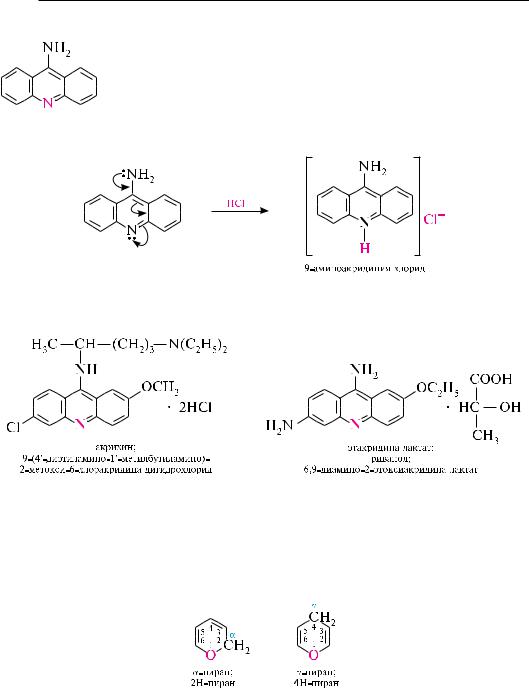
-аминоакридин — желтое кристаллическое вещество (т. пл. 236—237 с), растворимое в этаноле и ацетоне.
9-аминоакридин — более сильное основание, чем акридин. он содержит в своем составе два основных центра — атом азота пиридинового типа и атом азота аминогруппы. однако, вслед-
ствие сопряжения аминогруппы с гетероатомом, 9-аминоакридин, аналогично-аминопиридину, образует соль только по кольцевому азоту.
некоторые производные 9-аминоакридина применяются в качестве лекарственных препаратов (акрихин, этакридина лактат (риванол) и др.). акрихин проявляет противомалярийное, а этакридина лактат — антисептическое действие.
32.7. ШесТиЧленные геТерОциКлы с аТОМОМ КислОрОда
32.7.1. α-ПИран И γ-ПИран
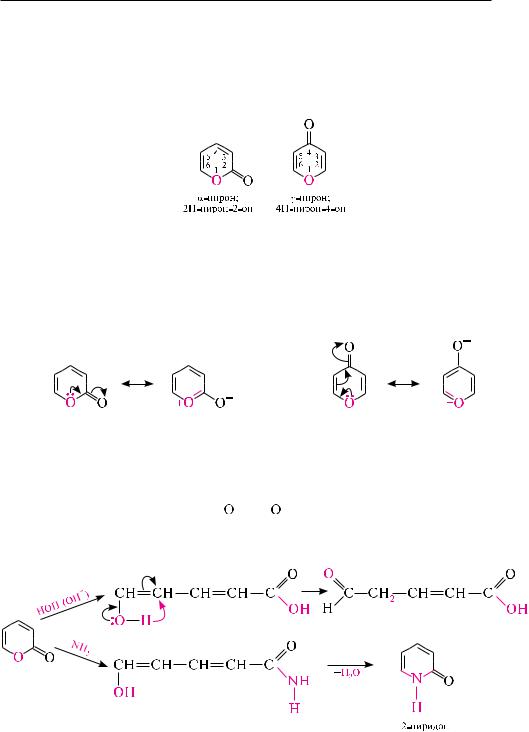
-Пиран (2H-пиран) и -пиран (4H-пиран) представляют собой шестичленные гетероциклические соединения, содержащие в качестве гетероатома один атом кислорода.
Эти гетероциклы являются структурными изомерами и отличаются друг от друга расположением метиленовой группы относительно гетероатома. в молекуле-пирана метиленовая группа находится в -положении, в -пиране — соответственно в -положении.
в - и -пиранах отсутствует замкнутая сопряженная система, из-за чего эти вещества не обладают ароматичностью и характеризуются низкой стабильностью.

Глава 32
1
-Пирон, в результате сопряжения неподеленной пары электронов гетероатома с карбонильной группой, не образует характерных для кетонов производных по карбонильной группе (оксимов, гидразонов, оснований шиффа) и с трудом вступает в реакции присоединения по месту разрыва двойных углерод-углеродных связей. -Пирон при взаимодействии с минеральными кислотами (HCl, HClO4) или алкилгалогенидами образует соли пирилия.
Пирилиевый катион в солях пирилия содержит замкнутую 6 -электронную систему и, подобно бензолу или пиридину, обладает ароматическим характером.
реакции -пирона с нуклеофильными реагентами, аналогично -пирону, как правило, сопровождаются раскрытием цикла по связи O–C. в присутствии аммиака -пирон превращается в -пиридон.
некоторые производные -пирона являются природными веществами. к ним относятся хелидоновая и меконовая кислоты. хелидоновая кислота содержится в траве чистотела (Chelidonium majus), меконовая кислота выделена из мака снот-
ворного (Papaver somniferum).
32.7.2. КУмарИн
кумарин (бензо[b]пиран-2-он, 2-хроменон) представляет собой 


 конденсированную гетероциклическую систему, состоящую из
конденсированную гетероциклическую систему, состоящую из 



 бензольного и -пиронового циклов. По строению кумарин является лактоном цис-о-гидроксикоричной кислоты (кумариновая кислота). он встречается во многих растениях. обладая запахом свежескошенно-
бензольного и -пиронового циклов. По строению кумарин является лактоном цис-о-гидроксикоричной кислоты (кумариновая кислота). он встречается во многих растениях. обладая запахом свежескошенно-
го сена, кумарин придает аромат доннику, ясменнику и другим растениям. синтетически кумарин получают по реакции Перкина (см. с. 418) конденса-
цией салицилового альдегида с уксусным ангидридом в присутствии натрия ацетата.

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
17
Химические свойства кумарина обусловлены наличием в его структуре лактон-
ного и бензольного колец. реакции с нуклеофильными реагентами протекают по лактонному кольцу и, как правило, сопровождаются раскрытием цикла. так, при нагревании кумарина с водным раствором щелочи образуется соль о-гидроксико- ричной кислоты. После подкисления раствора происходит быстрая рециклизация в кумарин.
По бензольному кольцу кумарин вступает в реакции электрофильного замещения (нитрование, сульфирование). Электрофильной атаке в первую очередь подвергается положение 6.
Производные кумарина содержатся во многих растениях и обладают фармакологической активностью. некоторые вещества из группы 4-гидроксикума- ринов оказывают выраженное антикоагулирующее действие, то есть понижают свертываемость крови. на их основе созданы антикоагулянтные лекарственные препараты (неодикумарин, фепромарон, синкумар и др.), применяемые для профилактики и лечения тромбозов.
32.7.3. хрОмОн
Хромон (бензо[b]пиран-4-он, 4-хроменон) представляет собой конденсированную гетероциклическую систему, состоящую из бензольного и -пиронового циклов.
По химическим свойствам хромон напоминает -пирон. Подобно-пирону, при обработке сухим хлороводородом в эфире хромон об-

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
1
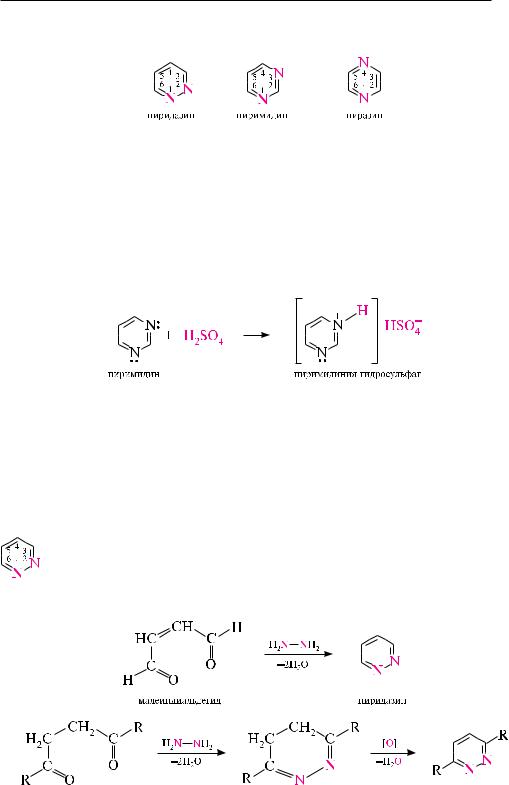
существует три изомерных диазина — пиридазин (1,2-диазин), пиримидин
(1,3-диазин) и пиразин (1,4-диазин).
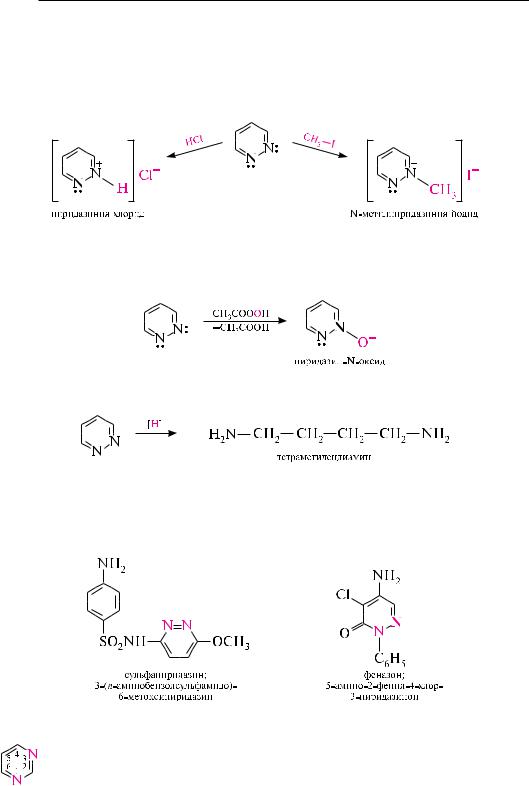
По строению и свойствам эти соединения во многом напоминают пиридин. Подобно пиридину, молекулы пиридазина, пиримидина и пиразина имеют в своем составе замкнутую сопряженную систему из 6 -электронов и обладают ароматическим характером. неподеленные пары электронов атомов азота не участвуют в сопряжении и придают диазинам основные свойства. из-за взаимного дезактивирующего влияния атомов азота друг на друга пиридазин, пиримидин и пиразин являются более слабыми основаниями, чем пиридин (рKвн+ пиридазина в воде — 2,33; пиримидина — 1,3; пиразина — 0,6; пиридина — 5,25). По этой причине диазины, несмотря на наличие двух основных центров, образуют соли только с одним эквивалентом минеральной кислоты.
наличие в структуре молекул пиридазина, пиримидина и пиразина двух атомов азота пиридинового типа приводит к значительному понижению электронной плотности на атомах углерода диазинового цикла. Поэтому диазины характеризуются очень низкой реакционной способностью в реакциях Sе и, наоборот, высокой активностью в реакциях SN. Реакции электрофильного замещения возможны только тогда, когда диазиновый цикл активирован электронодонорными группами (–NH2, –OH и др).
ПИрИДаЗИн (1,2-ДИаЗИн)
Пиридазин — бесцветная жидкость со слабым запахом (т. кип. 207 с), растворимая в воде, этаноле, бензоле, диэтиловом эфире, не растворимая в петролейном эфире.
Пиридазин и его производные получают конденсацией гидразина с на-
сыщенными или ненасыщенными 1,4-дикарбонильными соединениями.

 ) -пирон вступает в реакции нуклео-
) -пирон вступает в реакции нуклео-