
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf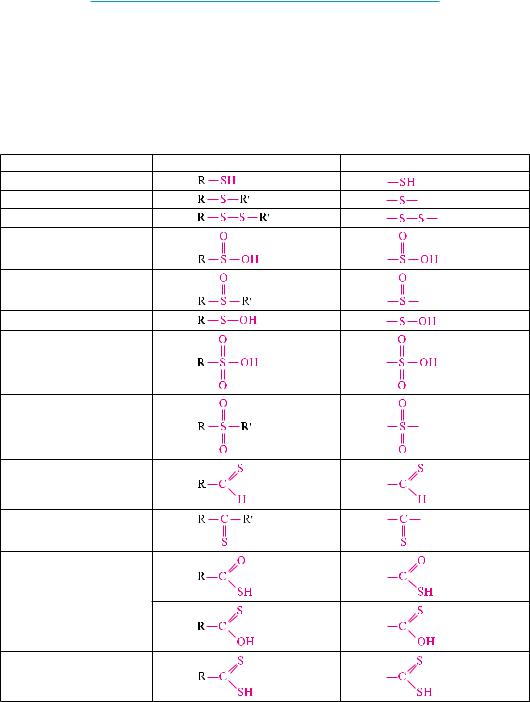
Глава 29
522
29.1. ТиОлы
Тиолами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены меркаптогруппой —SH.
Меркаптогруппу еще называют тиольной, или сульфгидрильной группой. тиолы можно также рассматривать как тиоаналоги гидроксильных производных углеводородов, в молекулах которых атом кислорода группы –OH заменен на атом серы. для соединений этого класса используют еще название «меркаптаны».
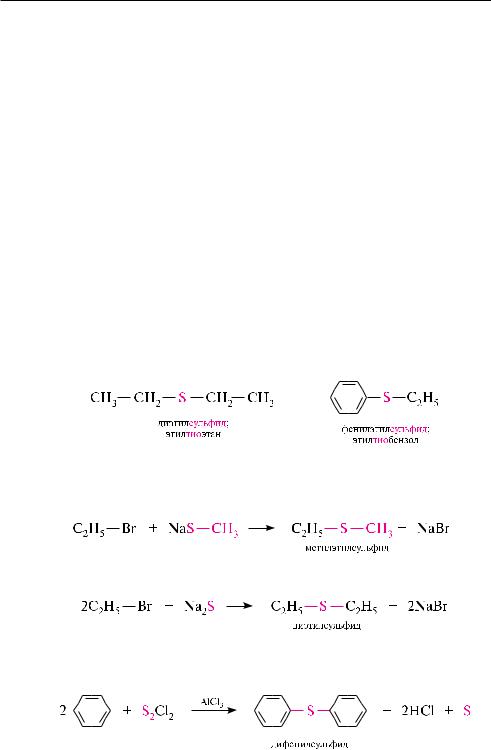
Тиолы, в которых меркаптогруппа связана с алифатическим радикалом, называют тиоспиртами, а с ароматическим радикалом — тиофенолами:
номенклатура тиолов аналогична номенклатуре гидроксильных производных с той лишь разницей, что вместо суффикса -ол используется суффикс -тиол или вместо префикса гидрокси- применяется префикс меркапто-:
тиолы, за исключением метантиола,— жидкие или твердые вещества. как правило, их температуры плавления и кипения ниже гидроксианалогов, что связано с меньшей электроотрицательностью атома серы по сравнению с атомом кислорода и в соответствии с этим меньшей склонностью к образованию водородных связей. По этой же причине тиолы по сравнению со спиртами и фенолами хуже растворяются в воде. как правило, меркаптаны ядовиты и обладают чрезвычайно неприятным запахом.
СПОСОБЫ ПОлУЧенИя
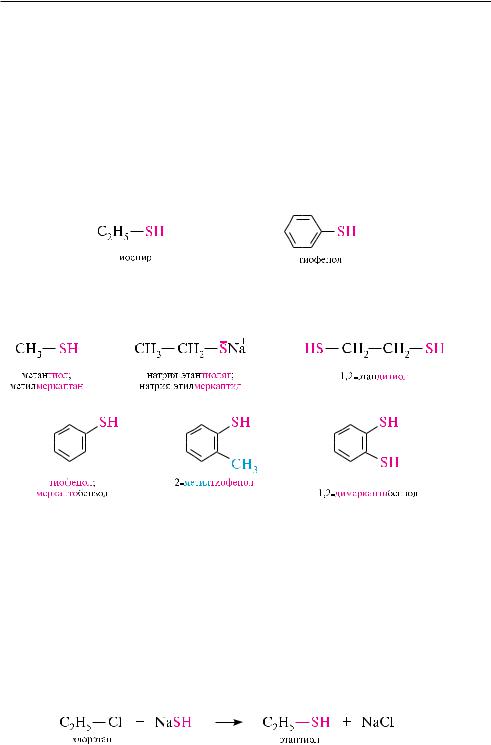
Взаимодействие галогеналканов с гидросульфидами щелочных металлов. При действии на первичные и вторичные галогеналканы калия или натрия гидросульфида образуются тиоспирты. реакция протекает по механизму SN (см. с. 262):
реакция невозможна с третичными галогеналканами, так как в данном случае преобладает процесс элиминирования.
СераОрГанИЧеСКИе СОеДИненИя
523
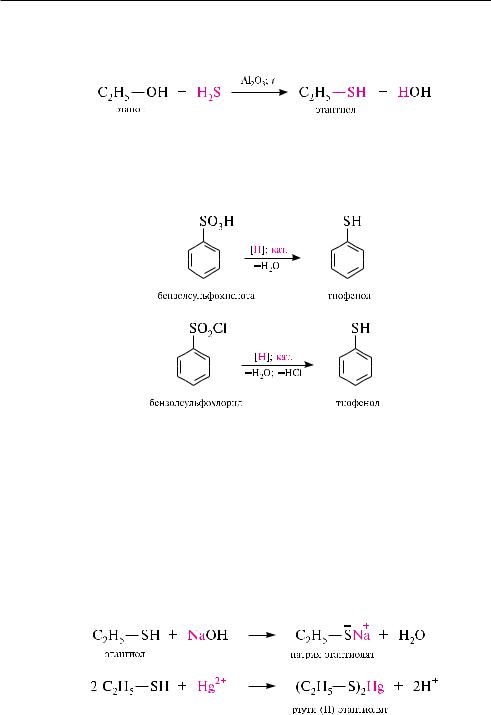
Взаимодействие спиртов с сероводородом. При обработке спиртов сероводоро-
дом в присутствии катализатора Al2O3 при температуре 350—400 °с образуются тиоспирты:
в реакцию вступают только первичные спирты.
Восстановление аренсульфокислот и аренсульфонилхлоридов. При восстановле-
нии аренсульфокислот и аренсульфонилхлоридов образуются тиофенолы. в качестве восстановителей используют цинк в растворе серной кислоты или лития алюмогидрид LiAlH4 :
хИмИЧеСКИе СВОЙСТВа
По химическим свойствам тиолы во многом сходны с гидроксильными производными углеводородов. особенности их химического поведения обусловлены уменьшением прочности связи S—н по сравнению со связью O—H в спиртах и фенолах. именно поэтому тиолы обладают более выраженными кислотными свойствами, чем соответствующие им гидроксианалоги (см. с. 95). реакции тио-
лов в основном обусловлены ионизацией связи S—H и нуклеофильными свойствами атома серы.
Образование тиолятов (меркаптидов). тиолы, как более сильные кислоты, чем аналогичные OH-кислоты, легко образуют соли — тиоляты (меркаптиды) не только со щелочными металлами, но также и с ионами тяжелых металлов:
на этом свойстве тиолов основано их применение в медицине в качестве антидотов при отравлении тяжелыми металлами.
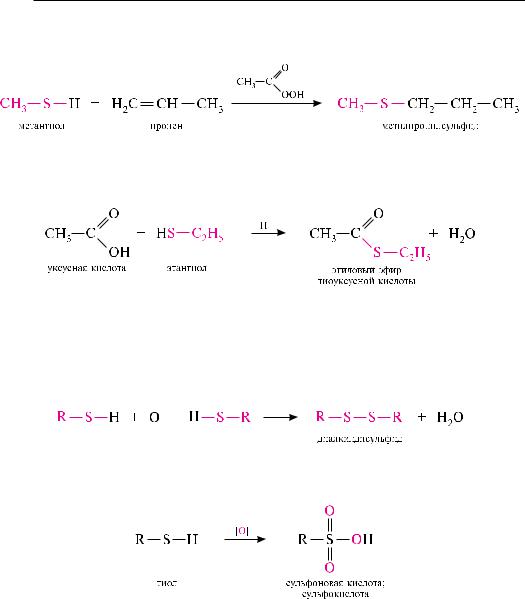
Взаимодействие тиолов с алкенами. в присутствии пероксидов или под действием уф-излучения тиолы присоединяются к алкенам по месту разрыва двой-
Глава 29
524
ной связи с ориентацией против правила Марковникова. реакция протекает по механизму AR:
ацилирование тиолов. реакция тиолов с карбоновыми кислотами катализируется сильными кислотами и приводит к образованию тиоэфиров карбоновых кислот:
данная реакция аналогична реакции этерификации карбоновых кислот и спиртов (см. с. 431).
Окисление тиолов. в отличие от спиртов, тиолы окисляются не по атому углерода, а по атому серы. Продукты реакции зависят от условий окисления.
При окислении тиолов в мягких условиях (H2O2, CuCl2 и др.) образуются диалкилдисульфиды:
При окислении тиолов сильными окислителями (KMnO4, HNO3 или HOI) образуются сульфокислоты:
ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
метантиол (метилмеркаптан) сн3—SH. бесцветный газ с отвратительным запахом, растворим в воде, спирте, эфире (т. кип. 5,95 °с). Получают взаимодействием метанола с сероводородом в паровой фазе в присутствии катализатора.
Применяют в производстве лекарственного препарата метионина, в качестве одоранта для топлива, в том числе бытового газа (порог запаха 2,1·10–8 мг/л).
Тиофенол (фенилмеркаптан) с6н5—SH. бесцветная жидкость с неприятным запахом, нерастворима в воде, легкорастворима в органических растворителях (т. кип. 169 °с). Получают при восстановлении бензолсульфохлорида цинком в серной кислоте.
Глава 29
52
хИмИЧеСКИе СВОЙСТВа
сульфиды по своим химическим свойствам во многом напоминают простые эфиры. однако для них характерны особенности, связанные с большей поляризуемостью атома серы по сравнению с атомом кислорода.
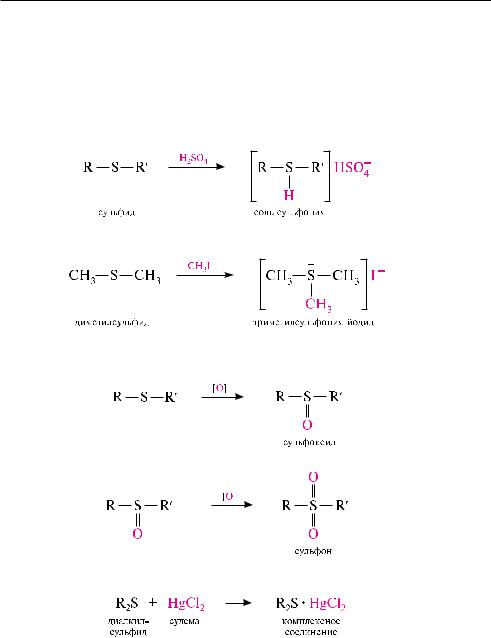
Образование солей сульфония. сульфиды, как и простые эфиры, являются слабыми основаниями. они способны протонироваться в кислой среде. При взаимодействии сульфидов c концентрированной серной кислотой образуются соли сульфония:
алкилирование сульфидов. сульфиды сравнительно легко реагируют с галогеналканами с образованием достаточно стабильных галогенидов триалкилсульфония:
Окисление сульфидов. Продукты окисления сульфидов в зависимости от природы окислителей и условий реакции могут быть различными. так, при окислении сульфидов йодоводородной кислотой при 0 °с образуются сульфоксиды:
дальнейшее окисление сульфоксидов приводит к сульфонам:
Взаимодействие сульфидов с солями тяжелых металлов протекает легко и при-
водит к образованию комплексов:
данная особенность позволяет использовать некоторые сульфиды в качестве антидотов при отравлении солями тяжелых металлов. реакция также применяется в анализе для идентификации сульфидов.
ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Диметилсульфид CH3—S—CH3. бесцветная летучая жидкость с неприятным запахом (т. кип. 38 °с). синтезируют из метанола и сероводорода в присутствии катализатора.
используют для производства диметилсульфоксида.
СераОрГанИЧеСКИе СОеДИненИя
527
Иприт ( -дихлордиэтилсульфид) ClCH2CH2—S—CH2CH2Cl. бесцветное кристаллическое вещество (т. кип. 157 °с), труднорастворимое в воде, хорошо — в органических растворителях. технический иприт представляет собой буроватую жидкость с запахом горчицы. чрезвычайно ядовит.
иприт — боевое отравляющее вещество (бов) кожно-нарывного и общетоксического действия, противоплазматический яд. как бов был впервые применен Германией в 1917 году у бельгийского города ипр (отсюда и название «иприт») против англо-французских войск. смертельная концентрация иприта при попадании на кожу 70 мг/кг. в качестве защиты используют противогаз и спецодежду. для дегазации используют хлорирующие и окисляющие агенты.
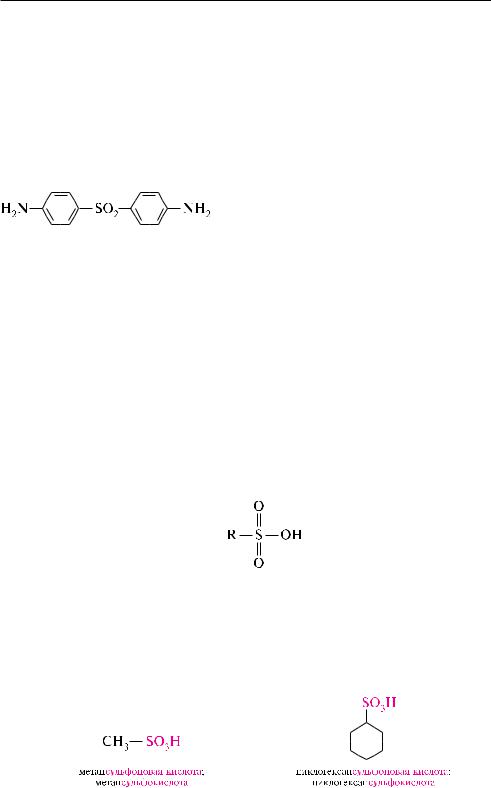
Диафенилсульфон (4,4 -диаминодифенил-
сульфон). Применяется в медицине как лекарственный препарат для лечения лепры (проказы).
Димексид (диметилсульфоксид, дМсо) (CH3)2S+—O–. бесцветная жидкость
(т. кип. 189 °с).
органический растворитель, широко использующийся в органическом синтезе, промышленности. Применяется как лекарственный препарат с противовоспалительным, обезболивающим и антимикробным свойствами. в основном используется для наружного применения (примочки, мази, растворы и др.).
Цистамина дигидрохло-
рид бис-( -аминоэтил)ди- сульфида дигидрохлорид . Применяется как лекарственный препарат для профилактики лучевой болезни.
29.3. сулЬФОнОвые КислОТы (сулЬФОКислОТы)
Сульфоновыми кислотами (сульфокислотами) называют производные углево-
дородов, в молекулах которых один или несколько атомов водорода замещены сульфогруппой —SO3H.
общая формула сульфокислот:
КлаССИФИКаЦИя И нОменКлаТУра
сульфоновые кислоты классифицируют в зависимости от природы углеводо-
родного радикала на алифатические, алициклические, ароматические и др.
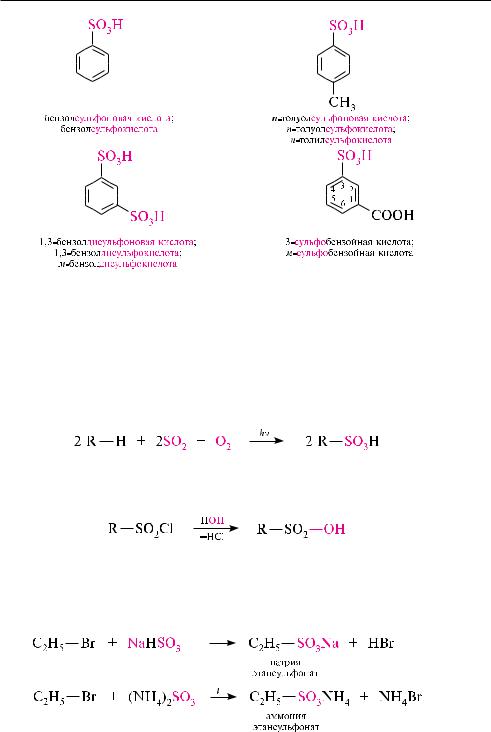
в соответствии с заместительной номенклатурой IUPAC названия сульфокислот образуют исходя из названий соответствующего углеводорода, к которому добавляют суффикс -сульфоновая кислота или -сульфокислота.
Глава 29
528
если в составе гетерофункционального соединения сульфогруппа не является старшей, то ее отражают в названии с помощью префикса сульфо-.
сульфокислоты — кристаллические вещества, растворимые в воде. Гигроскопичны.
СПОСОБЫ ПОлУЧенИя
Сульфоокисление. данный метод позволяет в промышленном масштабе осуществить синтез алкан- и циклоалкансульфоновых кислот из соответствующих углеводородов.
реакция протекает по свободнорадикальному механизму. Гидролиз сульфонилхлоридов. алкансульфоновые кислоты иогут быть получе-
ны в результате гидролиза соответствующих алкансульфонилхлоридов.
Окисление тиолов (см. с. 524).
Взаимодействие алкилгалогенидов с гидросульфитами и сульфитами щелочных металлов (аммония). в лабораторных условиях алкансульфокислоты получают при взаимодействии галогеналканов с гидросульфитом натрия или сульфитом аммония.
Последующее подкисление растворов приводит к выделению сульфокислот.
Взаимодействие альдегидов и кетонов с гидросульфитами щелочных метал-
лов. в результате нуклеофильного присоединения гидросульфит-иона к альдеги-
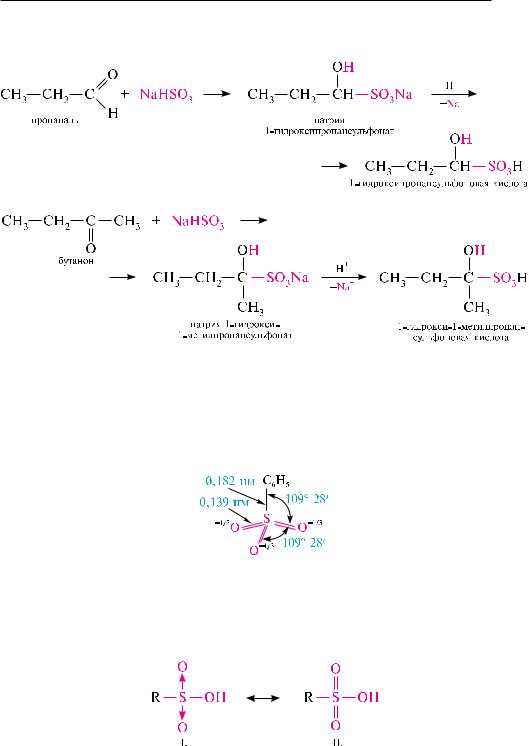

Глава 29
530
хИмИЧеСКИе СВОЙСТВа
сульфогруппа оказывает на углеводородный радикал сильное электроакцепторное влияние (–I, –M-эффекты). в результате значительной электроотрицательности атома серы связь с—S сильно полярна.
для сульфокислот характерны следующие группы реакций:
реакции с участием сульфогруппы (образование солей, галогенангидридов, амидов, сложных эфиров);
нуклеофильное замещение сульфогруппы (SN);
электрофильное замещение (SE) по ароматическому ядру.
реакции с участием сульфогруппы. Кислотные свойства. сульфоновые кислоты
проявляют кислотные свойства, которые по силе можно сравнить со свойствами минеральных кислот. значения рка сульфоновых кислот изменяются в том же интервале, что и значения рка сильных минеральных кислот (–5,0…–8,0).
сульфокислоты образуют соли (сульфонаты) со щелочными, щелочноземельными металлами, их оксидами, гидроксидами.
При взаимодействии сульфокислот с галогенирующими реагентами (PCl3, PCl5, SOCl2 и др.) образуются сульфонилхлориды:
для получения аренсульфонилхлоридов также используют хлорсульфоновую кислоту.
ароматические сульфонилхлориды по сравнению с алифатическими менее активны. сульфонилхлориды широко используют в органическом синтезе амидов, сложных эфиров и др.
Сульфонамиды и их производные получают при взаимодействии сульфонилхлоридов с аммиаком или аминами.
ароматические сульфонамиды проявляют слабые кислотные свойства и растворимы в щелочах.
