304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5 1
в реакциях ацилирования наряду с хлорангидридами карбоновых кислот можно использовать сложные эфиры. так, при действии этилформиата на пиррилмагниййодид на холоде образуется N-формилпиррол, при нагревании — -фор- милпиррол.
в некоторых реакциях электрофильного замещения пиррол напоминает фенол, а его N-металлические производные — феноксиды щелочных металлов. в частности, пиррол, как и фенол, вступает в реакцию азосочетания:
Пиррол при взаимодействии с хлороформом в щелочной среде подвергается не только формилированию (см. реакция Реймера—Тимана, c. 373), но и претерпевает расширение цикла:
натрия пирролид карбоксилируется углерода (IV) оксидом (см. реакция коль- бе—Шмитта, c. 373) с образованием 2-пирролкарбоновой кислоты:
Фуран и его производные. занимая промежуточное положение между ароматическими соединениями и 1,3-диенами, фуран вступает в характерную для сопряженных диенов реакцию дильса—альдера. так, с малеиновым ангидридом он легко образует соответствующий продукт присоединения.

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя |
|
5 3 |
|||||
|
|
|
|
|
|
||
зуют в фармацевтической промышленности |
|
|
|
||||
|
|
|
|
||||
как связывающее средство в производстве |
|
|
|
|
|||
таблеток. |
|
|
|
|
|
|
|
При сополимеризации |
винилпирроли- |
|
|
|
|
||
дона, акриламида и этилакрилата получают |
|
|
|
|
|||
биорастворимый полимер для глазных ле- |
|
|
|
|
|||
карственных пленок, который обеспечивает |
|
|
|
|
|||
продолжительное |
действие |
лекарственных |
|
|
|
|
|
веществ (пролонгирующий эффект). |
|
|
|
|
|||
Пролин (2-пирролидинкарбоновая кис- |
|
|
|
|
|||
лота) и оксипролин (4-гидрокси-2-пирроли- |
|
|
|
|
|||
динкарбоновая кислота) — являются -ами- |
Ганс Эйген |
|
|
||||
нокислотами гетероциклического ряда, в ко- |
|
|
|||||
|
ФИШер |
|
|
||||
торых общий -аминокислотный фрагмент |
|
|
|
||||
(1881—1 45) |
|
|
|||||
—NH—CH(COOH)— включен в пирроли- |
|
|
|||||
немецкий химик-органик и био- |
|||||||
диновый цикл. |
|
|
|||||
|
|
химик. |
|
|
|
||
|
|
|
|
|
|
||
|
|
|
основные |
исследования |
посвя- |
||
|
|
|
щены химии пиррола и его произ- |
||||
|
|
|
водных. изучал пиррольные пигмен- |
||||
|
|
|
ты, входящие в состав крови, желчи, |
||||
|
|
|
содержащиеся в зеленых растениях. |
||||
|
|
|
осуществил синтез порфирина (1927) |
||||
Пролин имеет |
один асимметрический |
и билирубина (1931), установил стро- |
|||||
атом углерода и поэтому существует в виде |
ение хлорофиллов а (1939) и b (1940). |
||||||
двух оптически активных изомеров и од- |
синтезировал (1929) гемин и доказал, |
||||||
что в его составе — белок глобин и |
|||||||
ного рацемата. оксипролин содержит два |
железосодержащий комплекс гемин. |
||||||
хиральных центра, |
а следовательно, может |
||||||
лауреат |
нобелевской |
премии |
|||||
существовать в виде двух пар энантиомеров |
|||||||
(1930). |
|
|
|
||||
и двух рацематов. L-Пролин и L-оксипро- |
|
|
|
||||
лин входят в состав белков. особенно богат ими коллаген.
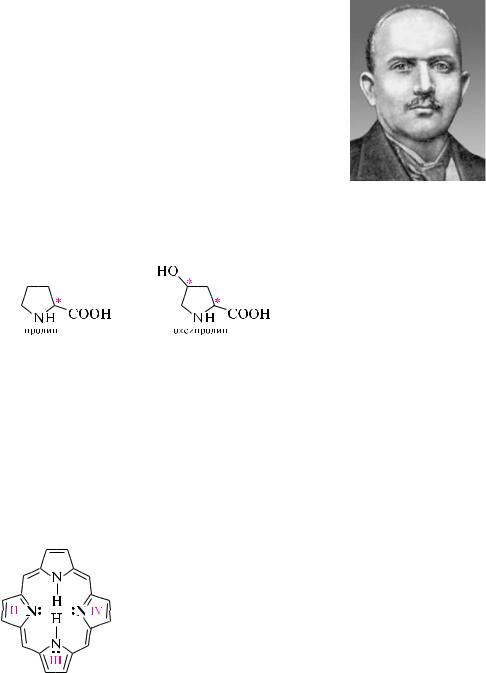
Порфин — кристаллическое вещество темно-красного цвета. По химической структуре представляет собой макроциклическую сопряженную систему, состоящую из пиррольного (III), пирролинового (I) и двух изопиррольных (II, IV) ядер, связанных между собой мети-  новыми группами =CH—. Порфин является ароматическим
новыми группами =CH—. Порфин является ароматическим
соединением. он имеет плоское строение молекулы, содержит
замкнутую сопряженную систему с числом -электронов — 26
(11 -связей и 2 пары неподеленных электронов при атомах азота), что отвечает правилу хюккеля (4n + 2, n = 6). Производные порфина получили общее название «порфирины».
в виде комплексов с металлами порфирины входят в состав таких важных природных соединений, как гемоглобин и хло-
рофилл.
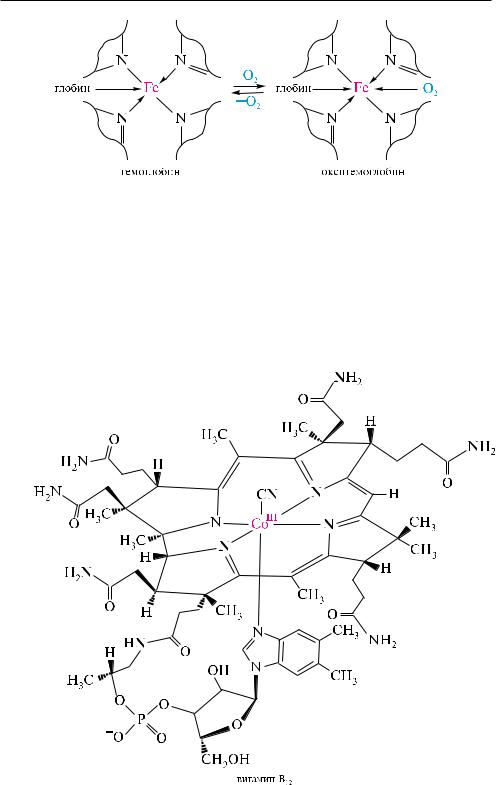
Гемоглобин — красящее вещество крови, содержащееся в эритроцитах. он представляет собой сложный белок — хромопротеид, состоящий из белка глобина и окрашенной в красный цвет небелковой части — гема. По химической структуре гем является комплексом порфина с Fe (II). При кислотном гидроли-

Глава 32
5 4
зе гемоглобина свободный гем легко окисляется на воздухе с образованием гемина, имеющего ту же структуру, что и гем, но содержащего Fe (III):
в 1929 году Ганс Эйген фишер установил строение гемина и осуществил его синтез.
Гем, координационно связанный с глобином (за счет координационной связи между Fe2+ и имидазольным фрагментом гистидина белковой молекулы), образует гемоглобин.
Гемоглобин в организме выполняет роль переносчика кислорода из легких в ткани. Молекула кислорода обратимо реагирует с гемоглобином с образованием оксигемоглобина.
некоторые вещества, в частности углерода (II) оксид и соли циановодородной кислоты, образуют с гемоглобином более стабильные комплексы, чем кислород, и тем самым блокируют действие гемоглобина. такие соединения относятся к дыхательным ядам.
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5 5
частично гидрированный порфиновый цикл, координационно связанный с магнием, входит в состав зеленого пигмента растений — хлорофилла. из растений выделены хлорофилл и хлорофилл .
хлорофиллы содержат три асимметрических атома углерода и поэтому обладают оптической активностью. синтез хлорофиллов был впервые осуществлен
в1960 году робертом бёрнсом вудвордом. хлорофиллы играют важную роль
впроцессе фотосинтеза, превращая световую энергию солнечных лучей в энергию химических связей.
Витамин B12 (цианокобаламин). витамин B12 был впервые выделен из печени теплокровных животных американским химиком карлом августом фолкерсом
в1948 году. однако только в 1956 году английский химик дороти кроуфут-ходж- кин установила с помощью рентгеноструктурного анализа его строение.

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5 7
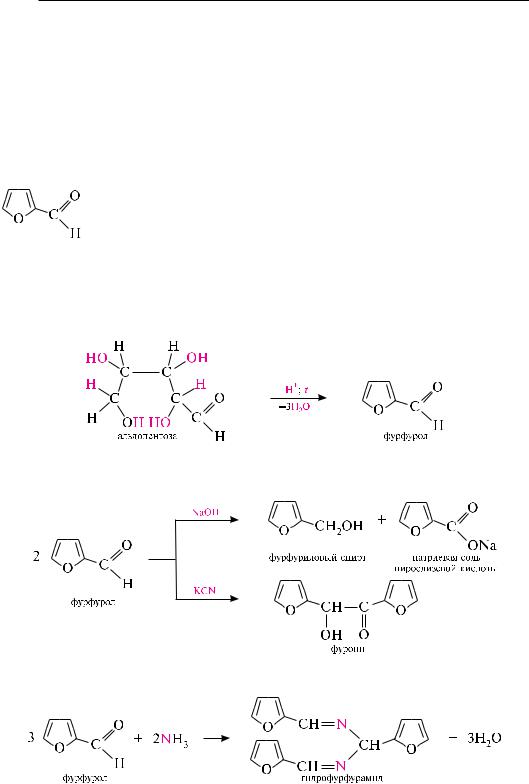
фурфурол как альдегид окисляется аммиачным раствором серебра оксида, образуя пирослизевую кислоту, восстанавливается в фурфуриловый спирт, присоединяет натрия гидросульфит, с гидроксиламином образует оксим, с фенилгидразином — фенилгидразон и т. д.
для фурфурола, кроме реакций по альдегидной группе, характерны реакции по фурановому ядру. фурфурол легко вступает в реакции SE, при этом наиболее реакционноспособно — положение 5. вследствие электроноакцепторного влияния альдегидной группы, приводящего к понижению электронной плотности на углеродных атомах фуранового цикла, фурфурол менее ацидофобен, чем фуран.
нитрование фурфурола проводят концентрированной азотной кислотой в среде уксусного ангидрида. в процессе реакции получают ацилаль — 5-нитрофурфу- ролдиацетат, который при гидролизе в присутствии разведенной серной кислоты образует 5-нитрофурфурол:
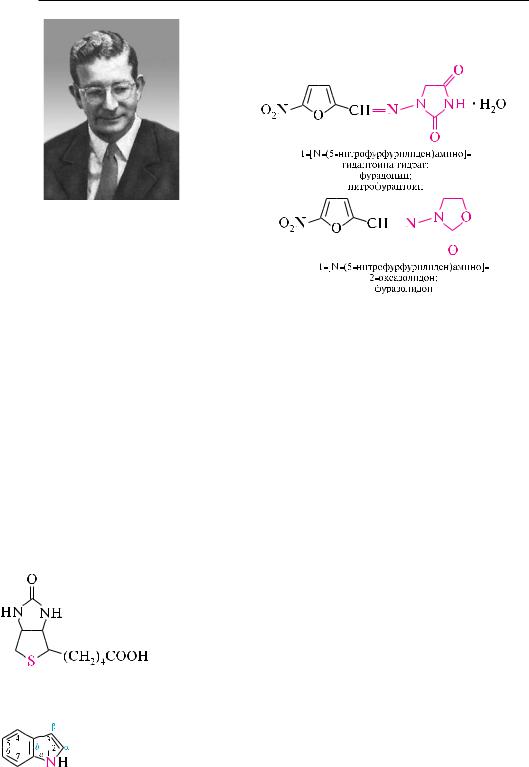
5-нитрофурфурол является исходным веществом для синтеза ряда лекарственных препаратов. так, при взаимодействии 5-нитрофурфурола с семикарбазидом образуется семикарбазон 5-нитрофурфурола, который применяется в медицине под названием «фурацилин».
Глава 32
5 8
Представителями группы лекарственных препаратов нитрофуранового ряда являются также фурадонин и фуразолидон.
роберт Бёрнс ВУДВОрД
(1 17—1 7 ) |
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|||
американский химик-органик. |
|
|
|
|
|||
|
|
|
|
||||
крупнейший |
специалист в |
области |
|
|
|
|
|
синтетической и структурной орга- |
|
|
|
|
|||
нической химии. совместно с со- |
|
|
|
|
|||
трудниками и учениками осуществил |
Препараты нитрофуранового ряда об- |
||||||
синтезы: хинина (1944), семперве- |
|||||||
ладают высокой антибактериальной актив- |
|||||||
рина (1949), холестерина и кортизо- |
ностью. они находят широкое применение |
||||||
на (1951), стрихнина и ланостерина |
в медицине для лечения гнойных и воспа- |
||||||
(1954), резерпина (1956), хлорофиллов |
|||||||
лительных процессов. особенно ценным |
|||||||
и (1960), витамина в12 (1971). |
|||||||
свойством этих препаратов является их спо- |
|||||||
значителен его вклад в установле- |
|||||||
собность в ряде случаев проявлять эффект |
|||||||
ние структур |
сложных органических |
против форм возбудителей, устойчивых |
|||||
соединений (пенициллин, патулин, |
|||||||
к сульфаниламидам и антибиотикам. |
|||||||
террамицин, биомицин, стрептоми- |
|
|
|
|
|||
цин). установил (1952) сэндвичевую |
ПрОИЗВОДнЫе ТИОФена |
||||||
структуру дициклопентадиенилжелеза |
|||||||
Биотин (витамин H). Гетероциклическая |
|||||||
и назвал его ферроценом. |
|
||||||
лауреат |
нобелевской |
премии |
часть молекулы биотина состоит из гидриро- |
||||
(1965). |
|
|
ванных тиофенового и имидазольного колец, |
||||
|
|
|
а боковая цепь представлена остатком вале- |
||||
риановой кислоты. биотин впервые выделен в 1935 году из яичного желтка, при этом для получения 1 мг вещества потребовалось 225 кг сухого яичного желтка.
особенно богаты биотином почки, печень, горох, бобы, картофель. биотин входит в состав активного центра ферментов, принимающих участие в синтезе высших жирных кислот, белков, нуклеиновых кислот и др. При недостатке биотина в организме развиваются воспалительные заболевания кожи (дерматиты), сопровож-
дающиеся выпадением волос и поражением ногтей.
32.4. индОл
Молекула индола (бензо[b]пиррола) представляет собой конденсированную гетероциклическую систему, состоящую из пиррольного и бензольного колец. нумерацию атомов в индоле начинают с гетероатома, атомы углерода в пиррольном цикле обозначают также буквами и .
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5
32.4.1. СПОСОБЫ ПОлУЧенИя
индол содержится в небольших количествах (3—5 %) в каменноугольной смоле, откуда может быть выделен в чистом виде.
индол и его гомологи могут быть получены различными синтетическими методами.
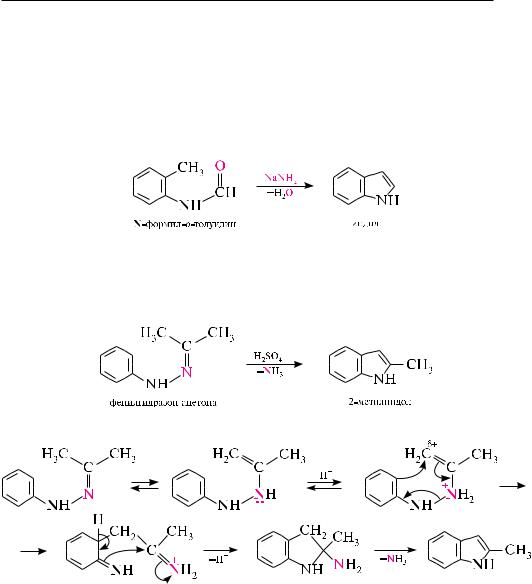
Циклизация N-формил-о-толуидина. реакция протекает в присутствии сильного основания (калия трет-бутанолята или натрия амида) и относится к реакциям конденсации кротонового типа.
Перегруппировка фенилгидразонов альдегидов или кетонов в присутствии кис-
лотного катализатора (метод Фишера). Этот способ применяют для синтеза гомологов индола с алкильными заместителями в пиррольном ядре. реакция протекает при нагревании фенилгидразонов альдегидов (за исключением формальдегида и ацетальдегида) или кетонов в присутствии серной кислоты или цинка хлорида:
Механизм реакции можно представить следующим образом:
32.4.2. ФИЗИЧеСКИе СВОЙСТВа
индол — бесцветное кристаллическое вещество (т. пл. 52 с), имеющее своеобразный неприятный запах; хорошо растворим в этаноле, эфире и толуоле, практически не растворим в воде. в малых концентрациях индол обладает приятным цветочным запахом.
32.4.3. хИмИЧеСКИе СВОЙСТВа
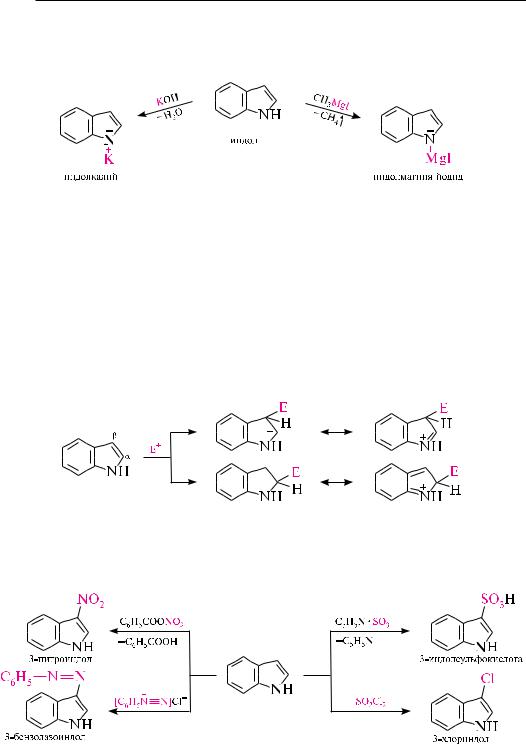
индол является гетероароматическим соединением. По химическим свойствам он напоминает пиррол. Под действием минеральных кислот индол осмоляется, что указывает на его ацидофобность. Подобно пирролу, в реакциях с сильными