304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
571
32.4.4. ВажнеЙШИе ПрОИЗВОДнЫе ИнДОла
Индоксил (3-гидроксииндол, 3-оксоиндолин). Желтое кристаллическое вещество с сильным фенольным запахом (т. пл. 85 °с), растворяется в воде, спиртах, ацетоне, эфире и бензоле. в растворах индоксил существует в двух таутомерных формах — кетонной и енольной (кето-енольная таутомерия), в кристаллическом состоянии — в кетоформе (3-оксоиндолин).
в промышленности индоксил получают взаимодействием анилина с натриевой солью хлоруксусной кислоты. образующаяся в процессе реакции натриевая соль N-фениламиноуксусной кислоты при нагревании (180—200 °с) с натрия амидом превращается в индоксил.
мелатонин
Мелатонин — нейрогормон, вырабатываемый клетками эпифиза. он регулирует цикл «сон — бодрствование», температуру тела, выработку гормонов. уровень мелатонина увеличивается в темное время суток
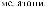 и снижается с приближением утра. люди с высоким уровнем мелатонина спят дольше и крепче. концентрация данного гормона в крови изменяется с возрастом: у шестилетних
и снижается с приближением утра. люди с высоким уровнем мелатонина спят дольше и крепче. концентрация данного гормона в крови изменяется с возрастом: у шестилетних
детей его в пять раз больше, чем у восьмидесятилетних стариков. именно поэтому молодые люди имеют меньше проблем со сном по сравнению с пожилыми.
Мелатонин вызывает концентрирование пигмента меланина. Пигментация кожи, цвет волос и радужной оболочки глаза человека зависят от количества и распределения меланина в клетках. возникновение загара и появление веснушек — результат усиленного образования и отложения меланина в коже. Прекращение биосинтеза меланина вызывает поседение волос.
Глава 32
572
индоксил легко вступает в реакции, характерные для карбонильных соединений и фенолов. в щелочной среде индоксил легко окисляется кислородом воздуха, образуя синий краситель — индиго.
Индиго. темно-синее с медным отливом кристаллическое вещество (т. пл. 390—392 с с разложением), растворяется в хлороформе, нитробензоле, анилине, ледяной уксусной кислоте, не растворяется в воде, спиртах,
эфире.

 индиго — один из самых древних органических красителей, отличающийся яркой окраской и высокой светоустойчивостью. оно было известно еще древним египтянам и народам индии,
индиго — один из самых древних органических красителей, отличающийся яркой окраской и высокой светоустойчивостью. оно было известно еще древним египтянам и народам индии,
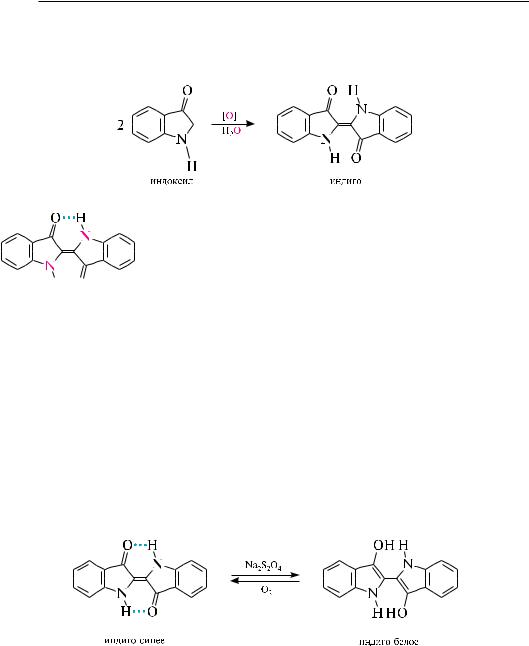
которые получали его из тропических растений рода Indigofera. синтетическим путем индиго впервые было получено в 1896 году. в настоящее время наибольшее распространение получил способ, основанный на взаимодействии анилина с натриевой солью хлоруксусной кислоты с последующим окислением образовавшегося индоксила кислородом воздуха (см. схему получения индоксила, с. 571).
Молекула индиго имеет транс-строение и образует между группами с=о
иNH внутримолекулярные водородные связи.
вприсутствии восстановителей (глюкоза, натрия дитионат Na2S2O4) синее индиго легко восстанавливается с образованием бесцветного лейкооснования — белого индиго, которое, в отличие от синего, хорошо растворимо в воде. на воздухе очень легко протекает обратный процесс — белое индиго окисляется до синего.
Это свойство индиго используют при крашении тканей. Поскольку синее индиго не растворяется в воде, его вначале восстанавливают Na2S2O4 в белое индиго (растворимую форму) и полученным раствором обрабатывают ткань. затем на воздухе происходит окисление белого индиго в синее, и ткань при этом окрашивается в синий цвет.
Метод крашения, при котором краситель образуется на ткани из бесцветного соединения, называют кубовым крашением, а само индиго относится к кубовым красителям.

Глава 32
574
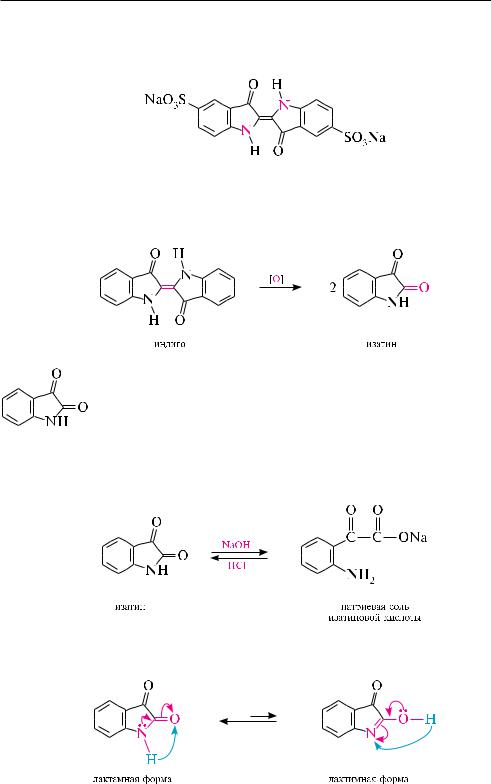
изатин проявляет свойства карбонильных соединений, причем в реакци-
ях принимает участие -карбонильная группа. активность карбонильной группы в -положении значительно снижена +М-эффектом группы NH. так, изатин вступает в реакцию с гидроксиламином и фенилгидразином, образуя соответственно оксим и гидразон.
атом водорода группы NH в молекуле изатина, как и в индоле, обладает значительной подвижностью и может замещаться на щелочной металл. изатин широко применяется в органическом синтезе, а также как аналитический реагент для фотометрического определения примеси тиофена в бензоле.
Триптофан [2-амино-3-( -индолил)пропионо- вая кислота]. кристаллическое вещество (т. пл.
289 с), растворимое в горячей воде и спирте, нерастворимое в хлороформе. триптофан содержит один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров
и одного рацемата. L-триптофан является незаменимой -аминокислотой, входящей в состав белков.
Серотонин [5-гидрокси-3-( -аминоэтил)индол]. кристаллическое вещество (т. пл. 207—212 с), растворимое в воде, нерастворимое в органических растворителях. серотонин является биогенным амином, который играет важную роль
в процессах жизнедеятельности организма. он принимает участие в передаче нервных импульсов, вызывает сокращение гладкой мускулатуры внутренних органов и сужение кровеносных сосудов, повышает стойкость капилляров и количество тромбоцитов в крови. в организме образуется из триптофана. с нарушением обмена серотонина связывают появление симптомов шизофрении.
серотонин применяется в медицине в виде соли с адипиновой кислотой как антигеморрагическое средство.
β-Индолилуксусная кислота (гетероауксин). кристаллическое вещество (т. пл. 168—169 с), растворимое в воде и этиловом спирте. Гетероауксин является продуктом окислительного дезами-
нирования триптофана. он оказывает стимулирующее
влияние на рост растений (гормон роста) и широко применяется в сельском хозяйстве.
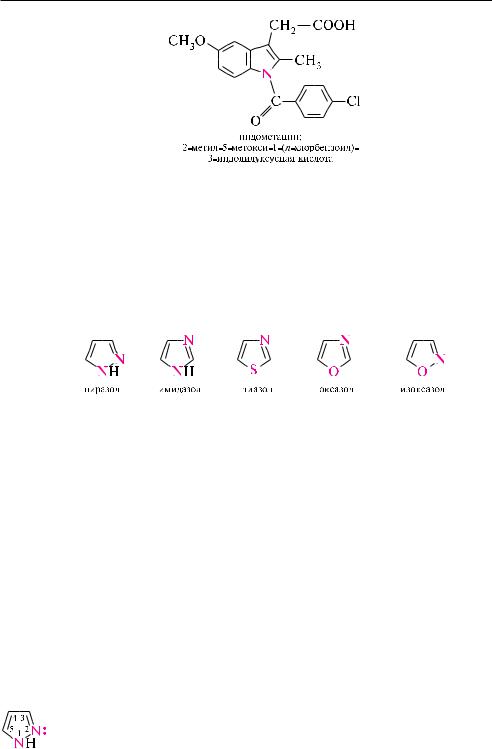
на основе -индолилуксусной кислоты создан лекарственный препарат — индометацин, обладающий сильным противовоспалительным действием.
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
575
32.5. ПЯТиЧленные геТерОциКлиЧесКие сОединениЯ с двуМЯ геТерОаТОМаМи
важнейшими представителями многочисленного класса пятичленных гетероциклов с двумя гетероатомами являются пиразол, имидазол, тиазол, оксазол
и изоксазол.
Поскольку в этих соединениях по крайней мере один из двух гетероатомов является азотом, они получили общее название «азолы».
Азолами называют пятичленные гетероароматические соединения, которые содержат в цикле не менее двух гетероатомов, один из которых — пиридиновый атом азота, а также би- и полициклические системы на основе азольного цикла.
все приведенные гетероциклы обладают ароматичностью. неподеленная пара электронов атома азота пиридинового типа не участвует в образовании ароматического секстета и придает гетероциклам основные свойства. кроме того, атом азота пиридинового типа, обладая большей электроотрицательностью, чем атом углерода, уменьшает -электронную плотность на углеродных атомах цикла и тем самым снижает по сравнению с фураном, пирролом и тиофеном реакционную способность указанных гетероциклов в реакциях электрофильного замещения.
32.5.1. ПИраЗОл
СПОСОБЫ ПОлУЧенИя
в природе пиразол (1,2-диазол) и его производные не встречаются. известен ряд важных синтетических способов получения пиразола.
Присоединение диазоалканов к ацетиленовым углеводородам. Пиразол в услови-
ях этой реакции получают присоединением диазометана к ацетилену.

Глава 32
57
реакцию также применяют для получения производных пиразола.
Взаимодействие гидразина, алкилили арилгидразинов с 1,3-дикарбонильными соединениями. Этот способ используют для получения гомологов пиразола. так, при взаимодействии гидразина с ацетилацетоном образуется 3,5-диметилпира- зол:
ФИЗИЧеСКИе СВОЙСТВа
Пиразол — бесцветное кристаллическое вещество со слабым запахом пиридина (т. пл. 70 °с, т. кип. 187 °с), хорошо растворяется в воде, этаноле, эфире.
в неполярных растворителях существует в форме димеров и тримеров за счет образования межмолекулярных водородных связей.
хИмИЧеСКИе СВОЙСТВа
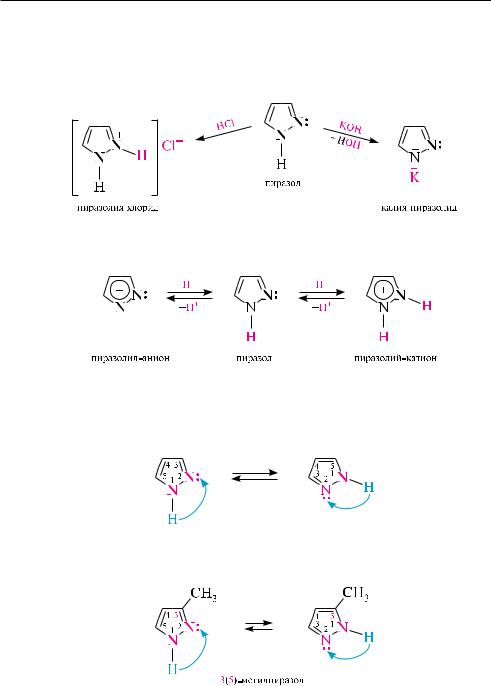
Кислотность и основность. кислотно-основные свойства пиразола обусловлены наличием в его структуре атомов азота пиррольного и пиридинового типов.
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
577
за счет атома азота пиридинового типа пиразол проявляет основные свойства (рквн+ = 2,53), за счет атома азота пиррольного типа — слабые кислотные свойства (рка 14). следовательно, пиразол является амфотерным соединением
и способен вступать в реакции как с минеральными кислотами, так и со щелочами, образуя при этом соли:
соли пиразола — довольно устойчивые соединения. их стабильность обусловлена делокализацией положительного заряда в катионе пиразолия, либо отрицательного заряда в пиразолид-анионе между всеми атомами цикла.
наличие в молекуле пиразола подвижного атома водорода NH-группы и основного центра — атома азота пиридинового типа является причиной прояв-
ления прототропной, или так называемой азольной, таутомерии. Прототропная таутомерия пиразола и его гомологов обусловлена миграцией протона от NH-группы
катому азота пиридинового типа.
врезультате таутомерных превращений положения 3 и 5 в молекуле пиразола равноценны. так, 3-метилпиразол и 5-метилпиразол являются таутомерными формами одного и того же соединения:
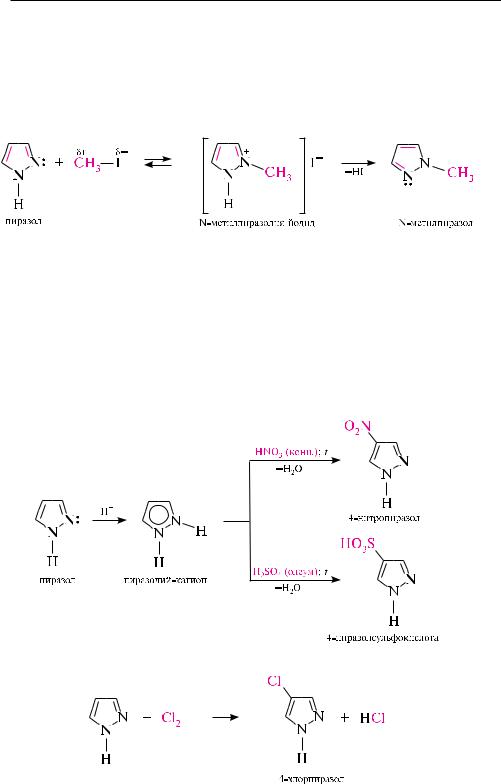
При этом миграция протона н+ происходит настолько быстро, что выделить индивидуальные таутомеры не представляется возможным. Поэтому в названиях таких соединений наряду с цифрой, указывающей положение заместителя, в скобках приводится цифра, обозначающая возможность отсчета от другого, химически идентичного атома азота. так, приведенное выше соединение называют 3(5)-метилпиразол.
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
57
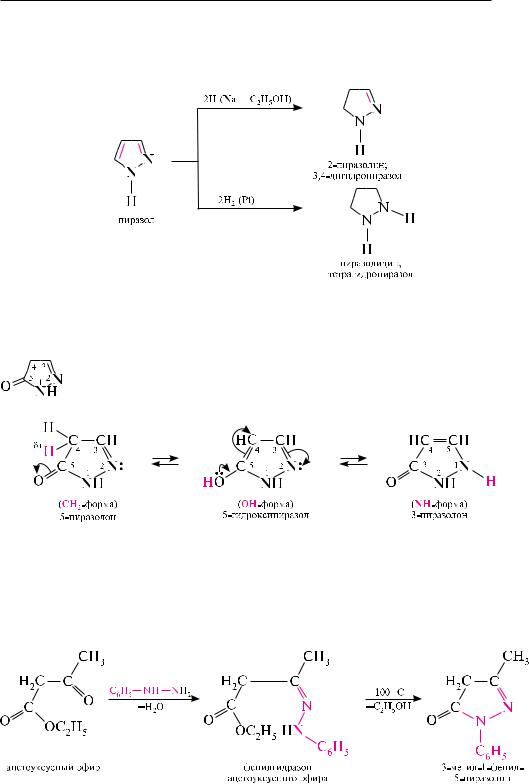
реакции восстановления. При восстановлении пиразола водородом в момент выделения (C2H5OH + Na) образуется частично гидрированный продукт — 2-пиразолин. Гидрирование в присутствии катализатора приводит к образованию полностью восстановленного производного — пиразолидина.
Пиразолин и пиразолидин являются гораздо более сильными основаниями, чем пиразол. они обладают свойствами вторичных алифатических аминов.
ВажнеЙШИе ПрОИЗВОДнЫе ПИраЗОла
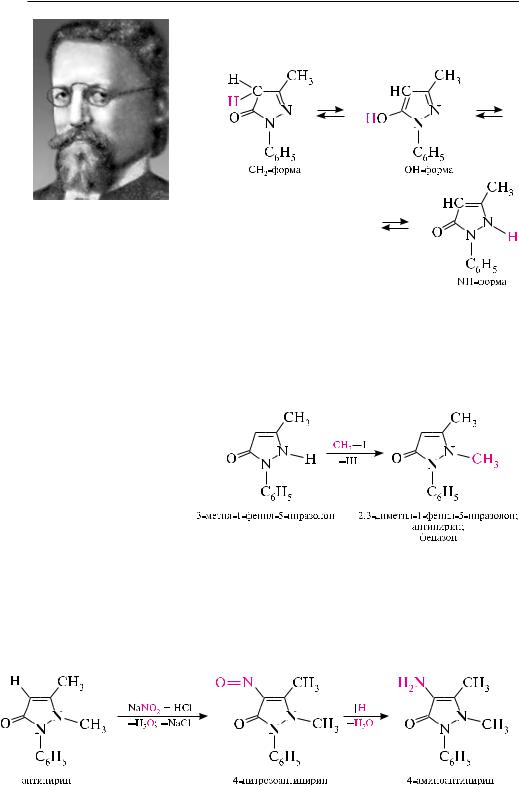
5-Пиразолон (2-пиразолин-5-он). бесцветное кристаллическое вещество (т. пл. 165 °с), хорошо растворимое в воде, этиловом спирте, плохо растворяется в эфире, толуоле. 5-Пиразолон является таутомерным соединением и может существовать в CH2-, OH- и NH-форме:
в указанном равновесии существенно преобладает CH2-форма, поэтому в названии соединения отдают предпочтение 5-пиразолону.
ядро 5-пиразолона входит в структуру ряда лекарственных препаратов (антипирина, амидопирина, анальгина). в качестве исходного вещества для получения лекарственных препаратов пиразолонового ряда используют 3-метил-1-фенил-5- пиразолон. впервые соединение было синтезировано в 1883 году немецким хими- ком-органиком людвигом кнорром из ацетоуксусного эфира и фенилгидразина: