
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf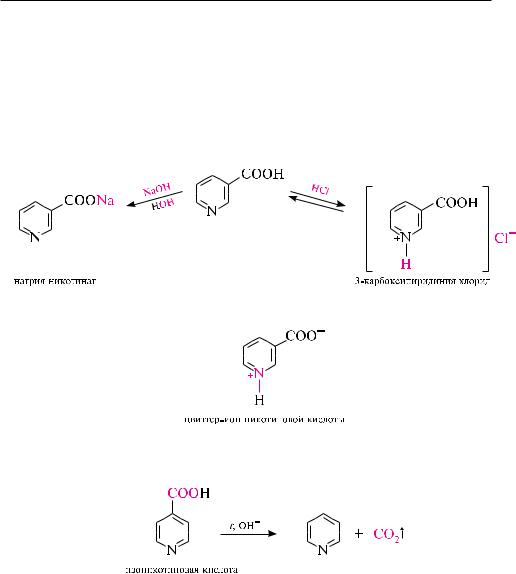
ПЯТИ- И ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
601
Пиридинкарбоновые кислоты представляют собой бесцветные кристаллические вещества (т. пл. пиколиновой кислоты — 136—137 С, никотиновой —
236—237 С, изоникотиновой — 323—325 С).
Пиридинкарбоновые кислоты являются бифункциональными соединениями. По карбоксильной группе они образуют соли, галогенангидриды, сложные эфиры, амиды, гидразиды и другие функциональные производные. По пиридиновому кольцу протекают реакции, свойственные пиридину. Вследствие наличия в структуре молекул кислотного и основного центров, пиридинкарбоновые кислоты являются амфотерными соединениями.
В кристаллическом состоянии и частично в растворах они существуют в виде внутренней соли (цвиттер-ионов).
При нагревании пиридинкарбоновые кислоты декарбоксилируются. -Кисло- ты отщепляют углерода (IV) оксид довольно легко, - и -кислоты декарбоксилируются при нагревании со щелочью.
В результате электроноакцепторного влияния гетероатома пиридинкарбоновые кислоты являются более сильными кислотами, чем бензойная кислота:
Кислота: |
Пиколиновая |
Никотиновая |
Изоникотиновая |
Бензойная |
|
|
|
|
|
рКа в воде: |
1,50 |
2,07 |
1,80 |
4,17 |
В молекулах пиколиновой и изоникотиновой кислот карбоксильная группа находится в сопряжении с гетероатомом, поэтому эти кислоты проявляют более сильные кислотные свойства, чем никотиновая кислота.
Пиридинкарбоновые кислоты находят широкое применение в синтезе лекарственных средств. Так, никотиновая кислота и ее амид (никотинамид) известны в медицинской практике как две формы витамина РР (кислота является провитамином, а амид — витамином РР). При недостатке витамина РР в организме

Глава 32
02
развивается заболевание кожи — пеллагра. суточная потребность человека в никотиновой кислоте составляет 20—30 мг и удовлетворяется в основном за счет пищевых продуктов — молока, рыбы, овощей, фруктов, гречневой крупы и др.
N,N-диэтиламид никотиновой кислоты в виде 25%-ного водного раствора под названием «кордиамин» применяют в качестве средства, стимулирующего центральную нервную систему, возбуждающего дыхательный и сосудодвигательный центры головного мозга.
амид никотиновой кислоты и N,N-диэтиламид никотиновой кислоты синтезируют из никотиновой кислоты:
на основе производных изоникотиновой кислоты созданы лекарственные препараты (изониазид, фтивазид), которые применяют при лечении туберкулеза.
схема синтеза изониазида и фтивазида:

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
03
Пиперидин (гексагидропиридин) — бесцветная жидкость с резким аммиачным запахом (т. кип. 106 с), смешивается с водой и большинством
органических растворителей.
Пиперидин проявляет химические свойства вторичных аминов — обра-  зует соли с кислотами, с азотистой кислотой дает N-нитрозопроизводное, вступает в реакции алкилирования и ацилирования по атому азота и др. как вторичный амин пиперидин является значительно более сильным основанием, чем
зует соли с кислотами, с азотистой кислотой дает N-нитрозопроизводное, вступает в реакции алкилирования и ацилирования по атому азота и др. как вторичный амин пиперидин является значительно более сильным основанием, чем
пиридин (рKвн+ пиперидина в воде составляет 11,22; рKвн+ пиридина — 5,25). Пиперидиновый цикл является структурным фрагментом алкалоидов лобели-
на, анабазина (см. с. 640), входит в состав ряда лекарственных препаратов.
32. .2. хИнОлИн
Хинолин (бензо[b]пиридин) представляет собой конденсированную гетероциклическую систему, состоящую из пиридинового и бензольного колец. нумерацию атомов в молекуле хинолина начинают с гетероатома, атомы углерода в пиридиновом цикле обозначают буквами , и .
СПОСОБЫ ПОлУЧенИя
хинолин впервые выделен немецким химиком-органиком фридлибом фердинандом рунге в 1834 году из продуктов перегонки каменноугольной смолы. каменноугольную смолу и в настоящее время используют для получения хинолина и некоторых его метилпроизводных.
наиболее важными способами синтеза хинолина и его производных являются синтез скраупа и синтез дёбнера—Миллера.
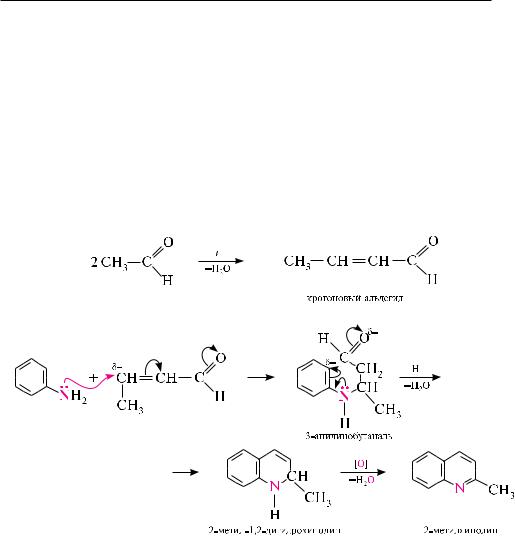
Синтез Скраупа. реакция основана на взаимодействии анилина и его замещенных в ядре производных, имеющих свободное орто-положение, с глицерином, концентрированной серной кислотой и окислителем при нагревании. в качестве окислителя чаще используют нитросоединение, соответствующее исходному амину. для получения хинолина по методу скраупа нагревают анилин с глицерином и концентрированной серной кислотой в присутствии окислителя — нитробензола:

Глава 32
04
Механизм реакции включает три последовательные стадии. на первой стадии глицерин под действием концентрированной серной кислоты подвергается внутримолекулярной дегидратации с образованием акролеина.
Зденко ханс СКраУП
(1850—1 10) |
|
||
австрийский |
химик-органик. |
|
|
основные научные |
работы связаны |
|
|
с выяснением строения и проведени- |
на второй стадии образующийся акроле- |
||
ем синтеза алкалоидов группы хини- |
|||
ин вступает в реакцию с анилином: |
|||
на. открыл (1880) |
синтез хинолина |
||
и его производных (реакция скраупа). установил (1883) строение алкалоида цинхонина. исследовал углеводы и белки.
вначале происходит нуклеофильное присоединение молекулы анилина по месту разрыва активированной двойной углерод-углеродной связи молекулы акролеина. затем образующийся 3-анилинопропаналь в кислой среде подвергается циклизации, превращаясь при этом в 1,2-дигидрохинолин. замыкание цикла обусловлено электрофильной атакой карбонильной группой орто-положения бензольного кольца.
на третьей стадии реакции 1,2-дигидрохинолин окисляется нитробензолом
вхинолин.
впроцессе окисления нитробензол количественно восстанавливается до анилина, который снова вступает в реакцию по описанному механизму.
При использовании в синтезе скраупа замещенных анилина со свободным орто-положением образуются производные хинолина с заместителями в бен-
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
05
зольном ядре. реакция открыта в 1880 году австрийским химиком-органиком зденко хансом скраупом.
Синтез Дёбнера — миллера. данный способ является модификацией синтеза скраупа и используется для получения производных хинолина с алкильными заместителями в пиридиновом цикле.
синтез дёбнера — Миллера заключается в нагревании первичного ароматического амина с альдегидом (способным к кротоновой конденсации) в присутствии цинка хлорида, хлороводородной или других кислот. Механизм реакции подобен механизму реакции скраупа. на первой стадии протекает кротоновая конденсация двух молекул альдегида с образованием , -ненасыщенного альдегида, который, как и в синтезе скраупа, взаимодействует далее с ароматическим амином. роль окислителя выполняют образующиеся в процессе реакции азоме-
тины C6H5—N=CH—R.
реакция открыта в 1881 году о. дёбнером и в. Миллером.
ФИЗИЧеСКИе СВОЙСТВа
хинолин — бесцветная жидкость с весьма неприятным запахом (т. кип. 237 с), хорошо смешивается с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, перегоняется с водяным паром.
хИмИЧеСКИе СВОЙСТВа
Хинолин является гетероароматическим соединением. Молекула имеет плос-
кое строение и содержит замкнутую сопряженную -электронную систему из 10-электронов, что соответствует правилу хюккеля.
По химическим свойствам хинолин напоминает пиридин. для него характерны реакции с участием гетероатома, реакции электрофильного и нуклеофильного замещения атомов водорода хинолинового ядра, а также реакции окисления и восстановления.

Глава 32
0
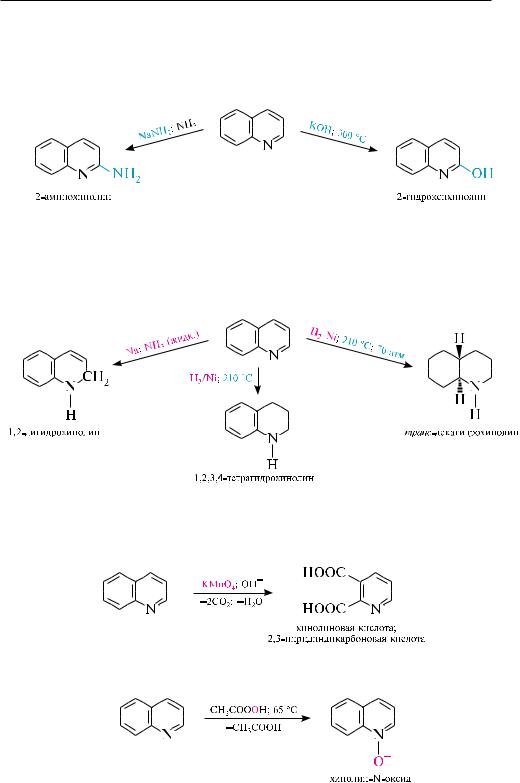
реакции с участием гетероатома. наличие в молекуле хинолина атома азота пиридинового типа сообщает соединению основные свойства. как основание хинолин немного слабее пиридина (рKвн+ хинолина — 4,94; рKвн+ пиридина в H2O — 5,25).
с участием гетероатома хинолин, аналогично пиридину, образует соли с сильными кислотами, алкил- и ацилгалогенидами:
реакции электрофильного и нуклеофильного замещения (SE, SN). Электрон-
ная плотность в молекуле хинолина в сравнении с бензоаналогом нафталином понижена и неравномерно распределена из-за электроноакцепторного влияния гетероатома: в пиридиновом кольце она ниже, чем в бензольном. Поэтому при действии электрофильными реагентами замещение, как правило, идет по бензольному кольцу, а нуклеофильными — по пиридиновому.
Реакции электрофильного замещения в молекуле хинолина протекают преимущественно в положениях 5 и 8. так, при нитровании нитрующей смесью образуется смесь 5- и 8-нитрохинолинов, сульфирование концентрированной серной кислотой при 220 с приводит к образованию 8-хинолинсульфокислоты, а при 300 с — термодинамически более предпочтительной 6-хинолинсульфокислоты (в этих условиях 5- и 8-изомеры перегруппировываются в 6-изомер).

Глава 32
08
ВажнеЙШИе ПрОИЗВОДнЫе хИнОлИна
хинолиновое ядро является структурным фрагментом некоторых алкалоидов (см. с. 641) и лекарственных средств.
8-Гидроксихинолин. бесцветное кристаллическое вещество (т. пл. 75—76 с), малорастворимое в воде, растворимое в хлороформе, диэтиловом эфире и бензоле.
8-Гидроксихинолин получают нагреванием о-аминофенола с глицерином и серной кислотой в присутствии о-нитрофенола (синтез скраупа) или сплавлением 8-хинолинсульфокислоты со щелочами:
с ионами металлов (Mg2+, Al3+, Zn2+, Mn2+, Co2+, Ni2+, Cu2+, Fe2+, Fe3+ и др.) 8-гидроксихинолин образует малорастворимые в воде комплексы (хелаты).
на этом свойстве основано использование 8-гидроксихинолина в качестве аналитического реагента.
ряд производных 8-гидроксихинолина применяют в медицинской практике в качестве противомикробных средств (хинозол, нитроксолин (5-нок) и др.).
Предполагают, что их бактерицидное действие основано на связывании ионов Co2+, необходимых для жизнедеятельности микроорганизмов.
32. .3. ИЗОхИнОлИн
изохинолин (бензо[c]пиридин) является изомером хинолина. Мо- 
 лекула изохинолина, как и хинолина, состоит из конденсированных
лекула изохинолина, как и хинолина, состоит из конденсированных 



 пиридинового и бензольного циклов, но, в отличие от хинолина, циклы соединены по связи с-3—C-4 пиридинового кольца. нумерацию атомов изохинолинового ядра проводят в соответствии с правилами IUPAC
пиридинового и бензольного циклов, но, в отличие от хинолина, циклы соединены по связи с-3—C-4 пиридинового кольца. нумерацию атомов изохинолинового ядра проводят в соответствии с правилами IUPAC
указанным способом.

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
0
СПОСОБЫ ПОлУЧенИя
изохинолин содержится в хинолиновой фракции каменноугольной смолы (около 1 %), из которой его извлекают в виде соли (гидросульфата). одним из распространенных способов синтеза изохинолина и его производных является синтез Би- шлера-напиральского (1893 г.), основанный на циклизации N-ацильных производных -фенилэтиламинов в 3,4-дигидроизохинолины и дальнейшем превращении последних в изохинолины путем каталитического дегидрирования. циклизацию N-ацильных производных осуществляют в присутствии P2O5 или POCl3 в ксилоле.
ФИЗИЧеСКИе СВОЙСТВа
изохинолин — бесцветное кристаллическое вещество (т. пл. 24,6 с), растворимое в воде, этаноле, диэтиловом эфире, хлороформе и бензоле.
хИмИЧеСКИе СВОЙСТВа
По химическим свойствам изохинолин мало отличается от хинолина.
за счет гетероатома изохинолин проявляет основные и нуклеофильные свойства и легко образует соли с кислотами, алкил- и ацилгалогенидами. как основание изохинолин немного сильнее хинолина (рKвн+ изохинолина в н2о — 5,14; рKвн+ хинолина — 4,94).
реакции электрофильного замещения в изохинолиновом цикле подобны хинолиновому и протекают главным образом в положениях 5 и 8.

Глава 32
10
нуклеофильное замещение в молекуле изохинолина протекает преимущественно в положении 1.
При восстановлении изохинолина, как и в молекуле хинолина, в первую очередь гидрируется пиридиновое ядро. так, при действии натрием в этаноле или водородом над никелевым катализатором изохинолин восстанавливается до 1,2,3,4-тетрагидроизохинолина :
в более жестких условиях гидрированию подвергается и бензольное кольцо. При окислении изохинолина щелочным раствором KMnO4 образуется смесь
фталевой и 3,4-пиридиндикарбоновой кислот.
Под действием органических пероксикислот изохинолин окисляется по гетероатому, образуя N-оксид.
ядро изохинолина является структурным фрагментом молекул алкалоидов изохинолинового ряда — папаверина, морфина, кодеина и др. (см. с. 641—643).
32. .4. аКрИДИн
Акридин (дибензо[b,e]пиридин) представляет собой конденсированную систему, состоящую из двух бензольных и одного пиридинового колец. атомы акридинового ядра нумеруют как
