
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf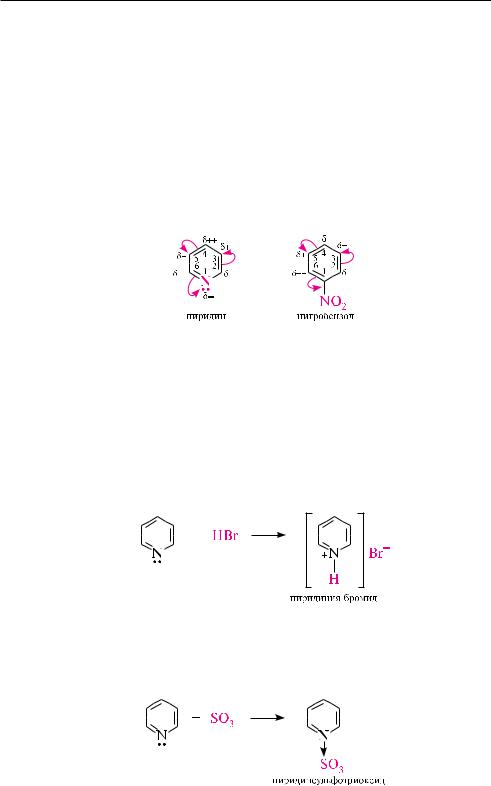
ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5 1
СТрОенИе И хИмИЧеСКИе СВОЙСТВа
Пиридин является гетероароматическим соединением, содержащим цикличе-
скую шести- -электронную сопряженную систему (см. с. 550). неподеленная пара электронов атома азота не участвует в образовании ароматического секстета и обусловливает основные свойства пиридина. в отличие от бензола, в молекуле пиридина электронная плотность распределена неравномерно, что подтверждает сравнительно большой дипольный момент (2,26 D). вследствие электроноакцепторного влияния атома азота в пиридиновом цикле на всех углеродных атомах электронная плотность понижена, причем в большей степени — в положениях 2, 4 и 6 ( - и -положения), в меньшей — в положениях 3 и 5 ( -положения).
Пиридин является -дефицитной гетероароматической системой.
влияние атома азота на электронную плотность пиридинового ядра сравнимо с влиянием нитрогруппы на бензольное кольцо в молекуле нитробензола:
характерные для пиридина реакции можно условно разделить на три группы:
реакции, протекающие с участием гетероатома;
реакции замещения атомов водорода пиридинового цикла;
реакции восстановления и окисления.
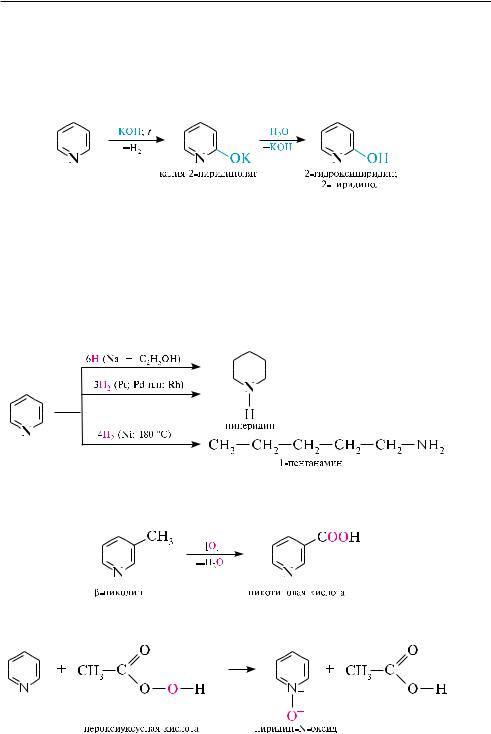
реакции, протекающие с участием гетероатома. Взаимодействие с кислотами.
Пиридин является слабым основанием. основность пиридина (рKвн+ = 5,25) близка к основности анилина (рKвн+ = 4,6). водные растворы пиридина окрашивают красную лакмусовую бумагу в синий цвет. При взаимодействии с сильными минеральными и органическими кислотами (хлороводородная, бромоводородная, серная, пикриновая и др.) пиридин образует хорошо кристаллизующиеся пиридиниевые соли:
образование соли с пикриновой кислотой используют для идентификации пиридина.
Взаимодействие с серы (VI) оксидом. с участием неподеленной пары электронов атома азота пиридин сравнительно легко реагирует с серы (VI) оксидом, образуя донорно-акцепторный комплекс — пиридинсульфотриоксид:

Глава 32
5 2
Пиридинсульфотриоксид используется в органическом синтезе как мягкий сульфирующий реагент при сульфировании ацидофобных гетероциклов (см. c. 557).
Взаимодействие с алкил- и ацилгалогенидами. При взаимодействии с алкил-
и ацилгалогенидами пиридин образует четвертичные соли N-алкил- и N-ацил- пиридиния соответственно. в этих реакциях атом азота молекулы пиридина проявляет нуклеофильные свойства, предоставляя пару электронов для образования связи с электрофильным атомом углерода молекулы галогеналкана или галогенангидрида карбоновой кислоты.
соли N-ацилпиридиния характеризуются высокой реакционной способностью ацильного фрагмента по отношению к нуклеофилам и поэтому являются эффективными ацилирующими реагентами.
реакции замещения атомов водорода пиридинового цикла. для пиридина харак-
терны реакции электрофильного и нуклеофильного замещения (SE, SN).
Реакции электрофильного замещения в пиридиновом цикле протекают лишь в жестких условиях. так, нитрование осуществляется с низким выходом при нагревании пиридина с калия нитратом
в дымящей серной кислоте при 300 с, сульфирование — при
нагревании с олеумом (220—270 с) в присутствии катализа-
тора — ртути (ІІ) сульфата, бромирование — возможно при действии брома в олеуме. Электрофильный реагент направляется в -положение цикла:
реакции алкилирования и ацилирования по фриделю—крафтсу для пириди-
на не характерны. низкая реакционная способность пиридинового цикла в реакциях электрофильного замещения и ориентация замещения в -положение обусловлена электроноакцепторными свойствами гетероатома (–I, –M-эффекты), который,
снижая электронную плотность на всех атомах углерода цикла, в меньшей степени оказывает влияние на -положение, что и предопределяет место атаки электрофильным реагентом. кроме того, в реакциях с протонными реагентами

Глава 32
5 4
реакция протекает по механизму SN2. на первой стадии нуклеофильная частица (NH2–) атакует пиридиновое кольцо с образованием s-комплекса. на второй стадии s-комплекс стабилизируется путем отщепления гидрид-иона H–.
аналогично аминированию протекает гидроксилирование пиридинового цикла. При пропускании паров пиридина над сухим калия гидроксидом при 300— 320 с образуется 2-гидроксипиридин.
реакции восстановления и окисления. Восстановление. Пиридиновый цикл по сравнению с бензольным восстанавливается легче. В зависимости от природы восстановителя и условий гидрирования образуются разные продукты. При вос-
становлении пиридина водородом в момент выделения (металлический натрий в этаноле) или водородом над платиновым, палладиевым или родиевым катализатором образуется пиперидин. в достаточно жестких условиях, например, при высокотемпературном каталитическом гидрировании, происходит восстановительное расщепление пиридинового кольца по связи C—N с образованием 1-пентанамина.
Окисление. Пиридиновое кольцо устойчиво к действию окислителей. алкилпири-
дины, подобно алкилбензолам, окисляются достаточно легко, образуя соответствующие пиридинкарбоновые кислоты.
Под действием пероксикислот пиридиновый цикл окисляется по атому азота с образованием N-оксидов (N-окисление):
Пиридин-N-оксид и его производные довольно легко восстанавливаются до исходных пиридинов. в качестве восстанавливающих агентов чаще используют фосфора (III) галогениды.

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5 5
Пиридин-N-оксид, в отличие от пиридина, более активен в реакциях электрофильного замещения. Это обусловлено некоторым электронодонорным эффектом атома кислорода. на атомах углерода в - и -положениях молекулы пири- дин-N-оксида в результате смещения электронной плотности от атома кислорода в кольцо электронная плотность повышена в сравнении с пиридином.
так, пиридин-N-оксид вступает в реакцию нитрования гораздо легче, чем пиридин. При нитровании азотной кислотой или калия нитратом в серной кислоте с высоким выходом образуется 4-нитропиридин-N-оксид.
Поскольку замещенный N-оксид может быть восстановлен в соответствующий пиридин, эту реакцию используют для получения -замещенных пиридина.

Глава 32
5
алкилирование и ацилирование N-оксидов протекает по атому кислорода с образованием солей N-алкокси- и N-ацилоксипиридиния соответственно.
реакции N-оксидов с нуклеофильными реагентами протекают аналогично пиридину, то есть преимущественно в положение 2.
ВажнеЙШИе ПрОИЗВОДнЫе ПИрИДИна
Пиколины. Пиколинами называют монометильные производные пиридина. раз-
личают -пиколин (2-метилпиридин), -пиколин (3-метилпиридин) и -пиколин (4-метилпиридин).
Пиколины являются бесцветными жидкостями с неприятным пиридиноподобным запахом, хорошо растворимы в воде и органических растворителях. температура кипения -пиколина — 129,5 с, -пиколина — 144 C, -пиколи-
на — 145,4 с.
химические свойства пиколинов и пиридина сходны. как и пиридин, метилпиридины образуют соли с сильными кислотами и алкилгалогенидами, окисляются пероксикислотами до N-оксидов, восстанавливаются водородом в присутствии Pt или Pd с образованием производных пиперидина. Под действием окислителей — KMnO4, HNO3 или кислорода воздуха в присутствии V2O5 -, - и -пико- лины окисляются соответственно до пиридинкарбоновых кислот — пиколиновой, никотиновой и изоникотиновой кислот (см. с. 594).
В результате электроноакцепторного влияния гетероатома в молекулах- и -пиколинов атомы водорода метильных групп обладают повышенной подвиж-
ностью, так как образующиеся в процессе депротонирования анионы стабили-

ПяТИ- И ШеСТИЧленнЫе ГеТерОЦИКлИЧеСКИе СОеДИненИя
5 7
зируются путем делокализации отрицательного заряда по сопряженной системе, включающей гетероатом:
Поэтому - и -пиколины, в отличие от -пиколина, вступают в реакцию конденсации с альдегидами и кетонами, при действии натрия амида NaNH2 или фениллития C6H5Li образуют металлорганические соединения, взаимодействием которых с алкилгалогенидами получают гомологи пиридина.
Пиколины используют в органическом синтезе. -Пиколины применяют в производстве пестицидов, - и -пиколины — для получения никотиновой и изоникотиновой кислот соответственно (см. с. 600).
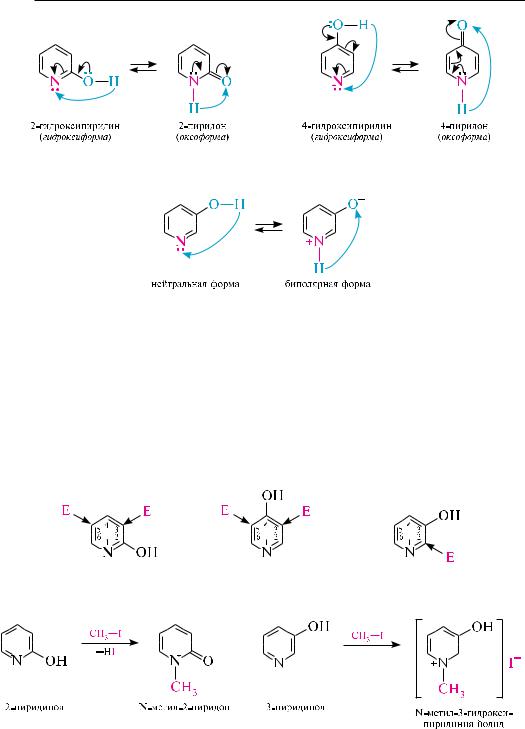
Гидроксипиридины (оксипиридины, пиридинолы). в зависимости от положения гидроксигруппы в пиридиновом цикле различают -гидроксипиридин (2-гидроксипиридин, 2-пиридинол), -гидроксипиридин (3-гидроксипиридин, 3-пиридинол), -гидроксипиридин (4-гидроксипиридин, 4-пиридинол).
Гидроксипиридины — бесцветные кристаллические вещества (т. пл. 2-гид- роксипиридина — 107 с, 3-гидроксипиридина — 130 с, 4-гидроксипириди- на — 151 с), легко растворимые в этаноле, ацетоне, умеренно — в воде, ограниченно — в диэтиловом эфире и бензоле.
- и -Гидроксипиридины являются таутомерными соединениями. они сущест-
вуют в двух таутомерных формах — гидрокси- и оксоформе. в водном растворе эти соединения находятся преимущественно в оксо-, или так называемой пиридоновой, форме, в неполярных растворителях и в газовой фазе преобладает гидроксиформа.

Глава 32
00
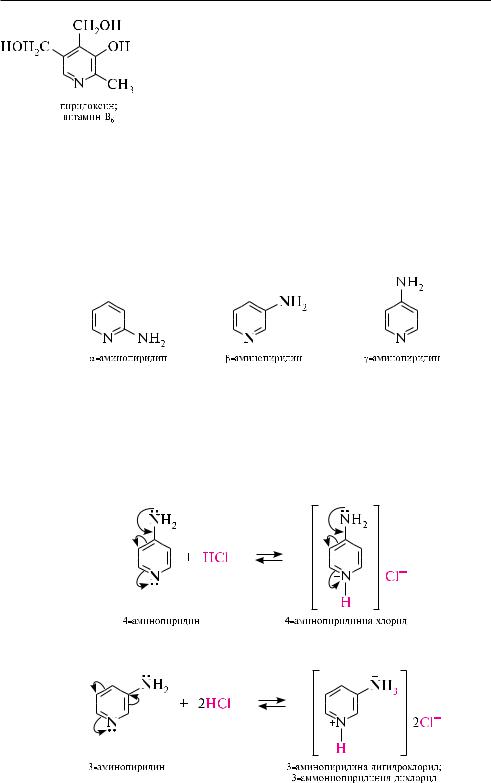
- и -аминопиридины являются таутомерными веществами. они существуют в двух таутомерных формах — аминной и иминной. более устойчивой является аминоформа.
реакционная способность аминопиридинов зависит от положения аминогруппы в пиридиновом кольце. 3-аминопиридин обладает свойствами, характерными для ароматических аминов. с участием аминогруппы он вступает в реакции алкилирования, ацилирования, диазотирования. 2- и 4-Aминопиридины в обычных условиях солей диазония не образуют, с галогеналканами реагируют по атому азота пиридинового кольца.
для аминопиридинов характерны реакции электрофильного замещения по пиридиновому кольцу (сульфирование, галогенирование, нитрование). -амино- пиридин в реакциях Sе образует продукты замещения преимущественно в положении 5, -аминопиридин — в положении 2, -аминопиридин — в положении 3.
таким образом, электрофильное замещение протекает в орто- или пара-поло- жении по отношению к аминогруппе.
аминопиридины применяются в синтезе лекарственных средств. Пиридинкарбоновые кислоты. в зависимости от положения карбоксильной
группы в пиридиновом цикле различают -, - и -пиридинкарбоновые кислоты.-Пиридинкарбоновую кислоту (2-пиридинкарбоновую кислоту) чаще называют пиколиновой кислотой, -пиридинкарбоновую (3-пиридинкарбоновую) — никотиновой, -пиридинкарбоновую (4-пиридинкарбоновую) — изоникотиновой.
