
- •ОГЛАВЛЕНИЕ
- •Введение
- •Используемые единицы измерений и основные константы
- •1.1. Предпосылки возникновения волновой механики
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •1.2. Волновая (квантовая) механика
- •1.3. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •2.1. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (ВС)
- •2.2.3. Геометрия простейших молекул. Гибридизация АО
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.3. Полярность связи. Дипольный момент молекулы
- •3.1. Агрегатные состояния
- •3.3.1.Основные понятия о строении кристаллов
- •Библиографический список

Пример. Ион [PtCl6]-2 представляет собой плоский квадрат, в центре которого находится ион Pt+4, в вершинах квадрата четыре иона Cl-, над и под плоскостью квадрата располагаются еще два иона Cl- (октаэдр, в вершинах которого располагаются ионы хлора, а в центре ион платины). Расстояние между ионом платины и всеми ионами хлора одинаково. Валентные углы равны 90о (рис. 2.15).
z
y
x
Рис. 2.15. Схема ориентации в пространствешести d 2sp3-гибридных орбиталей
2.2.4. Донорно-акцепторный механизм образования ковалентной связи
Единичная ковалентная связь между атомами может возникнуть не только в результате образования пары электронов из двух неспаренных электронов, принадлежащих обоим атомам. Образование обобществленной пары электронов может происходить и в том случае, когда оба атома не имеют неспаренных электронов, но один из них имеет неподеленную пару электронов (донор), а другой свободную орбиталь (акцептор). Первый атом предоставляет для образования связи свою неподеленную пару, он называется донором, а второй предоставляет свободную орбиталь, принимая (акцептируя) на нее эту неподеленную пару, он называется акцептором. Причем образующаяся связь не будет ничем отличаться от других ковалентных связей. Часто говорят об образовании донорно-акцепторной (координационной) химической связи, но при этом надо помнить, что она не является особым типом химической связи, а название указывает только на механизм образования.
Пример. Молекула оксида углерода (CO). По методу ВС атом кислорода может образовывать двойную связь, поскольку имеет только два неспаренных электрона. Эксперимент показывает, что энергия связи в молекуле CO существенно больше и по величине соответствует тройной связи. Образование третьей связи может происходить по донорно-акцепторному механизму. Перекрывание px-орбиталей атомов углерода и кислорода приводит к образованию σ-связи. Неспаренные py электроны углерода и кислорода образуют π-связь. Свободная pz-орбиталь углерода и неподеленная пара электронов кислорода на pz-орбитали образуют вторую
π-связь (рис. 2.16).
65

C |
2s2 |
2px1 |
2py1 |
2pz0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
2s2 |
2px1 |
2py1 |
2pz2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ−связь π−связь π−связь
Рис. 2.16. Схема образования ковалентной связи в молекулеСО
Донорно-акцепторный механизм объясняет образование ковалентной химической связи между молекулами и ионами, которые в обычном смысле не имеют валентных электронов и не могут образовывать химическую связь, например, в комплексных соединениях. Комплексные соединения (координационные соединения) – химические соединения, в молекулах которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды). Центральный атом и лиганды образуют внутреннюю сферу, внешнюю сферу составляют, как правило, ионы, компенсирующие заряд внутренней сферы. Например, [H3O]Cl, [NH4]OH, K[BF4], [Cu(NH3)4]Cl и т.д. Цен-
тральный атом связан с лигандами ковалентной связью, образованной по донорно-акцепторному механизму. Причем центральный атом может быть как донором, так и акцептором.
Комплексный ион пишется в квадратных скобках, участвует в обменных химических реакциях как единая частица. Заряд комплексного иона определяется алгебраической суммой зарядов центрального атома и лигандов. Число лигандов – координационное число центрального атома.
Пример. Ион [NH4]+ NH3 + H+ → [NH4]+
Атом азота в молекуле аммиака имеет четыре sp3-гибридные орбитали, три из которых идут на образование связей с тремя атомами водорода, а четвертая занята парой электронов. Ион водорода имеет свободную 1s- орбиталь, на которой и размещается неподеленная пара электронов азота. В результате образуется ион [NH4]+, который имеет тетраэдрическую конфигурацию и четыре равноценных атома водорода (рис. 2.17).
66

N |
|
2s2 |
2px1 |
|
2py1 |
|
2pz1 |
|||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s1 |
|
|
|
|
|
|
|
|
|
|
|
|
1s1 |
|
|
1s1 |
|
|
H+ |
|
1s0 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ-связь |
σ-связь |
σ-связь |
σ-связь |
Рис. 2.17. Схема образования ковалентной связи в ионеаммония |
|||
Ион [BF4]− |
BF3 +F− → [BF4] − |
|
|
Атом бора в молекуле фторида бора имеет три электрона занимающих sp2-гибридные орбитали, которые использует для образования ковалентной связи с атомами фтора, и одну 2pz-свободную орбиталь. Ион фтора имеет неподеленные пары электронов, одна из которых может расположиться на свободной орбитали бора. Это позволяет изменить гибридизацию атомных орбиталей бора на sp3. Образовавшийся ион имеет
тетраэдрическую |
конфигурацию и |
четыре равноценных иона фтора |
|||||||
(рис. 2.18). |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
B* |
|
|
2s1 |
2px1 |
|
2py1 |
2pz0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
2s2 |
2px2 |
|
2py2 |
2pz1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
− |
|
2s2 |
2px2 |
|
2py2 |
2pz1 |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.18. Схема образования ковалентной связи в ионе[BF4] −
67
2.2.5.Метод молекулярных орбиталей (МО)
Параллельно с методом ВС для описания ковалентной химической связи был разработан метод молекулярных орбиталей (МО), существенный вклад в создание которого внес Малликен (Mulliken).
В основу этого метода положены следующие основные принципы:
1.Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. Молекула рассматривается как единая частица. (В методе валентных связей электрон находится в эффективном поле своего ядра, а молекула описывается как система взаимодействующих атомов).
2.Состояние электрона в молекуле описывается волновыми функциями, которым соответствуют молекулярные орбитали, подобно атомным орбиталям. Молекулярные орбитали, в отличие от атомных, многоцентровые, поскольку в молекуле имеется не менее двух ядер. Волновая функция молекулярных орбиталей может быть получена сложением или вычитанием волновых функций атомных орбиталей (линейная комбинация АО).
3.Заполнение электронами молекулярных орбиталей осуществляется на основе тех же принципов, что и при заполнении атомных орбиталей (принцип минимума энергии, принцип Паули, правило Хунда). Совокупность молекулярных орбиталей называется электронной конфигурацией молекулы.
Модельной системой при разработке принципов МО был молекулярный ион водорода H2+, который состоит из двух положительно заряженных ядер и одного электрона. Волновая функция, описывающая состояние электрона в этой системе, может быть представлена как линейная комбинация волновых функций основного состояния атома водорода (1s), то есть результат сложения и вычитания волновых функций атомных орби-
талей: Ψ1 = c1 (ΨA + ΨB ), Ψ2 = с2 (ΨА − ΨВ), ci – нормирующие множители (функции нормируется согласно принципу нормировки).
При образовании молекулы из атомов происходит перекрывание атомных орбиталей. Метод МО следующим образом описывает этот процесс. При сложении атомных волновых функций вероятность нахождения электрона в межъядерной области увеличивается, а при вычитании уменьшается. Волновым функция Ψ1 и Ψ2 соответствуют молекулярные орбитали, схема образования которых показана на рис. 2.19.
Решение уравнения Шредингера с использованием этих волновых функций позволяет определить энергии электрона в молекулярном ионе водорода Е(Ψ1) и Е(Ψ2), которая меньше или больше на величину ∆Е энергии электрона в изолированных атомах водорода.
68

Атомные орбитали |
Молекулярные орбитали |
ΨА(1s) ΨВ(1s)
Ψ2
Ψ1
Атом А Атом В
Рис. 2.19. Схема распределения электронной плотности связывающей иразрыхляющей орбиталей в молекулярном ионеводорода
Молекулярная орбиталь, соответствующая волновой функции Ψ1, получила название связывающей орбитали, а волновой функции Ψ2 – разрыхляющей. Поскольку s-орбитали могут перекрываться только по σ-типу, то их двух 1s атомных орбиталей образуется σ-связывающая (σсв) и σ- разрыхляющая (σр) молекулярные орбитали.
Изменение энергии системы в зависимости от расстояния между ядрами для электрона, находящегося на связывающей и разрыхляющей орбиталях, приведено на рис 2.20. Нахождение электрона на связывающей орбитали приводит к понижению энергии системы, зависимость имеет минимум, соответствующий энергии связи в молекулярном ионе водорода. Нахождение электрона на разрыхляющей молекулярной орбитали приводит к увеличению энергии системы, и молекулярный ион не образуется. Таким образом, условием образования устойчивой системы является превышение числа электронов на связывающих молекулярных орбиталях над числом электронов на разрыхляющих.
а) |
б) |
Энергетическая диаграмма |
|||||
∆Ε(r) |
∆Ε |
АО |
МО |
АО |
|||
∆Ε2(r) – разрыхляющая |
|
||||||
|
|
|
σр |
|
|
|
|
r |
|
1s |
|
|
1s |
||
∆Ε1(r) – связывающая |
|
|
|
|
|
|
|
rcв |
|
|
|
|
|
σсв |
|
Рис. 2.20. Зависимость энергии системы (∆Ε(r)) от межъядерного расстояния (а), энергетическая диаграмма молекулярного иона водорода (б)
69
Для относительной характеристики прочности (энергии) связи вводится понятие кратность связи (формальный порядок связи). Кратность связи К определяется как разность между числом пар электронов на связывающих (nсв/2) и числом пар электронов на разрыхляющих орбита-
лях (nр/2): K = (nсв − nр) / 2 .
Качественное рассмотрение ковалентной связи между двумя атомами сводится к составлению электронной конфигурации молекулы на основе известных схем энергетических диаграмм. При этом выполняются следующие правила:
1.Выбираются атомные орбитали, принимающие участие в образовании химической связи (валентные орбитали). Ими, как правило, являются орбитали электронов внешнего слоя, которые в значительной степени перекрываются и вносят основной вклад в энергию химической связи. АО внутренних слоев слабо перекрываются, их вклад в энергию связи незначителен, поэтому электронная конфигурация молекулы составляется на основе валентных атомных орбиталей. Для s- и p-элементов валентными орбиталями являются ns- и np-электроны (n – главное квантовое число, равное номеру периода).
2.Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу исходных. Как было отмечено, ns-атомные орбитали перекрываются
только по σ-типу, образуя две σ-молекулярные оритали. Поскольку перекрывание np-орбиталей осуществляется как по σ-, так и по π-типу, то образуются две σ- и четыре π-молекулярные орбитали.
3. Хотя точное значение энергий МО необходимо рассчитывать, можно пользоваться известными качественными схемами энергетических диаграмм молекул определенного типа.
Для молекул, состоящих из атомов, имеющих ns-валентные атомные орбитали, схема энергетической диаграммы была приведена на рис. 2.20.
Для молекул, состоящих из атомов, имеющих ns- и np-валентные атомные орбитали, энергетическая диаграмма без учета взаимодействия электронов приведена на рис. 2.21.
Взаимодействие электронов на σ(s) и σ(p) молекулярных орбиталях приводит к изменению относительного положения энергетических уров-
ней МО. На диаграмме σсв(px) и πсв(py), πсв(pz) меняются местами (рис. 2.22). Это взаимодействие учитывается при малом отличии энергии
ns- и np-атомных орбиталей, что имеет место для молекул, образованных из атомов второго периода с Z ≤ 7 (от лития до азота).
4. Распределение валентных электронов по молекулярным орбиталям производится в соответствии с принципом минимума энергии, принципом Паули и правиломХунда, какиприраспределенииэлектроновпоатомным орбиталям.
70
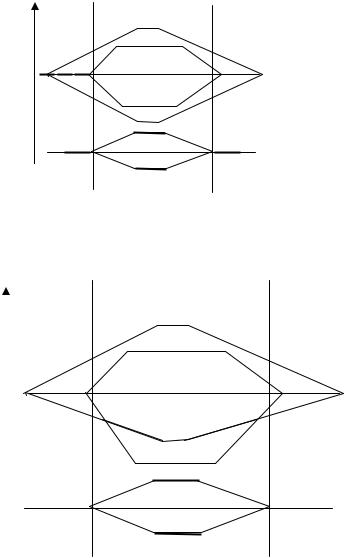
АО
∆E
px py pz
s
|
|
МО |
АО |
||||||||||||||
|
|
σр(px) |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π |
|
|
y) πр |
|
|
|
|
|
|
|
|
|
|||||
р(p |
(pz) |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
pz |
|
|
py px |
||||
πсв(py) πсв(pz) |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
σсв(px) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σр(s) |
|
|
|
|
|
|
|
s
σсв(s)
Рис. 2.21. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО в случае слабого взаимодействия s и p-электронов
|
|
АО |
|
|
|
МО |
|
|
|
|
|
АО |
|||||||||
∆E |
|
|
|
σр(px) |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
y) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
πр(p |
πр(pz) |
|
|
|
|
|
|
|
|
||||
|
px py |
pz |
|
|
|
|
pz py px |
||||||||||||||
|
|
|
|
|
|
|
|
|
σсв(px) |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
πсв(py) |
πсв(pz) |
|
|
|
|
|
|
|
||||
|
|
|
|
|
s |
|
|
|
σр(s) |
|
|
|
s |
||||||||
|
|
|
|
|
|
|
|
|
σсв(px) |
|
|
|
|
|
|
|
|||||
Рис. 2.22. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО с учетом взаимодействия s и p-электронов
71

Пример. 1. Распределение валентных электронов по МО молекул и молекулярных ионов элементов первого периода.
Частица |
|
H2+ |
H20 |
H2- |
He2+ |
He20 |
|||
|
|
|
|
|
|
|
|
|
|
Энергетическая |
σр |
|
|
σр |
|
|
σр |
σр |
σр |
|
|
|
|||||||
диаграмма |
σсв |
σсв |
σсв |
σсв |
σсв |
||||
|
|
σсв1 |
σсв2 |
σсв2σр1 |
σсв2σр1 |
σсв2σр2 |
|||
Электронная |
|
||||||||
конфигурация |
1/2 |
1 |
|
1/2 |
1/2 |
0 |
|||
Кратность свя- |
|
||||||||
зи |
255 |
432 |
17 |
232 |
0 |
||||
Энергия связи, |
|||||||||
кДж/моль |
1.06 |
0.74 |
- |
1.08 |
- |
||||
Длина связи, Å |
|||||||||
|
|
|
|
|
|
|
|
|
|
2. Электронная конфигурация молекул (типа А2; АВ) элементов второго периода.
Молекула |
Электронная конфи- |
Кратность |
Энергия |
Примечание |
|
гурация |
|
кДж/моль |
|
Li2 |
σсв2 |
1 |
107 |
Нет |
Be2 |
σсв2σр2 |
0 |
− |
|
B2 |
σсв2σр2πсв2 |
1 |
288 |
Парамагнетик |
C2 |
σсв2σр2πсв4 |
2 |
629 |
|
N2 |
σсв2σр2πсв4σсв2 |
3 |
942 |
|
O2 |
σсв2σр2σсв2πсв4 πр2 |
2 |
494 |
Парамагнетик |
F2 |
σсв2σр2σсв2πсв4 πр4 |
1 |
155 |
Нет |
Ne2 |
σсв2σр2σсв2πсв4 πр4σр2 |
0 |
− |
|
CO |
σсв2σр2πсв4σсв2 |
3 |
1071 |
Аналог N2 |
NO |
σсв2σр2πсв4σсв2πр1 |
2.5 |
628 |
|
NO+ |
σсв2σр2πсв4σсв2 |
3 |
- |
Аналог N2 |
Несмотря на то, что в основе методов ВС и МО лежат различные представления об образовании химической связи в молекулах (в методе ВС рассматривают молекулу как совокупность отдельных взаимодействующих атомов, а в методе МО – как самостоятельное целое), расчеты обоими методами энергии связи и распределения электронной плотности, естественно, приводят к одинаковым результатам. Метод ВС обладает большей наглядностью при описании химической связи. Метод МО использует сравнительно более простой математический аппарат и поэтому широко используется в квантово-механических расчетах. Кроме того метод МО, в отличие от метода ВС, объясняет магнитные свойства молекул.
72
