
- •ОГЛАВЛЕНИЕ
- •Введение
- •Используемые единицы измерений и основные константы
- •1.1. Предпосылки возникновения волновой механики
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •1.2. Волновая (квантовая) механика
- •1.3. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •2.1. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (ВС)
- •2.2.3. Геометрия простейших молекул. Гибридизация АО
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.3. Полярность связи. Дипольный момент молекулы
- •3.1. Агрегатные состояния
- •3.3.1.Основные понятия о строении кристаллов
- •Библиографический список
Fδ− |
Fδ− |
Fδ− |
|
Hδ+ |
Hδ+ Hδ+ |
Hδ+ Hδ+ |
|
|
Fδ− |
Fδ− |
|
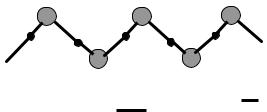
Рис. 3.2. Схема образования зигзагообразной цепи в твердом HF: |
- ковалентная связь, |
||
|
|
- водородная связь |
|
3.3.Химическая связь в твердом теле
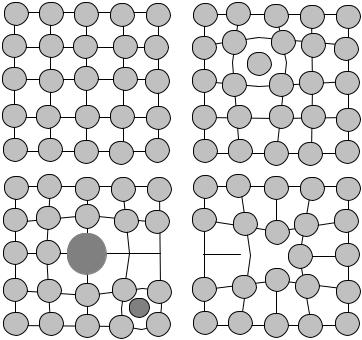
В твердом состоянии вещества образующие его частицы находятся в фиксированных положениях в пространстве, вокруг которых они совершают колебательные и вращательные движения. Различают кристаллические и аморфные твердые тела. Они различаются тем, что в кристаллах существует пространственная периодичность в равновесных положениях частиц, а в аморфных твердых телах частицы колеблются около хаотически расположенных точек.
3.3.1.Основные понятия о строении кристаллов
Кристалл – это тело, которое вследствие строго определенного внутреннего строения имеет самопроизвольно образующуюся форму, ог-
раниченную плоскими гранями. Для кристаллов характерны правильные формы и симметрия. Атомы, образующие кристалл, располагаются строго определенным образом, соответствующим состоянию с минимумом энергии. Закономерности этого расположения определяются типом химических связей, существующих между атомами, и в известном смысле кристалл можно рассматривать как одну “большую молекулу”.
Взависимости от характера химической связи между частицами, образующими кристаллы, они подразделяются на четыре типа: молекулярные,
ковалентные (атомные), ионные, металлические.
Для многих веществ в кристаллическом состоянии минимум энергии системы достигается при таком взаимном расположении частиц в пространстве, которое соответствует плотнейшей упаковке твердых шаров.
Вплоскости твердые шары располагаются плотнейшим образом тогда, когда каждый шар окружают шесть соседей. Второй слой шаров помещается во впадины, образованные тремя соприкасающимися шарами. При укладке третьего слоя появляются два возможных варианта, поскольку имеется два различных типа впадин: впадины, которые находятся над центрами шаров первого слоя, и впадины, которые располагаются над пусто-
81
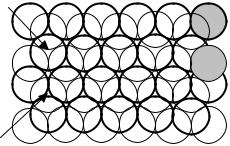
тами первого слоя (рис. 3.3). Поэтому существуют два возможных варианта плотнейшей упаковки:
1)гексагональная (ГПУ). Шары третьего слоя помещаются во впадины, которые находятся над центрами шаров первого слоя. Расположение слоев по вертикали повторяется в последовательности 1,2,1,2,... Повторение позиции шаров в нечетных и четных слоях;
2)кубическая (КПУ). Шары третьего слоя помещаются во впадины, которые располагаются над пустотами первого слоя. Расположение слоев по вертикали повторяется в последовательности 1,2,3,1,2,3,..
ГПУ
1 1
2
КПУ
Рис. 3.3. Первыедва слоя плотнейшей упаковки шаров
При плотнейшей упаковке шаров в кристалле образуются пустоты двух типов: тетраэдрические, заключенные между четырьмя сферами, и октаэдрические – между шестью сферами. Пустоты играют важную роль в процессах диффузии и образования дефектов кристаллов. Если кристалл, например (Na+Cl-), состоит из частиц разного размера, то частицы крупно-
о
го размера ( rCl− =1,81А ) образуют плотнейшую упаковку, а частицы
о
меньшего размера ( rNa + = 0,95А ) располагаются в пустотах.
Прямые линии, мысленно проведенные через центры частиц, создают так называемую кристаллическую решетку. Точки пересечения этих линий называются узлами кристаллической решетки, в которых располагаются образующие ее частицы. Кристаллическую решетку можно охарактеризовать элементарной ячейкой, которая представляет собой минимальный фрагмент решетки, полностью отражающий геометрию решетки и чередование частиц в кристалле (рис. 3.4).
82
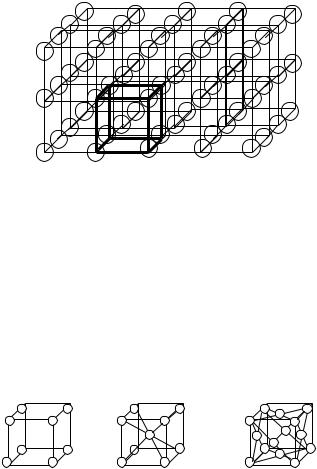
Рис. 3.4. Кристаллическая решетка и ееэлементарная ячейка
Элементарная ячейка является структурной единицей кристалла, ее параллельным переносом можно построить кристаллическую решетку.
Втрехмерном пространстве элементарная ячейка представляет собой варианты параллелепипеда с различным соотношением ребер и углов между ними. Размеры элементарной ячейки называются постоянными решетки.
Взависимости от равенства или неравенства этих углов между собой различают семь классов (сингоний) и 14 типов элементарных ячеек, которым соответствуют кристаллические решетки. Самая несимметричная решет-
ка – триклинная ( a ≠ b ≠ c , α ≠ β ≠ γ ), а самая симметричная – кубическая
( a = b = c , α =β = γ = 90o ), для которой возможны три варианта элемен-
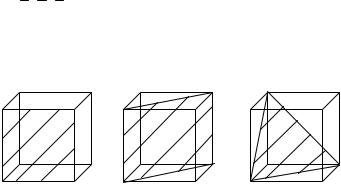
тарной ячейки: простейшая кубическая решетка – ПК, кубическая объемоцентрированная решетка – ОЦК и кубическая гранецентрированная решетка – ГЦК (рис. 3.5).
ПК |
ЦК |
ГЦК |
Рис. 3.5. Типы элементарных ячеек кубических кристаллических решеток
Число ближайших соседних частиц, находящихся на одинаковом расстоянии, от атома или иона, расположенного в узле решетки, называется
координационным числом (КЧ).
В зависимости от внешних условий (давление, температура) одно и то же вещество может существовать в состояниях с различными типами кристаллических решеток. Это явление называется полиморфизмом, а переход вещества из одного кристаллического состояния (полиморфной модифи-
83
кации) в другое – полиморфным переходом.
Вследствие упорядоченного фиксированного положения частиц в кристаллах они обладают анизотропией физических и химических свойств - зависимостью этих свойств от выбранного направления в кристалле. Поэтому важной характеристикой кристаллического тела является его кристаллографическая ориентация, то есть соответствие плоскостей поверхности тела кристаллографическим плоскостям. Плоскости, мысленно проведенные через узлы решетки, называются кристаллографическими. Ряд параллельных кристаллографических плоскостей обозначают индексами Миллера, которые определяют следующим образом. Находят пересечение плоскости с осями координат, соответствующих элементарной ячейке (оси координат направлены вдоль ребер, углы между ними равны α,β,γ). Отрезки, отсекаемые плоскостью на осях, измеряют в длинах ребер элементарной ячейки (x, y, z). Затем обратные значения этих величин умножают на соответствующие числа так, чтобы получить три наименьших возможных целых числа, которые и называются индексами Миллера
(h, k, l): 1x : 1y : 1z = h : k : l .
Пример. В кубических кристаллах основными кристаллографическими плоскостями являются (1,0,0) – грань куба, (1,1,0) диагональная плоскость куба, проходящая через два ребра, (1,1,1) – диагональная плоскость, проходящая через три вершины (рис. 3.6).
|
|
|
1 |
|
0 |
0 |
|
0 |
|
1 |
1 |
|
1 |
|
(100) |
(110) |
1 |
(111) |
1 |
Рис. 3.6. Индексы Миллера для обозначения основных кристаллографических плоскостей в кубическом кристалле
Вследствие симметрии кристаллической решетки отдельные плоскости образуют группы эквивалентных плоскостей. Например, равнозначными в кубических кристаллах являются плоскости (100), (010), (001), …. Группа эквивалентных плоскостей обозначается {100}.
Направления в кристалле определяются также индексами Миллера. В кубическом кристалле направления [h, k, l] перпендикулярны плоскостям с тем же набором индексов.
84
3.3.2.Молекулярные кристаллы
В узлах кристаллической решетки молекулярных кристаллов располагаются молекулы. Связь между ними осуществляется за счет сравнительно слабых, короткодействующих сил межмолекулярного взаимодействия (силы Ван-дер-Ваальса) и водородных связей. Расположение частиц подчиняется законам плотнейшей упаковки с учетом геометрии самих молекул и ориентирующим эффектом ориентационного и индукционного взаимодействия диполей. Межмолекулярное расстояние существенно больше, чем внутримолекулярное (длина связи в молекулах меньше, чем расстояние между молекулами). В ряде случаев из молекулярных кристаллов в отдельную группу выделяют кристаллы с преимущественно водородной связью между молекулами. Отличительной особенностью этих кристаллов (например, кристаллов льда) является расположение молекул в пространстве и число ближайших соседей, обусловленные водородными связями между молекулами, а не законами плотнейших упаковок.
Пример. В кристаллах йода длина ковалентной связи в молекуле I2
о |
о |
rI−I = 2,67 А , а расстояние между молекулами I2-I2 |
rI2 −I2 = 3,60 А и |
o
rI2 −I2 = 4,40 A в зависимости от направления в кристаллической решетке.
Подобным образом кристаллизуются H2O, Ме(ОН)2, N2, Xe, Kr, H2 и т.д. Кристаллы обладают сравнительно низкой температурой плавления, низкой твердостью, неэлектропроводны.
3.3.3.Ковалентные (атомные) кристаллы
Ковалентные кристаллы образуют атомы с равной или близкой электроотрицательностью. Связь между атомами в решетке осуществляется за счет ковалентной связи, поэтому число ближайших соседей в решетке определяется валентностью атома (числом общих электронных пар с соседними атомами). Взаимное расположение ближайших соседних атомов определяется направленностью в пространстве валентных орбиталей. В случае ковалентных кристаллов координационное число равно числу ковалентных связей атома в узле кристаллической решетки.
Пример. Кристалл, образованный атомами углерода, имеющего четыре валентных электрона (C-2s22p2). В случае sp3-гибридизации четыре гибридные орбитали образуют тетраэдрическую структуру, пространственное повторение которой дает решетку алмаза. Каждый атом углерода связан с
85
о
четырьмя соседними атомами равноценными связями ( rсв =1,54 А), угол
между которыми составляет ~109o. Алмазоподобную решетку имеют также и изоэлектронные углероду атомы кремния (Si-3s23p2), германия (Ge- 4s24p2). Алмазоподобную решетку образуют также изоэлектронные молекулы (суммарное число валентных электронов такое же как и у двух атомов углерода). Например, нитрид бора (боразон) [B 2s22p1 N 2s22p3], арсенид галлия [Ga 4s24p1 As 4s24p3], карбид кремния (карборунд) [C 2s22p2 Si 3s23p2]. Необходимо отметить, что в нитриде бора и арсениде галлия четвертая ковалентная связь образуется по донорно-акцепторному механизму.
Как известно, углерод имеет несколько полиморфных (аллотропических) модификаций: алмаз, графит, карбин (нитевидный углерод), фуллерены. Кристаллическая решетка алмаза, как было показано выше, соответствует полной sp3-гибридизации валентных электронов. Однако в гибридизации могут участвовать не все валентные электроны. Случаю sp2-гибридизации соответствует кристаллическая решетка графита. Три гибридные орбитали образуют плоский правильный треугольник, перпендикулярно которому располагается четвертая р-орбиталь. Каждый атом углерода связан с тремя соседями равноценными σ-связями, образованными sp2-гибридными электронами. В результате в плоскости образуется
о
гексагональная сетка ( rсв =1,4 А) связанных между собой атомов углерода. Отдельные плоскости связаны между собой более слабой связью
о
( rсв = 3,4 А ) за счет негибридизованных p-электронов. Кристаллическая
решетка представляет собой набор параллельных, относительно слабо связанных между собой плоскостей.
Случаю sp-гибридизации соответствует кристаллическая решетка карбина.
3.3.4.Ионные кристаллы. Ионный тип химической связи
Распространенным типом кристаллов являются кристаллы, образованные атомами (как минимум двумя различными атомами) с сильно различающимися значениями электроотрицательностей (χВ>>χА). В первом приближении можно считать, что в этом случае пара валентных электронов полностью смещается к атому В, при этом образуются ионы противоположного знака: А+ – катион и В- – анион. Данное допущение считается справедливым, если перенос заряда составляет величину более 2/3 от максимально возможной, что соответствует разности в значениях электроот-
86

рицательностей по Полингу более чем 2,1 ( χB − χA > 2,1 ).
Минимум энергии системы соответствует чередованию во всех направлениях в кристаллической решетке катионов и анионов. В данном случае химическую связь относят к ионному типу и ее описание сводится к определению энергии взаимодействия ионов, то есть электрических зарядов. В первом приближении ионы можно представить недеформирующимися шарами. Поскольку электрическое поле сферически симметрично, энергия взаимодействия определяется только расстоянием между зарядами, а не их взаимным расположением. Минимум энергии достигается в случае наименьшего расстояния между зарядами, что выполняется при одном из вариантов плотнейшей упаковки ионов. Энергия электростатического взаимодействия одного моля ионов в кристалле (энергия ионной связи) называется энергией кристаллической решетки.
Расчет энергии ионной кристаллической решетки.
Между катионом (A+) и анионом (B-) действуют силы электростатического притяжения и отталкивания. Энергия притяжения может быть описана законом взаимодействия точечных зарядов. Энергия отталкивания ближайших соседних ионов определяется взаимодействием системы точечных зарядов электронов и ядер и описывается более сложной зависимостью. Энергия взаимодействия пары ионов равна сумме энергии притяжения и энергии отталкивания: E = Eпр + Eот .
Энергия притяжения противоположных по знаку зарядов в зависимости от расстояния между ними определяется законом Кулона:
Eпр = − k re2
трона, k – константа в законе Кулона.
Энергию отталкивания М.Борн (M.Born) предложил определять по
формуле Eот = |
B |
, где B - постоянная величина, n – коэффициент борнов- |
|
rn |
|||
|
|
ского отталкивания.
Таким образом, энергия двух взаимодействующих ионов в зависимости от расстояния между их центрами будет равна:
E(r) = − |
k e2 |
+ |
B |
. |
|
r |
r n |
||||
|
|
|
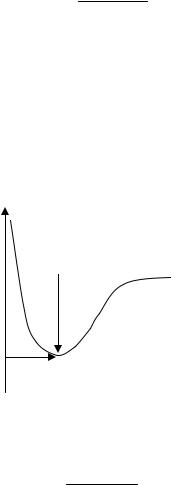
Энергия химической связи пары ионов (Eсв) соответствует минимуму энергии системы, который достигается на расстоянии между ионами, равном длине связи (r = rсв) (рис. 3.7).
Постоянную B можно определить из условия равенства нулю первой производной функции в точке минимума:
87
dE(r) |
↓r =r |
= |
k e2 |
− |
n B |
= 0 |
, |
|
dr |
r 2 |
rn+1 |
||||||
св |
|
|
|
|||||
B = k e2 rсвn−1 . n
Тогда величина энергии химической связи пары ионов будет равна:
Eсв = − |
k e2 |
|
k e2 r n−1 |
|
k e2 |
1 |
|
|
|
+ |
|
= − |
|
(1 − |
|
) . |
|
rсв |
r n n |
rсв |
n |
|||||
|
|
|
св |
|
|
|
|
|
Для определения энергии кристаллической решетки необходимо учесть, что один моль вещества содержит NА (число Авогадро) пар ионов. Кроме того, необходимо учесть энергию взаимодействия каждого иона как с ближайшими, так и с более удаленными ионами. Вклад этого взаимодействия зависит от типа кристаллической решетки и учитывается с помощью множителя А, который называется постоянной Маделунга.
E(r)
0  r
r
Eсв
rсв
Рис. 3.7. Энергия взаимодействия пары ионов в зависимости от расстояния между ними
Таким образом, энергия кристаллической решетки, образованной однозарядными ионами, определяется уравнением (уравнение Борна)
Eсв = − A Na k e2 (1− 1 ) , rсв n
где А – постоянная Маделунга, для кристаллической решетки типа NaCl (ГЦК) A=1,7475, типа CsCl (ПК) A=1,763; n – коэффициент борновского отталкивания определяется из сжимаемости кристалла – относительного уменьшения его объема при увеличении давления. Для галогенидов щелочных металлов n = 6 – 12.
88
Реальные ионы в узлах кристаллической решетки не являются недеформирующимися шарами. Для более точного расчета величины энергии кристаллической решетки необходимо учитывать эффекты, связанные с деформацией ионов, которая приводит к разделению центров положительных и отрицательных зарядов, то есть при рассмотрении взаимодействия точечных зарядов необходимо учесть взаимодействие диполей. Вклад этих эффектов невелик и составляет единицы процентов.
Электростатическая модель дает хорошее совпадение с экспериментальными результатами для кристаллов галогенидов щелочных металлов
(табл. 3.3).
Таблица 3 . 3
Энергия кристаллической решетки, рассчитанная по уравнению Борна, из термодинамики и измеренная экспериментально
Кристалл |
Уравнение |
Термодинамический расчет |
Эксперимент |
|
Борна |
|
|
|
|
кДж/моль |
|
NaCl |
749,1 |
768,7 |
757,8 |
NaBr |
712,7 |
733,6 |
744,0 |
NaI |
667,1 |
688,9 |
693,9 |
Энергия ионной решетки существенно больше, чем энергия межмолекулярного взаимодействия в молекулярных кристаллах, и сравнима с энергией ковалентных связей в атомном кристалле. Поэтому, как правило, разрушение ионного кристалла происходит труднее, чем молекулярного, но легче, чем атомного (механическая прочность, плавление).
Таким образом, силы взаимодействия, определяющие ионную связь, характеризуются следующими свойствами: ненасыщенностью, ненаправленностью, дальнодействием. Поэтому координационное число в ионных кристаллах определяется геометрией плотнейшей упаковки. Например, в кубической простой решетке КЧ=6, в объемоцентрированной КЧ=8, а в гранецентрированной КЧ=12.
3.3.5.Металлические кристаллы. Металлическая химическая связь
Металлические кристаллы – металлы – отличаются от других прежде всего физическими свойствами. Они имеют характерный металлический блеск, высокую электро- и теплопроводность, способность легко пластически деформироваться без разрушения. Эти свойства определяются особым типом химической связи, которая возникает между атомами в металлических кристаллах.
Кристаллическая решетка металлов, как правило, является плотной упаковкой (КПУ или ГПУ) атомов. Элементарная ячейка – кубическая гранецентрированная (КЧ=12), кубическая объемоцентрированная (КЧ=8) или гексагональная (КЧ=12).
89
Такое строение кристалла характерно для веществ с ионной связью или межмолекулярным взаимодействием между частицами. Модель ионной связи не может быть использована, поскольку в узлах кристаллической решетки находятся одинаковые атомы с равной электроотрицательностью и трудно предположить, что происходит локализованное разделение зарядов с образованием положительно и отрицательно заряженных ионов. Химическая связь между частицами за счет межмолекулярного взаимодействия (силы Ван-дер-Ваальса) не согласуется с экспериментальными данными по энергии, которая имеет порядок величины, характерный для ионных или ковалентных кристаллов. В то же время классическая модель ковалентной связи между атомами металла в кристаллической решетке не согласуется со значительно большим числом ближайшихсоседей(КЧ = 8-12), чем число валентных электронов (максимальное число ковалентных связей, которые может образовать атом с учетом гибридизации равно шести). Следовательно, химическая связь между атомами в металлических кристаллах должна быть описана особой моделью, получившей название металлической. Поскольку в узлах кристаллической решетки металлов находятся атомы, имеющие валентные электроны, то логично предположить, что модель металлической связи может быть построена на основе представлений ковалентной связи.
Таблица 3 . 4
Электронная конфигурация внешних слоев атомов, тип кристаллической решетки (КР), температуры плавления (tпл) и кипения (tкип), энтальпии плавления (∆Нпл) и кипения (∆Нкип), твердость металла по Бринелю (НВ) простых веществ
элементов 4-го периода Периодической таблицы
nэ |
Электронная |
КР |
tпл, |
∆Нпл, |
НВ, |
tкип, |
∆Нкип, |
|
|
конфигурация |
|
оС |
кДж/моль |
МПа |
оС |
кДж/моль |
|
|
элемента |
|
|
|
|
|
|
|
1 |
K |
s1 |
ОЦК |
63,55 |
2,3 |
- |
760 |
89,4 |
2 |
Ca |
s2 |
ГЦК |
842 |
8,4 |
300 |
1485 |
152 |
3 |
Sc |
s2d1 |
Гекс. |
1541 |
14,1 |
550 |
2850 |
315 |
4 |
Ti |
s2d2 |
ГПУ |
1668 |
15 |
600 |
3330 |
410 |
5 |
V |
s2d3 |
ОЦК |
1920 |
23,0 |
800 |
3400 |
443 |
6 |
Cr |
s1d5 |
ОЦК |
1890 |
21,0 |
1000 |
2680 |
398 |
7 |
Mn |
s2d5 |
ОЦК |
1245 |
12,6 |
- |
2070 |
227 |
8 |
Fe |
s2d6 |
ОЦК |
1539 |
13,77 |
800 |
3200 |
350 |
9 |
Co |
s2d7 |
Гекс. |
1494 |
16,3 |
1550 |
2960 |
376 |
10 |
Ni |
s2d8 |
ГЦК |
1455 |
17,5 |
800 |
2900 |
370 |
11 |
Cu |
s1d10 |
ГЦК |
1084 |
12,97 |
400 |
2540 |
302 |
12 |
Zn |
s2d10 |
ГПУ |
419,5 |
7,24 |
- |
906 |
115 |
13 |
Ga |
s2d10p1 |
Ромб. |
29,75 |
5,59 |
60 |
2403 |
256 |
14 |
Ge |
s2d10p2 |
ПК |
958,5 |
37 |
- |
2850 |
343 |
15 |
As |
s2d10p3 |
Гекс. |
817 |
21,8 |
- |
Cубл. |
33 |
16 |
Se |
s2d10p4 |
Гекс. |
221 |
6,7 |
710 |
685,3 |
30 |
17 |
Br |
s2d10p5 |
|
-7,25 |
10,6 |
- |
59,8 |
29,6 |
18 |
Kr |
s2d10p6 |
|
-157 |
1,64 |
- |
-153 |
9,0 |
90
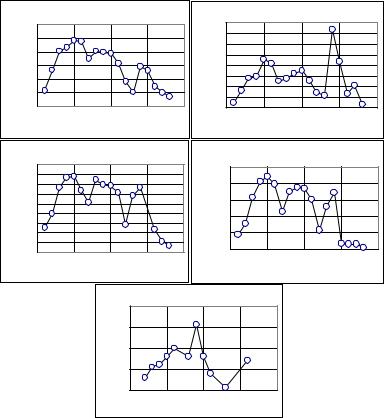
В табл. 3.4 и на рис. 3.8 приведены данные по изменению некоторых физико-химических характеристик простых веществ четвертого периода таблицы Д.И. Менделеева (первый период, содержащий d-элементы) в зависимости от числа внешних электронов. Все они связаны с энергией взаимодействия между атомами в конденсированной фазе и в периоде закономерно изменяются. Характер изменения характеристик от числа электронов на внешнем уровне позволяет выделить отдельные области: область возрастания (примерно 1-6), область относительного постоянства (6-10), область уменьшения значений (10-13), скачкообразное увеличение (14) и монотонное уменьшение (14-18).
|
|
Температураплавления |
|
|
Энтальпия плавления |
|
|
||||
|
2500 |
|
|
|
|
|
40 |
|
|
|
|
|
2000 |
|
|
|
|
|
35 |
|
|
|
|
|
|
|
|
|
,кДж/моль |
30 |
|
|
|
|
|
|
1500 |
|
|
|
|
|
|
|
|
||
tпл, С |
|
|
|
|
25 |
|
|
|
|
||
1000 |
|
|
|
|
20 |
|
|
|
|
||
500 |
|
|
|
|
15 |
|
|
|
|
||
|
|
|
|
|
Н |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
-500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
5 |
10 |
15 |
|
20 |
0 |
5 |
10 |
15 |
20 |
|
|
Число электронов |
|
|
|
Число электронов |
|
|
|||
|
|
Температуракипения |
|
|
|
Энтальпия кипения |
|
|
|||
|
4000 |
|
|
|
|
|
500 |
|
|
|
|
|
3500 |
|
|
|
|
|
400 |
|
|
|
|
|
3000 |
|
|
|
|
кДж, /моль |
|
|
|
|
|
tкип, С |
2500 |
|
|
|
|
300 |
|
|
|
|
|
2000 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
1500 |
|
|
|
|
200 |
|
|
|
|
||
1000 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Н |
100 |
|
|
|
|
|
|
500 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
0 |
|
|
|
|
|
0 |
|
|
|
|
|
-500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
|
|
0 |
5 |
10 |
15 |
|
20 |
|||||
|
|
|
|
Число электронов |
|
||||||
|
|
Число электронов |
|
|
|
|
|
||||
|
|
|
2000 |
Твердость по Бринелю |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
,МПа |
1500 |
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
НВ |
|
|
|
|
|
|
|
|
|
|
|
|
500 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
5 |
10 |
15 |
|
20 |
|
|
|
|
|
|
|
|
Число электронов |
|
|
|
|
|
Рис. 3.8. Зависимость температуры плавления (tпл) и кипения (tкип), энтальпии плавления (∆Нпл) |
|||||||||||
и кипения (∆Нкип), твердости поБринелю простых веществ 4-гопериода от числа электронов на |
|||||||||||
внешнем энергетическом уровне(число электронов сверх полностью заполненной оболочки |
|||||||||||
|
|
|
|
благородного газа Ar) |
|
|
|
|
|||
|
|
|
|
|
|
|
91 |
|
|
|
|
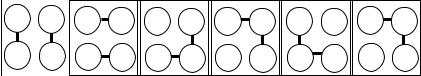
Как было отмечено, для описания химической связи, возникающей между атомами металлов, можно использовать представления метода валентных связей. Подход к описанию можно проиллюстрировать на примере кристалла калия. Атом калия на внешнем энергетическом уровне имеет один электрон. В изолированном атоме калия этот электрон находится на 4s-орбитали. В то же время в атоме калия имеются не сильно отличающиеся по энергии от 4s-орбитали свободные, не занятые электронами орбитали, относящиеся к 3d, 4p-подуровням. Можно предположить, что при образовании химической связи валентный электрон каждого атома может располагаться не только на 4s-орбитали, но и на одной из свободных орбиталей. Один валентный электрон атома позволяет ему реализовать одну единичную связь с ближайшим соседом. Наличие в электронной структуре атома мало различающихся по энергии свободных орбиталей позволяет предположить, что атом может «захватить» электрон от своего соседа на одну из свободных орбиталей и тогда у него появится возможность образовать две единичные связи с ближайшими соседями. В силу равенства расстояний до ближайших соседей и неразличимости атомов возможны различные варианты реализации химических связей между соседними атомами. Если рассмотреть фрагмент кристаллической решетки из четырех соседних атомов, то возможные варианты показаны на рис. 3.9.
К |
1 К |
К 2 К |
К+ 3 К |
К 4 К– |
К 5 К+ |
К 6 К– |
|||||
К |
К |
К |
К |
К |
К– |
К+ |
К |
К– |
К |
К+ |
К |
Рис. 3.9. Фрагмент кристаллической решетки калия и возможныеварианты образования единичных химических (общихэлектронных пар) междусоседними атомами
Полинг и Слэтер показали, что если имеется возможность одновременного существования нескольких электронных структур, способных свободно переходить друг в друга, то это приводит к понижению энергии системы. Эти структуры были названы резонансными. Каждая из них, взятая в отдельности, не отражает химическую связь. Описание связи в кристалле можно получить суперпозицией резонансов. То есть в металлическом кристалле положение связей между атомами соответствует не какой-то конкретной структуре, а всем сразу. Таким образом, положение химических связей в пространстве делокализовано. Возможность реализации резонансов обусловлена именно наличием в электронной структуре атома металла свободных орбиталей, незначительно отличаю-
92
щихся по энергии от валентных, которые были названы металлическими. Прочность металлической химической связи определяется как числом валентных электронов, так и числом металлических орбиталей. Отметим, что, с учетом того, что в атомах металлов может происходить гибридизация s-, p- и d-электронных орбиталей, максимальное число валентных орбиталей равно шести.
Во всех рассмотренных ранее моделях химической связи в неметаллических кристаллах и молекулах валентные электроны локализованы (принадлежат определенным атомам). Вследствие делокализации единичной химической связи в металлах валентные электроны могут свободно переходить от атома к атому, т. е. они делокализованы (принадлежат не определенным атомам, а всему кристаллу в целом). Часто для описания металлических кристаллов используют модель «электронного газа», в котором находится кристаллическая решетка, образованная однозарядными положительными ионами. При наложении электрического поля электроны направленно двигаются в металле: металлы обладают высокой электропроводностью. Наличие свободных электронов объясняет также высокую теплопроводность, взаимодействие с электромагнитным излучением и др.
Представления о химической связи в металлическом кристалле позволяют объяснить закономерности изменения физических свойств металлов, четвертого периода, которые приведены в табл. 3.4 и на рис. 3.6. Увеличение числа валентных электронов приводит к увеличению энергии связи (область 1-6). Относительное постоянство (область 6-10) связано с достижением и сохранением максимального числа электронов на металлических орбиталях. Дальнейшее увеличение электронов приводит к уменьшению числа металлических орбиталий (область 10-13). У элементов от германия (14-18) орбитали, играющие роль металлических, отсутствуют, элементы теряют свойства металлов. Кристаллы этих простых веществ будут ковалентными или молекулярными.
3.3.6.Зонная модель кристаллического тела
Электропроводность (электрическая проводимость, проводимость) – способность вещества проводить электрический ток под действием электрического поля. Она обусловлена присутствием свободных носителей заряда в твердом теле, направленное движение которых и есть электрический ток. Электропроводность σ определяется величиной заряда
носителя тока q, его подвижностью µ и концентрацией носителей n. Размерность σ – Ом-1 м-1 или чаще Ом-1 см-1: σ = qµn.
По механизму, величине и температурной зависимости электропроводности твердые тела классифицируют на металлы, полупроводники и диэлектрики.
93
Металлы имеют при комнатной температуре высокую электропровод- ность (σ = 104 – 106 Ом-1 см-1), которая уменьшается с ростом температуры. Диэлектрики из-за отсутствия носителей заряда при обычных условиях обладают низкой проводимостью (σ = 10-8 – 10-18 Ом-1 см-1). По-
лупроводники по величине электропроводности занимают промежуточное положение (σ = 10-8 – 104 Ом-1 см-1), электропроводность увеличивается с ростом температуры.
Вметаллах и полупроводниках электропроводность обусловлена подвижностью электронов. Для описания механизма переноса заряда должны быть использованы модели химической связи в кристаллах. Причем для каждого отдельного типа кристалла должны быть использованы свои модели (металлическая связь, ковалентная связь и т. д.).
Врамках физики твердого тела была разработана зонная модель твердого тела, позволяющая с единой позиции описать поведение электронов во всех типах кристаллов. В результате решения квантово-механической задачи об энергетических состояниях электрона в кристалле (уравнение Шредингера для кристалла) были сформулированы следующие основные положения.
Всистеме из N изолированных атомов имеются разрешенные энергетические состояния, которые N-кратно вырождены (одинаковые по энергии для всех атомов). В кристалле, вследствие взаимодействия между атомами, вырождение снимается, энергетические состояния будут отличаться друг от друга. В результате в кристалле возникает система, со-
стоящая из N различных близкорасположенных энергетических уровней,
которые образуют энергетические зоны. Эти зоны отделены друг от друга запрещенными зонами (области значений энергий, которые не могут принимать электроны).
На каждом энергетическом уровне согласно принципу Паули может находиться не более двух электронов. Поэтому, если в зоне все уровни заселены электронами, их перемещение невозможно. В то же время, если имеются свободные, незанятые уровни, электрон может свободно переходить с одного уровня на другой.
Наивысшая из разрешенных энергетических зон электронов кристалла,
вкоторой при температуре 0 К энергетические состояния заняты, называ-
ется валентной зоной.
Пустая верхняя разрешенная энергетическая зона при 0 К называется
зоной проводимости.
К аналогичным положениям можно прийти, используя метод молекулярных орбиталей для описания химической связи в кристалле. Согласно методу МО каждый электрон принадлежит всей молекуле и движется в поле всех ядер и электронов. В методе МО оперируют понятием молеку-
94
лярных орбиталей, которые получают в результате сложения и вычитания атомных орбиталей. Число молекулярных орбиталей всегда равно числу атомных орбиталей АО, взятых для их построения. Заселение электронами молекулярных орбиталей происходит с выполнением тех же принципов, что и заселение АО (принцип минимума энергии, принцип Паули, правило Хунда).
Кристалл можно рассмотреть как макромолекулу, состоящую из N- атомов. В этом случае кристалл будет иметь N молекулярных орбиталей, совокупность которых образует систему энергетических зон, аналогичную полученной из зонной модели.
Энергетические зоны характеризуются понятиями ширина зоны и заселенность. Ширина зоны равна разности максимального и минимального значений энергий МО, входящих в зону. Она определяется природой атомов и межатомным расстоянием, но не зависит от N. Для реальных кристаллов ширина зон составляет величину порядка нескольких электронвольт. Поэтому при N ~ 1023 (количество вещества порядка одного моля) разница энергий между уровнями в зоне ~10-23 эВ. Если уровни не заняты, электроны могут свободно переходить с одного уровня на другой в пределах зоны, поскольку энергия электрона при T=300К составляет величину порядка 3 k T = 0,078 эВ, что несоизмеримо больше различия в энер-
гии между уровнями. Такие электроны обычно называют свободными, при приложении электрического поля именно они определяют электропроводность вещества, участвуя в переносе заряда. Энергетические зоны отделены друг от друга запрещенными зонами (области значений энергий, которые не могут принимать электроны).
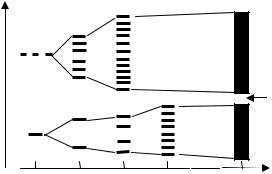
Если кристалл состоит из N одинаковых атомов, имеющих s и p атомные орбитали, то образуется система, состоящая из s-зоны МО, содержащей N s АО, и р-зоны МО, содержащей 3N p АО (рис. 3.10).
E |
|
|
|
|
|
p- |
|
|
|
p- |
|
|
|
|
|
|
|
|
|
|
|
Запрещенная |
|
s-АО |
|
|
|
зона |
|
|
|
|
|
|
|
|
|
|
|
|
s- |
1 |
2 |
4 |
8 |
1023 |
N |
Рис. 3.10. Построениеэнергетических зон при последовательном присоединении атомов
95

Свойства твердых тел с позиций зонной теории определяются взаимным расположением зон и их заселенностью, то есть количеством электронов в зоне. В зависимости от строения электронных оболочек атомов кристалла и типа химической связи между ними образующиеся энергетические зоны могут быть полностью или частично заселены электронами. Полностью заполненная зона представляет собой валентную зону, а свободная или частично заполненная – зону проводимости. Энергетическая разность между максимальным по энергии уровнем валентной зоны (EV – верх валентной зоны) и нижним уровнем зоны проводимости (EC – дно зоны проводимости) называется шириной запрещенной зоны (Eg = EC – EV).
Распределение электронов по энергетическим состояниям.
Вероятность заселения электронами энергетических состояний в кристалле (р) описывается функцией распределения Ферми-Дирака:
p = |
|
1 |
|
|
, |
|
|
|
|
|
|||
1+exp( |
E − EF |
) |
|
|||
|
||||||
|
|
|
|
k T |
||
где E – энергия электронного уровня; |
|
|
EF – энергия Ферми; k – константа |
|||
Больцмана. |
|
|
|
|
|
|
При абсолютном нуле, согласно принципу минимума энергии и принципу Паули, все энергетические состояния ниже какого-то уровня заняты (вероятность их заполнения р=1), а состояния, расположенные по энергии выше, свободны (вероятность их заполнения р=0). Граница заселения энергетических уровней называется уровнем Ферми (энергия Ферми – EF). С повышением температуры вследствие теплового возбуждения часть электронов переходит из состояний, лежащих ниже уровня Ферми, в состояния с энергией, превышающий уровень Ферми. Это приводит к «размыванию» первоначальной функции распределения состояний. Необходимо отметить, что число электронов выше уровня Ферми (в зоне проводимости) и свободных уровней ниже уровня Ферми (в валентной зоне) одинаково. Их распределение по энергии зеркально симметрично
(рис.3.11).
p
0 oK
1
T>0 oK
0 E
EF
Рис. 3.11. Распределение электронов поэнергетическим состояниям для металлов
96

Для полупроводников возможен переход электронов из валентной зоны в зону проводимости вследствие их теплового возбуждения. Вероятность этого перехода зависит от ширины запрещенной зоны (Eg) и температуры. При относительно высоких температурах функция распределения (р) приобретает вид
(E – EF)>>k T, exp( Ek− TEF ) >>1, p = exp(− Ek− TEF ) .
Так как уровень Ферми находится в середине запрещенной зоны:
EF = EC − 12 Eg , E = EC, Eg = EC – EV, то функция распределения, опре-
деляющая вероятность перехода электронов из валентной зоны в зону
проводимости, будет иметь вид p = exp(− Eg ) . 2 k T
3.3.7.Металлы, полупроводники и диэлектрики
В зависимости от ширины запрещенной зоны (Eg) все твердые тела подразделяются на металлы (Eg < 0,08 эВ), диэлектрики (Eg > 3 эВ), полупроводники (0,08 эВ < Eg < 3 эВ).
Металл – это кристалл, в котором либо не все энергетические уровни валентной зоны заняты электронами, либо валентная зона и зона проводимости перекрываются. Ширина запрещенной зоны равна нулю, или ее величина меньше тепловой энергии кристалла, которая составляет величину порядка 3kT, что при T=300К примерно равно 0,08 эВ. В металлах число свободных электронов сравнимо с числом атомов в том же объеме
( ≈1022 атом/см3), при этом концентрация электронов не зависит от темпе-
ратуры. Электропроводность при T≈300K велика. Металлами являются кристаллические вещества с металлическим типом химической связи.
Диэлектрик и полупроводник имеют ширину запрещенной зоны больше, чем энергия тепловых колебаний решетки. Если ширина запрещенной зоны не слишком велика, то существует вероятность перехода электронов из валентной зоны в зону проводимости за счет тепловых колебаний решетки либо за счет поглощения кванта света. Условной границей подразделения кристаллов на полупроводники и диэлектрики является ширина запрещенной зоны, при которой возможен переход электрона из валентной зоны в зону проводимости при поглощении кванта видимого света. Энергия кванта, соответствующего коротковолновой границе видимой области света (λ 400 нм), составляет величину hν ~ 3 эВ.
Полупроводник – это кристалл, у которого все энергетические уровни валентной зоны при T=0К заняты, а ширина запрещенной зоны составляет
97
величину в интервале 0,08 эВ <Eg<3 эВ. Концентрация свободных электронов при Т=0К равна нулю, с ростом температуры она экспоненциально растет, соответственно экспоненциально растет и электропроводность:
σ(Т) exp(− Eg ) . 2 k T
В полупроводниковых кристаллических веществах химическая связь относится к ковалентному или смешанному ионно-ковалентному типу.
Диэлектрик – кристалл, имеющий ширину запрещенной зоны много больше, чем энергия тепловых колебаний (Е>>kT), концентрация свободных электронов равна нулю. Электропроводность незначительна, слабо зависит от температуры.
Примеры.
Металлический кристалл лития. Валентные электроны 2s1. 2s-атомные орбитали образуют валентную зону, которая заполнена только наполовину.
2s-валентная зона
Металлический кристалл магния. Валентные электроны 3s2.
3p-зона проводимости
3s валентная зона
Валентная зона магния заполнена электронами полностью, свободные уровни, которые могли бы обеспечить перемещение электронов в валентной зоне, отсутствуют. Ближайшая по энергии зона, зона проводимости, образованная свободными 3p атомными орбиталями, перекрывается с валентной зоной.
Кристалл кремния. Валентные электроны 3s23p2.
Кремний – ковалентный кристалл, связи осуществляются электронами, располагающимися на sp3-гибридных орбиталях, которые образуют как валентную зону, так и зону проводимости. Каждый атом кремния имеет 4 sp3-гибридные орбитали, то есть в кристалле, состоящем из N атомов, имеется 8N энергетических состояний электронов. Нижняя по энергии половина из них при Т=0 К полностью заселена, образуя валентную зону, а верхняя свободна, образуя зону проводимости. В отличие от магния, в кристалле кремния валентная зона и зона проводимости не перекрываются. Ширина запрещенной зоны составляет величину Eg=1,12 эВ. Кристалл кремния – полупроводник.
98
sp3 зона проводимости
Eg – запрещенная зона
sp3 валентная
Кристалл NaCl. Поскольку химическая связь в этом кристалле относится к ионному типу, валентными электронами будут Na+3s0 Cl- 3s23p6.
Валентная зона образована 3p электронными орбиталями хлора, она полностью заселена. Зону проводимости образуют вакантные s-орбитали натрия. В кристалле хлорида натрия, так же как и в случае с кристаллом кремния, валентная зона и зона проводимости не перекрываются. Но ширина запрещенной зоны много больше, чем у кремния, Eg = 7,7 эВ, хлорид натрия – диэлектрик.
3.3.8.Кристаллические материалы
Наиболее близким к идеальному понятию кристалл является монокри-
сталлический материал. Монокристалл (монос – один) – это твердое ве-
щество с непрерывной кристаллической решеткой во всем объеме физического тела. Линейные размеры монокристаллов могут составлять доли микрометра и доходить до 1 м. Монокристаллы, в силу своего внутреннего строения, обладают анизотропными свойствами. Анизотропия (анизос – неравный, тропос – направление) – зависимость физических и физико-химических свойств тела от направления в кристалле. Если в рассматриваемом физическом теле имеется несколько различным образом ориентированных, связанных между собой сильными химическими связями монокристаллов, то данное тело представляет собою блочный монокристалл. Границы отдельных блоков (монокристаллов) – это дефекты кристаллической структуры.
Гораздо более распространены в природе твердые тела, состоящие из большого числа произвольно ориентированных относительно друг друга мелких монокристаллов, сцепленных как сильными, так и слабыми химическими связями. Такие тела называются поликристаллами (полис – многочисленный). Поликристаллические тела, вследствие усреднения анизотропных свойств отдельных произвольно ориентированных монокристаллов, обладают изотропией физических и физико-химических свойств.
Дефекты кристаллической решетки.
Если структура твердого тела соответствует идеальной кристаллической решетке, то система находится в состоянии с минимумом энергии.
99
Это соответствует состоянию идеального кристалла при Т = 0 К. Любое сообщение системе дополнительного количества энергии переводит ее в возбужденное состояние, при этом в кристалле нарушается строгая периодичность расположения частиц в кристаллической решетке, то есть создаются дефекты.
Другим типом дефектов являются нарушения регулярности решетки, связанные с примесями, которые появились в кристалле случайно (химические примеси) или были введены в него преднамеренно (легирующие добавки). С дефектами связаны многие физические и химические свойства кристаллов (электропроводность, прочность, оптические свойства, коррозионная стойкость и др.).
Различают точечные дефекты, одномерные (дислокации) и двумерные
(поверхности, границы кристаллических зерен). Дефекты возникают как в процессе кристаллизации, так и в результате внешних воздействий на кристалл. Создание дефектов данного типа связано с разрывом имеющихся химических связей между атомами кристалла или образованием дополнительных связей.
Простейшими из точечных дефектов в полупроводниках являются электроны проводимости и дырки. Они образуются в результате асимметричного разрыва химической связи между атомами кристалла при поглощении тепловой энергии. При этом один из атомов приобретает избыточный отрицательный заряд за счет дополнительного валентного электрона (электрон проводимости), а другой – избыточный положительный заряд (дырка). Оба дефекта могут перемещаться по кристаллу независимо друг от друга. Электрон проводимости перемещается путем эстафетной передачи избыточного электрона от атома к атому, а дырка – путем эстафетного захвата электрона от атома к атому.
В процессе образования электронно-дырочных пар большую роль играют примесные атомы, находящиеся в узлах кристаллической решетки. Атомы примеси, имеющие число валентных электронов большее, чем число связей с ближайшими соседями (электронно-избыточные примеси), являются источником электронов проводимости. Образующиеся при этом дырки локализованы на примесном атоме и не могут мигрировать по кристаллу. Атомы примеси, имеющие число валентных электронов меньше, чем число связей с ближайшими соседями (электронно-дефицитные примеси), являются источником дырок, а электрон будет локализован на атоме примеси.
Энергия, необходимая для образования электронно-дырочных пар, может быть сообщена кристаллу не только нагреванием, но и при поглощении электромагнитного излучения. Причем энергия кванта электромагнитного излучения должна быть больше, чем ширина запрещенной зоны (энергии ионизации химической связи).
100
Необходимо отметить, что в кристаллах диэлектриков электроннодырочные пары не образуются при подводе тепловой энергии из-за большой величины ширины запрещенной зоны. Они могут быть образованы при поглощении электромагнитного излучения достаточной энергии или ионизирующего излучения.
При облучении кристаллов создаются дефекты без разрыва химической связи, например экситоны (от лат. excito – возбуждаю) – квазичастицы, представляющие собою возбужденные состояния атомов кристаллической решетки. Возбуждения могут передаваться от атома к атому, мигрируя по кристаллу.
Основными дефектами, связанными с нарушением регулярности расположения частиц в кристалле, являются следующие.
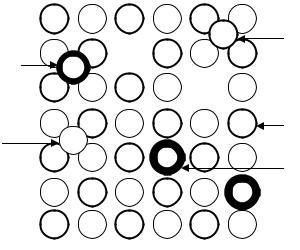
Точечные дефекты – нарушения, связанные с узлами решетки. Точечные дефекты могут быть собственными, связанными с разупорядочением решетки, и примесными, связанными с присутствием в кристаллической решетке посторонних атомов (рис. 3.12).
B-I
Vc
PI
Va
анион – B-G
A+I
P+G
 P-G
P-G
 катион – A+G
катион – A+G
Рис. 3.12. Точечные дефекты в решеткеионногокристалла: A+G – катионы в узлахрешетки; B-G - анионы в узлахрешетки; вакансии: Vc – катионные; Va – анионные; межузельныеионы: A+I катион; или B-I - анион; примесныеионы в узлерешетки: катион (P+G) или анион (P-G); примесный атом или ион в межузельном положении (PI)
101

Собственные дефекты:
•вакансия – отсутствие в узле решетки частицы, образующей кристалл.
Вслучае ионного кристалла существуют катионные и анионные вакансии;
•межузельные атомы или ионы.
В ионных кристаллах отсутствие в узле решетки катиона или аниона (вакансии в катионной или анионной подрешетке) нарушает баланс электрических зарядов в кристалле. Поэтому в кристалле должно быть либо равное количество катионных и анионных вакансий (дефекты Шоттки), либо на каждую ионную вакансию необходимо равное количество межузельных частиц того же знака (дефекты Френкеля).
Собственные дефекты образуются в кристалле в результате теплового движения частиц при температурах выше 0 К. Для создания собственного дефекта частица должна перейти из узла решетки в междоузлие, для этого частице необходимо преодолеть потенциальный барьер, который называется энергией образования дефекта (Ед). Вероятность преодоления потенциального барьера и образования дефекта определяется количеством частиц, имеющих энергию большую, чем энергия Ед. Из молекулярнокинетической теории известно, что доля таких частиц зависит от темпера-
туры и пропорциональна множителю exp(− kEДT ) . Таким образом, каждой
температуре соответствует равновесная концентрация собственных дефектов (n), которая экспоненциально увеличивается с ростом температуры:
n ≈ A exp(− kEдT ) ,
где А – предэкспоненциальный множитель, k – константа Больцмана; T – температура, К.
Примесные дефекты. Точечные дефекты могут быть примесными, связанными с присутствием в твердом веществе химических примесей, которые появляются случайно, их концентрация определяется степенью очистки вещества, или вводятся в кристалл преднамеренно. Примесный дефект может находиться в узле решетки или в межузельном положении. В каком положении будет находиться примесная частица, как правило, зависит от соотношения ее размеров и размеров частиц, образующих решетку.
Точечные дефекты вызывают нарушение регулярного расположения частиц кристалла в их ближайшем окружении (искажение кристаллической решетки), тем самым увеличивая энергию кристаллической решетки
(рис. 3.13).
102
p+
I
e−
ex0
PG 


 V
V
PI
Рис. 3.13. Искажение кристаллической решетки точечными дефектами. Электронные возбуждения: электроны (e-) A+e→A-, дырки (p+) A-e→A+, экситоны (ex0) A*. Собственные точечные дефекты: вакансии (V), межузельные атомы (I) Примесный точечный дефект:
решеточный примесный атом (PG), межузельный примесный атом (PI)
Дефекты могут захватывать электрон или отдавать его (захватывать дырки), могут взаимодействовать друг с другом, образовывая более сложные структуры (ассоциаты). Например, в щелочно-галоидных кристаллах (А+В-) анионная вакансия может захватить электрон Vae (электрон располагается на орбиталях катионов, окружающих анионную вакансию), и образуется так называемый F-центр. Если межузельный анион отдает электрон (захватывает дырку), то образуется H-центр (В0), который может с ближайшим решеточным анионом образовать молекулярный ион В2- (Vк- центр).
Линейные дефекты кристаллической решетки – дислокации.
Дислокации – дефекты кристаллической решетки, представляющие собой линии, вдоль которых нарушено правильное чередование атомных плоскостей. Дислокации появляются в кристалле в результате пластической деформации или в процессе роста кристалла. Простейшими типами дислокаций являются краевые (рис. 3.14) и винтовые (рис. 3.15).
103

Рис. 3.14. Краевая дислокация
Рис. 3.15. Винтовая дислокация
Кристаллическая решетка в непосредственной близости от дислокации находится в искаженном состоянии, поскольку в ней размещается дополнительное число атомов. Нормальный порядок расположения атомов восстанавливается в обоих направлениях от дислокации на расстоянии нескольких постоянных решетки.
Плотность дислокаций (концентрация дислокаций) в кристалле бывает очень велика, достигая 106 дислокаций на 1 см2.
104
3.3.9.Аморфные твердые тела
В аморфных твердых телах, в отличие от кристаллов, в которых существует пространственная периодичность в равновесных положениях атомов, атомы колеблются около хаотически расположенных точек. Основные отличия свойств аморфных веществ от кристаллических связаны именно с нерегулярностью расположения частиц. Хотя в аморфных веществах отсутствует дальний порядок, на расстояниях, сравнимых с длиной химических связей, пространственное расположение ближайших соседних частиц сохраняется, то есть имеется ближний порядок.
Такая разупорядоченность структуры является следствием недостаточной подвижности частиц при кристаллизации. Частицы при достаточно быстром охлаждении теряют подвижность и не успевают образовать кристаллическую решетку, то есть занять места в пространстве, отвечающие минимуму энергии. Таким образом, аморфное состояние вещества является нестабильным, обладающим избыточной энергией, и при определенных условиях может самопроизвольно переходить в кристаллическое состояние. В отличие от кристаллов, для которых существует фиксированная температура плавления, переход аморфного вещества из твердого состояния в жидкое происходит в некотором температурном интервале. Аморфные тела обладают изотропностью физико-химических свойств.
Аморфное вещество, которое образуется при охлаждении жидкости и переходе ее в твердое состояние без кристаллизации, называется стеклом.
В стеклообразное состояние переходят вещества с преимущественно ковалентным типом связи, например, некоторые оксиды (SiO2, P2O5, B2O3). Стеклами являются также и большинство органических полимеров.
Для описания строения стеклообразного состояния вещества существуют две основные модели.
Теория кристаллитов рассматривает стекло как совокупность мельчайших монокристаллических областей – кристаллитов.
Теория непрерывной неправильной сетки предполагает, что в стекле,
как и в монокристалле, существует пространственная сетка из химически связанных атомов. Но, в отличие от монокристалла, отсутствует строгое периодическое повторение фрагментов сетки.
Пример. Диоксид кремния (SiO2) может существовать как в кристаллическом состоянии – кварц, так и в стеклообразном - кварцевое стекло (плавленый кварц). И в том и в другом состоянии структурной единицей является тетраэдр SiO2, в центре которого находится ион кремния, а в вершинах – ионы кислорода. Тетраэдры связаны между собой через ионы кислорода, которые одновременно принадлежат двум тетраэдрам. В кристаллическом состоянии структура периодически повторяется, а в стеклообразном состоянии она искажена и не повторяется в объеме (рис. 3.16).
105
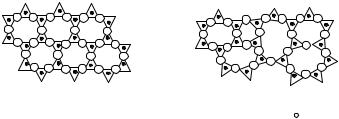
Кристалл |
Стекло |
Рис. 3.16. Проекция структуры кристаллического и стеклообразного SiO2: - атом кремния,
- атом кремния,  - атом кислорода
- атом кислорода
К аморфным веществам относятся также и мелкодисперсные порошки, состоящие из частиц, размер которых составляет величину порядка 10-100 длин химической связи, например сажа – мелкодисперсный углерод. Вещество в таком состоянии, в отличие от поликристаллов, не имеет фиксированной температуры плавления.
3.4.Химическая связь в жидкостях
3.4.1.Жидкое состояние вещества
Жидкое состояние вещества по степени упорядоченности взаимного расположения частиц и характеру их теплового движения занимает промежуточное положение между газообразным и кристаллическим.
Строение вещества и характер взаимодействия между частицами в жидкости имеет много общего с кристаллическим состоянием. Это сходство обусловлено близким взаимным расположением частиц (конденсированное состояние вещества) и сохранением характера химической связи между ними при фазовом переходе. Как правило, при плавлении молекулярных кристаллов получают молекулярные жидкости (частицами, образующими жидкость, являются молекулы), при плавлении ионных кристаллов – жидкости, состоящие только из ионов (электролиты), при плавлении металлических кристаллов – жидкие металлы. При плавлении ковалентных кристаллов в силу специфики характера ковалентной связи (насыщенность и направленность) поведение частиц в жидкости будет в сильной степени зависеть от химического состава вещества, при этом могут образовываться молекулярные и ионные жидкости (происходит полная или частичная диссоциация молекул на ионы) или жидкие металлы.
Частицы в жидкости, как и в твердом теле, совершают тепловые колебания около положений равновесия (период тепловых колебаний t0 10-12 c). Расположение частиц в пространстве в жидкости аналогично расположению частиц в стеклообразном состоянии («стекло – переохлажденная жидкость»).
106

Однако если в твердых телах эти положения равновесия фиксированы в пространстве и практически не изменяются во времени, то в жидком состоянии частицы по истечении некоторого времени t перескакивают в новое положение равновесия, перемещаясь на расстояние порядка среднего расстояния между ними. Эти перемещения и обусловливают текучесть жидкости, в силу которой жидкости изменяют свою геометрическую форму в поле силы тяжести, принимая форму сосуда или растекаясь по поверхности. Частицы поверхностного слоя обладают избыточной энергией по сравнению с объемными частицами, поскольку часть химических связей у этих частиц не реализуется (отсутствует часть ближайших соседей). Минимум энергии системы в отсутствие силы тяжести будет соответствовать форме, при которой доля поверхностных частиц будет минимальной, поэтому жидкое вещество самопроизвольно примет сферическую форму.
Для перехода из одного состояния равновесия в соседнее частицам необходимо преодолеть энергетический барьер Еа, величина которого зависит от характера химической связи между частицами. Процесс подобен образованию собственных дефектов в кристалле.
Среднее время между переходами t называется временем «оседлой жизни» частиц. Оно зависит от природы жидкости, то есть характера химической связи между частицами, и быстро уменьшается с ростом температуры:
t = t0 exp( kEaT ) ,
где t0 10-12 c, k – константа Больцмана, Т – температура, К.
Для маловязких жидкостей время «оседлой жизни» частиц при комнатной температуре составляет величину 10-11 с. Поэтому поведение примесных частиц в жидкости, если их концентрация невелика (сильноразбавленные растворы), подчиняется законам идеального газа.
3.4.2.Жидкие кристаллы
Жидкие кристаллы – это состояние, в котором вещество обладает одновременно свойством текучести, как жидкость, и анизотропией некоторых физико-химических свойств, как кристалл вследствие упорядоченности расположения молекул. Таким свойством могут обладать вещества, состоящие из молекул, имеющих определенную удлиненную палочкообразную или дискообразную форму. Палочкообразную форму чаще всего имеют органические молекулы, представляющие собою цепочки с чередованием линейных и циклических атомных группировок. Такая форма позволяет образовывать упорядоченные структуры с приблизительно параллельным расположением молекул, что является основным
107
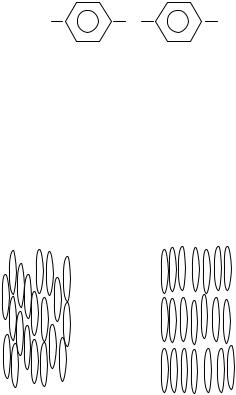
признаком жидких кристаллов.
Пример. В жидкокристаллическом состоянии могут находиться вещества, молекулы которых состоят из одного или нескольких бензольных колец с заместителями в пара-положениях (рис. 3.17).
X - -CH2- CH2; -CH=CH-; -CH=N-; ... |
Y,Z – R-; -CN; Cl-; Br-; -NO2; NH2; ... |
Рис. 3.17. Структурная формула молекул веществ, которыемогут находиться в жидкокристаллическом состоянии
По степени упорядоченности структуры можно выделить три типа жидких кристаллов. Наименее упорядоченную структуру имеют нематические жидкие кристаллы, молекулы которых параллельны, но сдвинуты относительно друг друга на произвольные расстояния. В смектических жидких кристаллах молекулы располагаются слоями. Холестерические жидкие кристаллы по своей структуре похожи на нематические, но в отличие от них молекулы дополнительно закручены в направлении, перпендикулярном их длинным осям (рис. 3.18).
Нематические Смектические
Рис. 3.18. Взаимноерасположениемолекул в нематическом и смектическом жидком кристаллах
Структура жидких кристаллов легко изменяется при нагревании, под воздействием электрического и магнитного поля, механических напряжений. При этом резко меняются физические свойства жидких кристаллов, особенно оптические свойства, в частности рассеяние света.
108
