
- •ОГЛАВЛЕНИЕ
- •Введение
- •Используемые единицы измерений и основные константы
- •1.1. Предпосылки возникновения волновой механики
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •1.2. Волновая (квантовая) механика
- •1.3. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •2.1. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (ВС)
- •2.2.3. Геометрия простейших молекул. Гибридизация АО
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.3. Полярность связи. Дипольный момент молекулы
- •3.1. Агрегатные состояния
- •3.3.1.Основные понятия о строении кристаллов
- •Библиографический список

газообразном состоянии при нормальных условиях (Р = 1,013 105 Па (Н/м2); Т = 273,15 К) молярный объем равен 22,4 л.
Абсолютная термодинамическая шкала температур (Кельвина)
T K = t oC + 273,15.
Стандартные термодинамические условия:
Р0 = 1,013 105 Па (Н/м2); Т0 = 298,15 К.
Элементарный электрический заряд е = 1,602 10-19 Кл. Электрон: масса m = 9,11 10-31 кг, заряд е = 1,60 10-19 Кл.
Скорость света в вакууме c = 2,9979 108 м/с.
Постоянная Планка h = 6,6262 10-34 Дж с, h = 2hπ =1,0546 10-34 Дж с.
Константа в законе Кулона k = 4πε1 0 = 8,99 10−9 (Н м/Кл).
Радиус первой боровской орбиты атома водорода r1 = 0,53Å. Энергия электрона атома водорода в основном состоянии Е1= –13,6 эВ. Постоянная Больцмана k = 1,381 10-23 Дж/К.
Универсальная газовая постоянная R = 8,314 Дж/моль К.
1 . СТРОЕНИЕ АТОМА
Химия – фундаментальная отрасль естествознания, наука о веществах и законах их превращения, при которых молекулы одного соединения обмениваются атомами с молекулами других соединений, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции, в результате которых образуются новые вещества. Атомы претерпевают в химических процессах некоторые изменения лишь в наружных электронных оболочках; ядро и внутренние оболочки при этом не изменяются, поэтому для курса химии теория строения атома есть в первую очередь рассмотрение способов описания состояния электронов в атоме (энергия и нахождение электрона в пространстве).
1.1.Предпосылки возникновения волновой механики
Кначалу XIX века окончательно утвердилось понятие, что атом представляет наименьшую частицу элемента, являющуюся носителем его свойств. Именно на анализе изменения свойств атомов был основан целый ряд таблиц элементов, а в 1869 г. Д. И. Менделеевым сформулирован Периодический закон.
Начиная с середины XIX века росло число экспериментальных фактов, свидетельствовавших прямо или косвенно о сложном характере строения атома.
7
Уильям Крукс (Crookes) и позднее Джозеф Томсон (Thomson) обнаружили катодные лучи – поток электронов, возникающий между двумя электродами в вакууме при приложении к ним разности потенциалов.
Анри Беккерель (Becquerel) открыл явление естественной радиоактивности солей урана (α-, β- и γ-излучение). Впоследствии было показано, что α-частицы представляют собой положительно заряженные ядра атомов гелия (+2), β-частицы – поток электронов, аналогичный катодным лучам Крукса, γ-излучение аналогично X-лучам Рентгена.
Спектры излучения не взаимодействующих друг с другом свободных атомов представляют собой серии линий (узких полос) с определенными длинами волн (или соответственно частот), характерными для каждого атома. Для атомов водорода спектр излучения наиболее прост и состоит из ряда серий (Лаймана, Бальмера, Пашена, Брэкетта, Пфунда) в видимой, УФ- и ИК-областях спектра. Причем была обнаружена эмпирическая формула зависимости, связывающейчастоты излучениялиниймеждусобой:
|
|
1 |
|
1 |
|
|
|
|
|
||||
ν = R |
|
− |
|
|
, |
|
|
n2 |
|||||
|
n2 |
|
|
|
||
|
|
1 |
|
2 |
|
|
где ν =1/λ волновое число (характеристика, обычно используемая в спектроскопии); ni = 1,2,3 ,... (целые числа); R = 109677,58 см-1 – постоянная величина (постоянная Ридберга).
Эрнест Резерфорд (Rutherford) экспериментально установил, что атом представляет собой систему, состоящую из малого по размеру положительно заряженного ядра, содержащего практически всю массу атома и расположенных вокруг него электронов, и предложил так называемую
планетарную модель атома.
Работы Генри Мозли (Moseley) по изучению характеристических рентгеновских спектров различных элементов позволили доказать, что порядковый номер элемента в Периодической системе совпадает с зарядом ядра атома.
Совокупность экспериментальных фактов свидетельствовала о том, что атом представляет собой сложную систему, состоящую из положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и отрицательно заряженных электронов, движущихся вокруг него.
Заряд ядра атома (выраженный в единицах элементарного электрического заряда) соответствует порядковому номеру элемента в Периодической таблице и, в силу электронейтральности атома, равен числу электронов в нем.
8
1.1.1.Корпускулярно-волновая природа электромагнитного излучения
Одной из наиболее спорных в истории естествознания была проблема природы лучистой энергии – электромагнитного излучения. Взгляды физиков на природу света (волна или поток частиц), начиная с Исаака Ньютона (Newton), периодически изменялись. К концу XIX века общепринятым считалось, что электромагнитное излучение имеет волновую природу. Однако к началу XX века встала проблема описания явления излучения света нагретыми телами. Не удавалось создать на основе классической электродинамики модель, объясняющую излучательную способность нагретых тел.
Для математического описания этого процесса Макс Планк (Planck) предложил гипотезу о квантовой природе процесса излучения (1900), согласно которой излучение энергии нагретым абсолютно черным телом происходит не непрерывно, как того требовала классическая теория, а дискретными порциями – квантами. Минимальная энергия – величина энергии кванта – пропорциональна частоте излучения:
E = hν,
где h = 6,6262 10-34 Дж с – постоянная Планка, ν – частота излучения, с-1. Альберт Эйнштейн (Einstein) высказал предположение о том, что идея квантования энергии относится не только к процессам поглощения и испускания света нагретыми телами, но и к излучению как таковому (1905). То есть электромагнитное излучение распространяется в виде дискретных частиц с энергией E = hν , названых впоследствии фотонами. Такие радикальные изменения во взглядах на природу света, предложенные Планком и Эйнштейном, нашли экспериментальное подтверждение в исследовании фотоэффекта – испускания электронов веществом под действием света. И особенно корпускулярные свойства электромагнитного излучения проявились в рассеянии рентгеновского излучения различными веществами – эффект Комптона (Compton), все особенности которого можно объяснить упругим столкновением фотонов рентгеновского излучения со сла-
босвязанными электронами.
Таким образом, поток электромагнитного излучения, с одной стороны, является волной, что наблюдается при интерференции и дифракции, а с другой стороны, – потоком частиц, что экспериментально проявляется в процессах испускания, поглощения и рассеяния излучения твердыми телами.
Используя выражение Планка для энергии кванта излучения и формулу Эйнштейна, показывающую взаимосвязь энергии частицы и ее массы (E = mc2), можно связать характеристики фотона (масса, импульс) и характеристики волны (длина волны и частота):
9

E = hν |
E = mc2 |
→ |
|
hν = mc2 |
|
ν = c/λ → hc/λ = mc2 |
→ |
m = h/cλ → λ = h/mc |
|||
p = m c |
→ |
|
λ = |
h |
; |
|
p |
||||
|
|
|
|
|
|
h = 6,6262 10-34 Дж с – постоянная Планка; ν – частота излучения, с-1; m – масса фотона, кг; c = 2,9979 108 м/с – скорость света в вакууме; λ – длина волны излучения, м; p – импульс фотона, Н/с.
1.1.2. Теория строения атома Бора
Первой теорией строения атома, использующей идеи квантования энергии и описывающей ряд экспериментальных фактов, в частности линейчатые спектры атомов, стала теория строения атома Нильса Бора
(Bohr).
Основным недостатком планетарной модели строения атома Резерфорда было ее противоречие теории классической электродинамики, которая утверждает, что, двигаясь по круговой орбите, электрон как заряженная частица должен непрерывно излучать энергию и "достаточно быстро упасть на ядро". Нильс Бор, разрабатывая теорию строения атома, пришел к выводу, что микрочастицы должны иметь иные свойства, чем макрообъекты, и классической электродинамики недостаточно для описания частиц атомного и субатомного размера. В своей теории описания движения электрона в атоме Нильс Бор использовал представления классической механики о движении заряженной частицы в электрическом поле, дополнив их идеями квантования энергии. При этом он выдвинул три постулата (постулат – утверждение в теории, принимаемое за истинное, хотя и недоказуемое в рамках этой теории).
Первый постулат. Существует ряд стационарных состояний атома, соответствующих определенным значениям его энергии. Электроны в атоме могут двигаться только по некоторым определенным устойчивым стационарным круговым орбитам. При движении по этим орбитам электроны не излучают энергию.
Второй постулат. При переходе с одной стационарной орбиты на другую электрон излучает или поглощает квант излучения, равный разности энергий стационарных состояний:
hν=E1–E2.
Третий постулат. В атоме существуют только такие электронные орбиты, находясь на которых электрон обладает моментом количества дви-
жения, кратным 2hπ часто вводят обозначение 2hπ = h ):
10
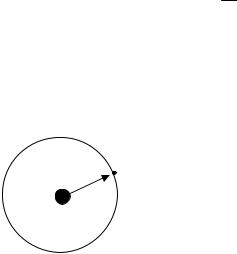
M = m v r = 2hπ n ,
где M – момент количества движения электрона; m = 9,11 10-31 кг – масса электрона; v – скорость электрона; r – радиус орбиты электрона; h – постоянная Планка; n = 1,2,3 ... – целое число, получившее название «кван-
товое число»
Используя эти постулаты, Нильс Бор рассчитал размеры стационарных орбит электронов в атоме, энергию электронов на стационарных орбитах и
выразил постоянную Ридберга через основные константы. |
|
|
||||||||||||||
|
|
|
|
|
|
Радиусы |
|
|
электронных |
|
орбит: |
|||||
|
|
|
|
|
|
F |
= k Ze2 – сила кулоновского притяже- |
|||||||||
|
|
|
|
|
−e |
пр |
|
r 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
+Ze |
r |
ния; k = 1/4πε0; Z |
– |
|
заряд |
ядра; |
|||||||||
|
|
|
|
|
|
ε0 = 8.85 10-12 Кл/Н м2 – |
электрическая по- |
|||||||||
|
|
|
|
|
|
стоянная; |
е = 1.6 10-19 |
Кл – |
единичный |
|||||||
|
|
|
|
|
|
электрический |
заряд |
(заряд |
электрона) |
|||||||
|
|
|
|
|
|
F |
= |
m v2 |
|
– |
центробежная |
сила; |
||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
цб |
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h2 |
|
|
|
|
|
F |
= F |
; |
mvr = n |
h |
– |
постулат Бора; |
|
r = |
|
|
n2 |
– |
радиусы |
|||
пр |
цб |
|
2π |
|
|
|
|
|
4π2Ze2k m |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
орбит электрона; n = 1,2,3... – квантовое число.
Радиус первой (n=1) стационарной орбиты электрона для атома водорода (Z=1) составляет величину:
r1 = h2/4π2e2mk = 5,29 10-11 м = 0,53 Å
и называется «радиус первой боровской орбиты». |
|
|
|
|
|
||||||||||||
Энергия |
|
|
электрона: E = Eп + Eк |
|
– |
полная |
энергия |
электрона; |
|||||||||
|
|
|
Ze2 |
|
|
|
|
Ze2 |
|
|
|
|
|||||
Eп = −k |
|
|
|
– потенциальная энергия электрона; Eк = k |
|
– кинетиче- |
|||||||||||
|
r |
|
2r |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
ская |
энергия электрона; E = −k |
Ze2 |
– |
полная |
энергия |
электрона; |
|||||||||||
2r |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
r = |
|
h2 |
|
|
|
n2 – радиус орбит электронов; E = − |
2π2Z 2e4k 2m |
|
1 |
. |
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
4π2Ze2km |
|
|
|
h2 |
|
|
n2 |
|||||||||
Электрон, находящийся на первой стационарной орбите (n=1) атома
водорода (Z=1), будет обладать энергией |
|
|||
E |
= − |
2π2e4k 2m |
= –2,17 10-18 |
Дж = – 13,6 эВ. |
|
||||
1 |
|
h2 |
|
|
|
|
|
|
|
11
Отрицательное значение энергии свидетельствует о том, что электрон связан с ядром и для его удаления из атома необходимо затратить энергию (потенциальная энергия электрона равна нулю на бесконечном удалении его от ядра). Чтобы перевести электрон на более удаленную стационарную орбиту, нужно затратить энергию. При переводе электрона на бесконечно большое расстояние от ядра необходимо затратить энергию, называемую энергией ионизации (Eи). Численное значение энергии электрона в основном состоянии совпадает с экспериментально определенным значением энергии ионизации. При переходе электрона с более удаленной стационарной орбиты на менее удаленную энергия выделяется в виде квантов электромагнитного излучения.
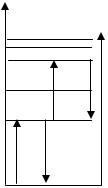
Необходимо отметить, что квантовое число n определяет в известном смысле энергию электрона и радиус орбит, по которым двигается электрон, обладающий соответствующей энергией. Набор стационарных орбит электрона может быть представлен в виде набора энергетических состояний (уровней) – рис. 1.1.
|
E |
|
n=∞ |
E=0 |
|
|
||
n=4 |
E4 |
|
n=3 |
E3 |
|
|
|
hν24 |
n=2 |
E2 |
|
E1= Eи = - 13,6 эВ
hν12
n=1 E1
Рис. 1.1. Диаграмма энергетических состояний электрона в атоме водорода: n – главное квантовое число; Еi – энергия электрона на i орбите; hνij=Ei-Ej – квант электромагнитного излучения
Теория Бора сыграла положительную роль, открыв дорогу квантовой механике. Основное ее достоинство заключалось в количественном описании линейчатых спектров простейших атомов. С усовершенствованием приборов и техники спектроскопии обнаружилось, что линии, принимавшиеся за единичные, в действительности состоят из нескольких близко расположенных друг к другу линий. Следовательно, для каждого квантового числа, скорее всего, существует несколько близких друг к другу энергетических уровней. Потребовалось введение дополнительных кван-
12
