
- •1.Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
- •2. Основные понятия термодинамики. Внутренняя энергия. Работа и теплота - две формы передачи энергии.
- •3 Типы термодинамических систем (изолированные, закрытые, открытые). Типы термодинамических процессов (изотермические, изобарные, изохорные). Стандартное состояние.
- •5. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Закон Гесса. Формулировка. Математическое выражение. Следствия из закона Гесса.
- •6.Второе начало термодинамики. Формулировка. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия как критерий возможности протекания самопроизвольных процессов.
- •13.Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков. Экспериментальные методы определения скорости и константы скорости реакций.
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •16. Катализ. Положительный и отрицательный катализ. Гомогенный и гетерогенный катализ Энергетический профиль каталитической реакции.
- •17. Ферментативный катализ. Особенности каталитической активности ферментов. Уравнение Михаэлиса - Ментен и его анализ.
- •18. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя.Автопротолиз воды. Константа автопротолиза воды.
- •2.3. Автопротолиз воды
- •19.Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий, на растворимость. Термодинамика растворения. Понятие об идеальном растворе.
- •20. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита. Закон разбавления Оствальда.
- •21 .Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля и следствия из него: понижение температуры замерзания раствора, повышение температуры кипения раствора.
- •25 Основные положения теории кислот и оснований Бренстеда- Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара. Амфолиты.
- •26. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя.
- •27.Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория жмко).
- •30.Буферное действие - основной механизм протолитического гомеостаза организма.Буферные системы, буферные растворы, их состав. Классификация буферных систем.
- •Буферные растворы
- •Буферные системы организма.
- •32.Расчет рН протолитических систем. Вывод уравнения Гендерсона- Гассельбаха и его анализ. Зона буферного действия.
- •34.Буферные системы крови: фосфатная буферная система. Состав, механизм действия, биологическая роль.
- •35.Буферные системы крови: гемоглобиновая буферная система. Состав, механизм действия, биологическая роль
- •36.Буферные системы крови: протеиновая буферная система. Состав, механизм действия, биологическая роль.
- •Применение реакции нейтрализации в фармакотерапии.
- •39.Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальций-фосфатного буфера.
- •41. Комплексные соединения. Их строение на основе координационной теории а. Вернера. Комплексный ион, его заряд. Катионные, анионные, нейтральные комплексы. Номенклатура, примеры.
- •42.Реакции замещения лигандов. Константа нестойкости комплексного иона, константа устойчивости.
- •44. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
- •Константа равновесия.
- •48.Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий. Общие представления о механизме действия редокс-буферных систем.
- •51.Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. Поверхностная активность, положительная и отрицательная адсорбция.
- •57.Молекулярно-кинетические свойства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление, седиментационное Фарадея-Тиндаля. Уравнение Рэлея, его анализ.
- •58.Электрокинетические свойства: электрофорез и электроосмос; потенциал течения и потенциал седиментации. Биологическое значение.
- •60.Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •62.Коллоидные пав; биологически важные коллоидные пав (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах пав. Определение критической концентрации мицеллообразования. Липосомы.
- •63.Высокомолекулярные вещества (вмв). Классификация. Структура. Форма
- •64.Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул. Механизм набухания и растворения вмс. Зависимости величины набухания от различных факторов.
25 Основные положения теории кислот и оснований Бренстеда- Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара. Амфолиты.
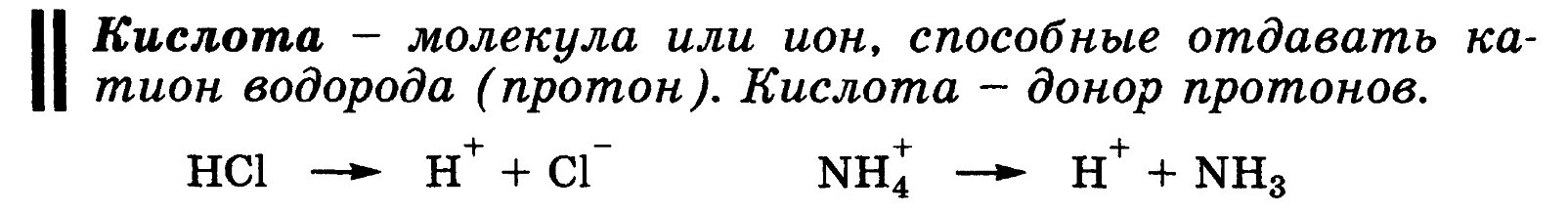
Сила
кислоты определяется ее способностью
отдавать протон, т.е сильная кислота -
активный донор протона.
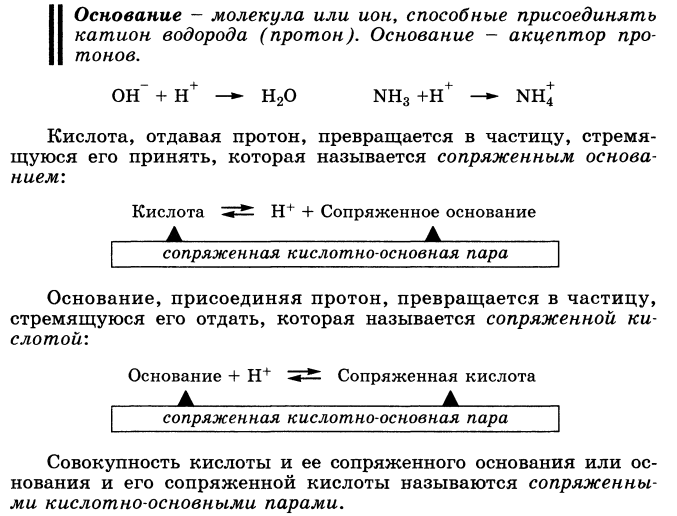
Сила основания
определяется его способностью принимать
протон, т.е сильное основание - активный
акцептор протона.


Для удобства оценки характера водной среды используют водородный показатель pH. Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода. pH=-lg[H+] Иногда используют гидроксильный показатель pOH. В нейтральной среде водородный показатель =7, в кислой он меньше 7 а в щелочной – больше. Для определения кислотности среды используют индикаторный или ионометрический метод.
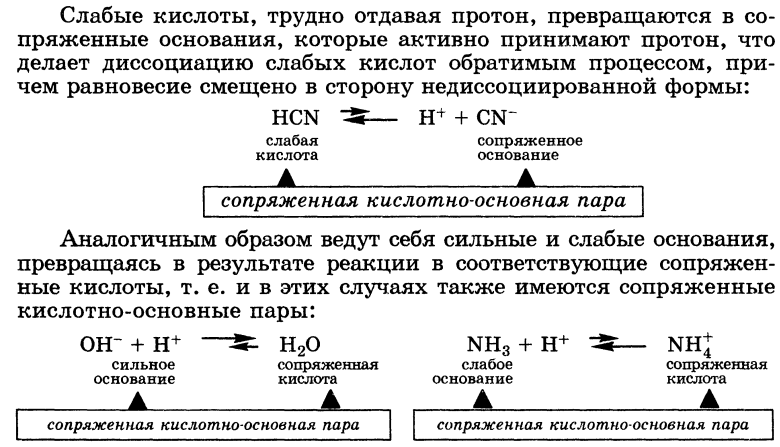
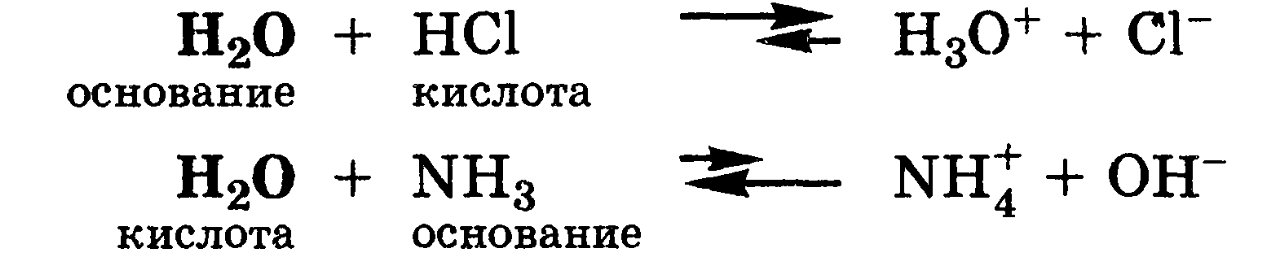
Некоторые вещества в одних реакциях способны вступать в роли донора протона, а в других - в роли акцептора протона. Такие вещества называют амфолитами.

Типичным
амфолитом является вода:
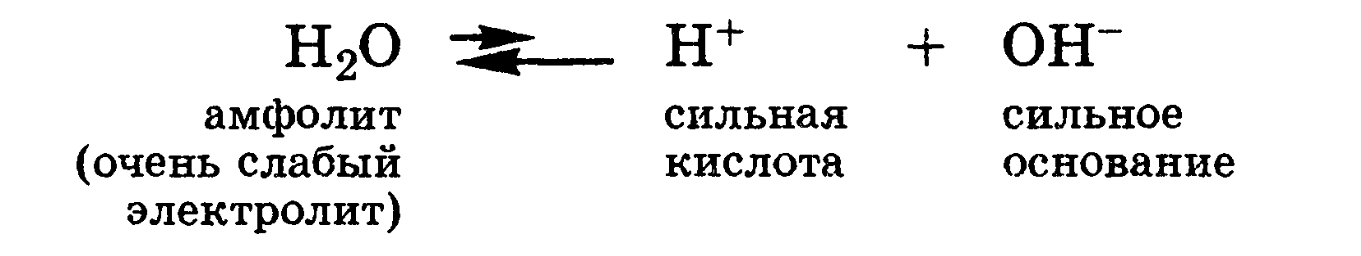
Вода
взаимодействует и с кислотами, выступая
в роли основания, и с основаниями,
выступая в роли кислот:
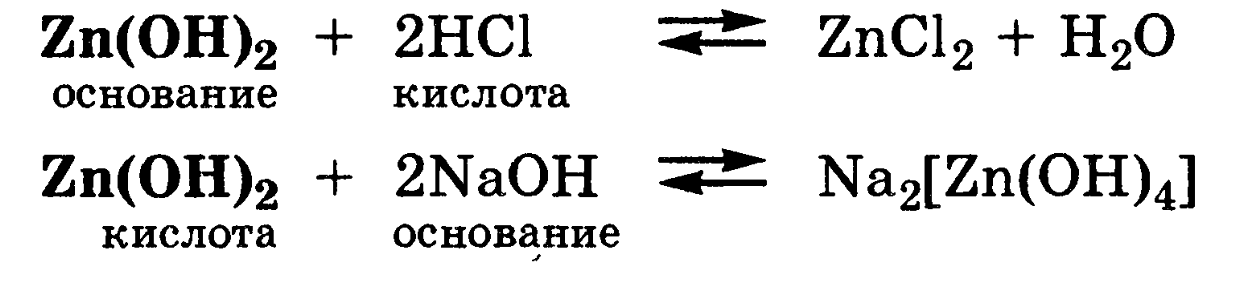
Амфолитами
являются также гидроксиды некоторых
металлов и гидроанионы некоторых
многоосновных кислот:
![]()
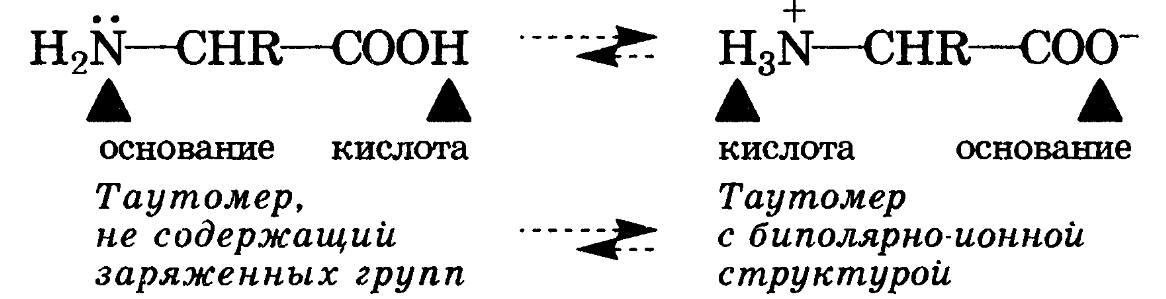
Амфолитами также являются соединения, молекулы которых две различные кислотно-основные группы:
26. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя.

В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.

ИОННОЕ
ПРОИЗВЕДЕНИЕ ВОДЫ.
Вода является очень
слабым электролитом.
Ее диссоциация
выглядит так:
![]() Константа
последнего равновесия равна:
Константа
последнего равновесия равна:
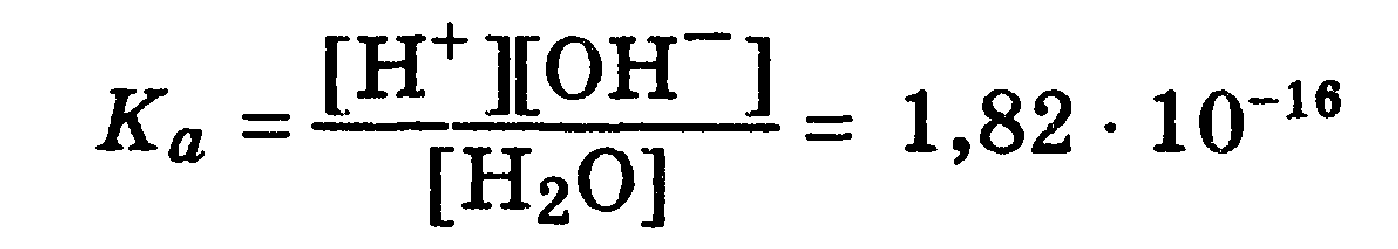
Отсюда:
![]()
 Постоянство
ионного произведения воды означает,
что в любом водном растворе-нейтральном,
кисломилищелочном-имеются и водородные
ионы, и гидроксид-ионы.
Постоянство
ионного произведения воды означает,
что в любом водном растворе-нейтральном,
кисломилищелочном-имеются и водородные
ионы, и гидроксид-ионы.


27.Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория жмко).

Кислота Льюиса – любое хим.соединение , молекула ,ион , являющийся акцептором электронной пары и таким образом способное принимать пару электронов соединения донора (основания Льюиса ) на незаполненную орбиталь с образованием соединения аддукта .
Основание Льюиса – основанием считается любая частица (атом , молекула или анион ) способная отдавать электронную пару для образования ковалентной связи . Т.е по Льюису кислота является акцептором пары электронов , а основание -донором .
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания.
Кислота Льюиса— молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны приниматьэлектронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода,спирты, галогены.
Примеры химических реакций между кислотами и основаниями Льюиса:
![]()
![]()
![]()
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь, на которую переходит электронная пара, у жёстких кислот имеет низкую энергию. Соответственно, жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Их орбиталь, с которой отдаётся электронная пара, также имеет низкую энергию.
Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Как у мягких кислот, так и у мягких оснований энергия орбиталей, участвующих в реакции высока. Поскольку такие свойства как заряд, электроотрицательность и поляризуемость изменяются плавно, существует ряд кислот и оснований Льюиса, которые занимают промежуточное положение между жёсткими и мягкими.
Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера.
28.
Ионизация слабых кислот и оснований.
Константа кислотности и основности.
Связь между константой кислотности и
константой основности в сопряженной
протолитической паре. Амфолиты.
Изоэлектрическая точка.






29.Протолитические
реакции. Типы протолитических реакции
(нейтрализации, гидролиза, ионизации).
Примеры. Конкуренция за протон:
изолированное и совмещенное протолитические
равновесия. Общая константа совмещенного
протолитического равновесия.











. Реакции нейтрализации:H2CO3+H2O=HCO3+H3O кислота +основание = с.о +с.к
1)между слабыми электролитами NH3+CH3COOH=NH4+ +CH3COO-
2) слабыми и сильнымиNH3+H3O+(кислота) = NH4+ + H2O(основание)
3)сильнымиH3O(кислота)+OH=H2O+H2O
Реакции ионизации:
CH3COOH + H2O(основание) ↔ H3O+(кислота) + CH3COO-
