
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
Межмолекулярное взаимодействие
Природа межмолекулярного взаимодействия электромагнитная. Различают следующие варианты связывания молекул друг с другом:
– с образованием ковалентной связи(по донорно-акцепторному или обменному механизму; последний реализуется между молекулами–радикалами);
– связывание без обобществления электронов, за счет так называемых сил Ван-дер-Ваальса: ориентационного, индукционного и дисперсионного взаимодействий;
– образование водородных связей.
Ориентационноевзаимодействие (рисунок 3.13) возможно междуполярными молекулами, например галогеноводородов, аммиака, оксида серы(IV) и др.: при ориентации диполей относительно друг друга противоположно заряженными концами они связываются за счет электростатического притяжения. Чем полярнее молекулы, тем больше диполь-дипольное взаимодействие между ними.

Рисунок 3.13 – Схема взаимодействия двух полярных молекул
Индукционноевзаимодействие (рисунок 3.14) реализуется между полярной и неполярной молекулой, по механизму диполь-наведенный (индуцированный) диполь. Под действием полярной молекулы симметричная вначале электронная оболочка неполярной молекулы деформируется, и индуцированный диполь притягивается к диполю полярной молекулы. Примером такого взаимодействия может быть растворение в воде, молекулы которой полярные, неполярных молекул углекислого газа. Индукционное взаимодействие тем больше, чем более полярна одна из молекул и чем легче деформируется электронная оболочка неполярной молекулы.

Рисунок 3.14 – Схема взаимодействия между полярной и неполярной молекулами
Дисперсионноевзаимодействие возникаетмежду неполярнымимолекулами за счет того, что в результате колебательного теплового движения электронной оболочки относительно ядер на короткое время образуются «мгновенные» диполи, взаимодействующие друг с другом. Из всех электростатических межмолекулярных взаимодействий дисперсионные – самые слабые; однако благодаря им оказывается возможным (при очень низких температурах) сжижение водорода, кислорода, азота, инертных газов. Дисперсионное взаимодействие тем больше, чем подвижнее электронная оболочка молекул. Так, в молекулярном азоте при тройной ковалентной связи между атомами электронная оболочка более «жесткая» по сравнению с молекулярным кислородом (связь двойная). Вследствие этого дисперсионное взаимодействие между молекуламиN2более слабое, и поэтому жидкий азот кипит при более низкой температуре, чем жидкий кислород. Эту особенность следует иметь в виду при работе с жидким азотом, т.к. в нем может конденсироваться кислород из воздуха.
Особенность водородной связи(рисунок 3.15) обусловлена уникальностью атома водорода – единственного атома, имеющего только один электрон. При связывании водорода с сильно электроотрицательными атомами его очень малый по размерам положительно поляризованный ион способен глубоко внедряться в электронные оболочки других атомов. Водородная связь весьма распространена и играет важную роль в процессах ассоциации, растворения, образования кристаллогидратов и др. Именно водородной связью обусловлены «аномальные» свойства воды (температура кипения, структура жидкой и кристаллической воды). Ассоциацией молекулHFза счет водородных связей объясняется наличие кислых солей «одноосновной» плавиковой кислоты, напримерKHF2.
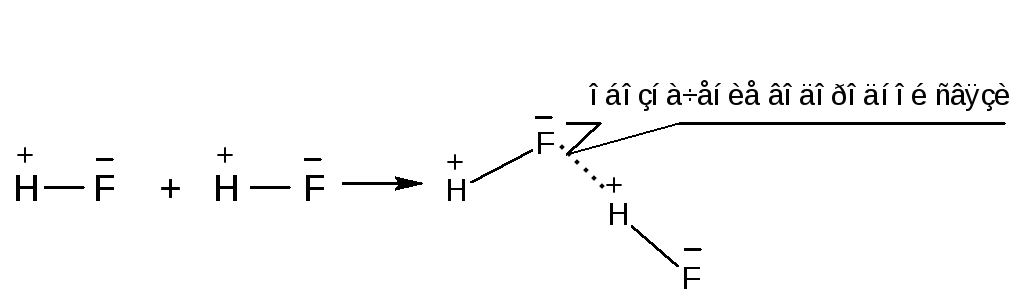
Рисунок 3.15 – Схема образования водородной связи между молекулами фтороводорода
Межмолекулярная ковалентная связьпо донорно-акцепторномумеханизмуобразуется в случае, если атомы одной молекулы имеют неподеленные электронные пары, а атомы другой – вакантные валентные орбитали. Примером таких соединений могут бытьAlCl3.NH3,BF3.NH3и др. Межмолекулярные связи в этих соединениях образуются за счетдонорных свойствазотав молекуле аммиака иакцепторныхсвойств атомовалюминияилиборав молекулах их галогенидов.
Образование ковалентноймежмолекулярной связипо обменномумеханизму встречается редко, т.к. молекулярные радикалы, как правило, нестабильны. Примерами относительно стабильных молекулярных радикалов могут быть оксиды азота,NOиNO2. Наличием у них неспаренных электронов объясняется возможность их димеризации (и, как следствие – особенностями кинетики реакций с их участием, см. тему 5).
Энергия ван-дер-ваальсова взаимодействия в сравнении с ковалентной связью гораздо слабее. Так, если для разрыва связи между атомами в молекуле I–Iтребуется 148,8 кДж/моль, то энергия разрыва межмолекулярных связей при сублимации (возгонке) кристаллического иода равна 62,4 кДж/моль.
