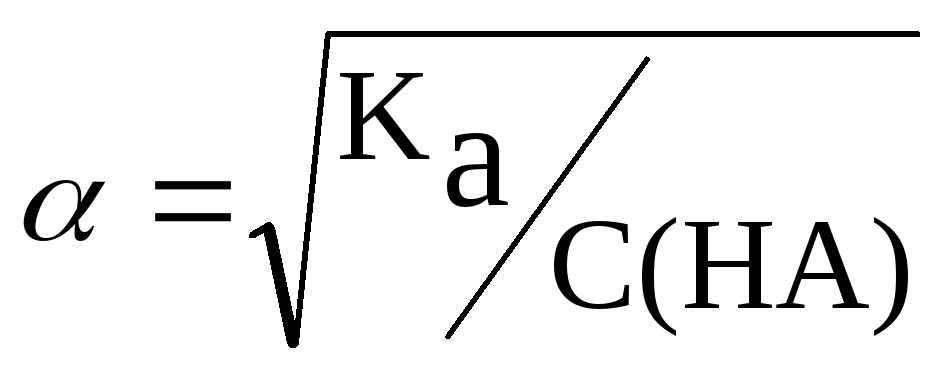- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
6 Растворы электролитов. Электролитическая диссоциация.
Буферные растворы
6.1 Электролитическая диссоциация
Законы Рауля и Вант-Гоффа, описывающие свойства идеальных растворов (температуру их кипения, замерзания и др. см. тему «Общие свойства растворов»), оказались для растворов одних веществ вполне удовлетворительными моделями их реальных свойств, для других веществ расчетные и экспериментальные свойства заметно различались.
Для согласования расчетных и экспериментальных данных по осмосу Вант-Гофф ввел коэффициент, названный изотоническим коэффициентом (i):
|
|
(6.1.1) |
Т.е., если рассчитанную величину осмотического давления (Росм. теор.) умножить наi, то получим реальную, измеренную величину (Росм. эксп.).
С. Аррениус, сопоставив расчетные и экспериментальные данные по другим коллигативным свойствам одних и тех же растворов, установил, что коэффициенты, подобные i, для них примерно одинаковы:
![]()
![]()
![]()
![]() i
i
В таком случае логично было предположить, что причина несоответствия рассчитанных и экспериментальных величин – одна и та же.
Было установлено, что для одних растворов i1 (т.е. такие растворы по свойствам близки к идеальным растворам). Для других растворовi< 1, что можно объяснить ассоциацией (связыванием) частиц растворенного вещества. Наибольшее удивление вызвали растворы, для которых изотонический коэффициент был больше единицы, нередко в несколько раз. Каким образом количество растворенного вещества оказалось большим, чем его растворили?
Объяснение могло быть только одно:
частицы некоторых веществ (молекулы
или др.) при растворении не только
распределяются среди молекул растворителя,
но и распадаются на более мелкие частицы
(диссоциируют). В результате общее число
частиц (Nобщее)
увеличивается по сравнению с числом
растворенных (N0).
По этой причине реальные свойства
растворов (![]() Ткип,
Росм.и др.) оказываются большими
по сравнению с рассчитанными. По-видимому,
изотонический коэффициент и показывает,
во сколько раз число частиц в растворе
(Nобщее) отличается
от того, которое растворили (N0),
т.е.i=Nобщее/N0.
Ткип,
Росм.и др.) оказываются большими
по сравнению с рассчитанными. По-видимому,
изотонический коэффициент и показывает,
во сколько раз число частиц в растворе
(Nобщее) отличается
от того, которое растворили (N0),
т.е.i=Nобщее/N0.
Как оказалось, растворы, для которых i> 1, объединяет еще одно общее свойство – они электропроводны.
Теория электролитической диссоциации Аррениуса(окончательный вариант – 1887 г.) включала три основных положения:
1) В растворах электролитов происходит самопроизвольный распад – диссоциация молекул на ионы, в результате чего раствор становится электропроводным;
2) Осмотическое давление, температуры кипения и замерзания растворов зависят не только от аналитической концентрации электролита, но и от степени его диссоциации (α). Степень диссоциации – это отношение числа частиц растворенного вещества, которые продиссоциировали (Nдис), к исходному числу частиц растворенного вещества (No):
|
α = Nдис/No |
(6.1.2) |
3) Для одного и того же растворенного вещества степень диссоциации увеличивается по мере разбавления раствора.
Поскольку свойства растворов зависят от концентрации растворенных частиц, а она, в свою очередь, зависит от степени диссоциации растворенного вещества, то, по-видимому, должна быть связь между степенью диссоциации электролита и изотоническим коэффициентом.
Действительно, если растворили N0молекул вещества, и степень его диссоциации α, то продиссоциируют αN0молекул. Если каждая молекула при диссоциации образуетzионов, то всего образуетсяzαN0ионов. Недиссоциированными останутся (N0– αN0) молекул. В результате в растворе окажется в виде молекул и ионов растворенного вещества (Nобщее):
Nобщее= (N0– αN0) +zαN0 =N0(1 + αz– α).
Подставив это выражение в уравнение (6.1.1), получим:
![]() , откуда α
=
, откуда α
=![]()
Например, если имеется раствор бинарного электролита (т.е. z= 2), и для него определилиI= 1,2; то степень диссоциации этого электролита:
α = (1,2 – 1)/(2 – 1) = 0,2 (или 20 %).
Сильный электролит диссоциирует полностью и для него α = 1.
Изотонический коэффициент для сильного электролита показывает число ионов, на которые он диссоциирует:
HCl H+ + Cl– i = 2
Ca(NO3)2 Ca2+ + 2NO3– i = 3
Факторы, влияющие на электролитическую диссоциацию веществ.
Природа растворенного вещества
К электролитам относятся вещества с ионной кристаллической решеткой и вещества, состоящие из молекул с полярной или легко поляризуемой связью.
К сильным электролитам относятся большинство солей, гидроксиды щелочных и щелочноземельных металлов, а также некоторые кислоты: галогеноводородные (кроме HF), азотная, хлорная, хлорноватая, серная и др. (подробнее см. далее).
Влияние природы растворителя на диссоциацию электролитов
Источник энергии, необходимой для разрыва химических связей в растворяемом веществе – это взаимодействие растворяемого вещества с растворителем. Одни и те же вещества проявляют свойства сильных электролитов в одних растворителях и слабых – в других. Так, например, в воде хлороводород – сильный электролит, а в бензоле – слабый. Гидроксиды щелочных металлов полностью диссоциируют в воде, но различаются по силе в спиртовых растворах.
Чаще всего наибольшая степень диссоциации проявляется в растворителях с большой диэлектрической проницаемостью (ε), высокой сольватирующей способностью и малой вязкостью. К таким растворителям в первую очередь относится вода.
Влияние температуры на диссоциацию электролитов
«Диссоциация» сопровождается разрывом химических связей (ионных или ковалентных), что требует энергетических затрат, и поэтому увеличение температуры должно способствовать диссоциации, что в большинстве случаев и наблюдается.
На самом деле ситуация более сложная. Ионы – продукты диссоциации электролита – в результате ионно-молекулярного взаимодействия могут образовывать ассоциаты с растворителем (рисунок 6.1.1).

Рисунок 6.1.1 – Схема растворения (гидратации) хлорида калия
Образование сольватов – процесс экзотермический, поэтому при увеличении температуры сольваты разрушаются.
6.2 Диссоциация (ионизация) сильных электролитов
Сильные электролиты в растворах диссоциируют практически полностью (не подчиняются закону действующих масс), что отражают соответствующим знаком «» в уравнении реакции (односторонний процесс, нет равновесия):
Ca(OH)2 Ca2+ + 2OH–
Cr2(SO4)32Cr3++ 3SO42–
H2SO42H++SO42–
Концентрацию ионов в растворах сильных электролитов рассчитывают по уравнениям их диссоциации как для реакций, протекающих необратимо:
KatxAyxKatY++yAx–
В этом уравнении KatxAy– структурная (формульная) единица электролита, аKatY+,Ax–– его катион и анион,x,y– число катионов и анионов соответственно в формульной единице электролита.
Пример 1
Рассчитать концентрацию, моль/л, продуктов диссоциации
в 0,1 М растворе серной кислоты.
Решение: уравнение диссоциации H2SO42H++SO42–
Из уравнения видно, что при диссоциации 1 моль H2SO4 образуются
2 моль ионов водорода и 1 моль сульфат-ионов; следовательно,
С(H+) = 2∙С(H2SO4) = 0,1·2 = 0,2 моль/л, С(SO42–) =C(H2SO4) = 0,1 моль/л
Пример 2
Рассчитать концентрацию, моль/л, сульфата хрома(III) и ионовCr3+, если молярная концентрация ионовSO42–равна 0,6 моль/л.
Решение: уравнение диссоциацииCr2(SO4)32Cr3++ 3SO42–
Из уравнения видно, что при диссоциации 1 моль Cr2(SO4)3 образуются 2 моль ионов хрома и 3 моль сульфат-ионов.
Следовательно, С(Cr2(SO4)3)
=![]() С(SO42–)
=
С(SO42–)
=![]() 0,6
= 0,2 моль/л;
0,6
= 0,2 моль/л;
С(Cr3+) = 2∙С(Cr2(SO4)3)
=
![]() 0,2
= 0,4 моль/л.
0,2
= 0,4 моль/л.
6.3 Диссоциация слабых электролитов. Константа диссоциации.
Степень диссоциации
Электролиты, которые диссоциируют не полностью, называют слабыми. При их диссоциации устанавливается равновесие между ионами – продуктами диссоциации и нераспавшимися молекулами (или сложными ионами), подчиняющееся закону действующих масс (см. тему «Химическое равновесие»). Эту особенность отражают в уравнении соответствующим знаком «» – равновесный процесс:
HAH++A–Kдис.=![]() (6.2)
(6.2)
Константу равновесия диссоциации слабого электролита называют константой диссоциации.
Константа диссоциации количественно характеризует силу электролита: чем слабее электролит, тем меньше константа диссоциации.
Для слабых кислот константу принято обозначать Ка(от англ. «acid» кислота), а для слабых оснований –Kb (от англ. «base» – основание).
Примеры
Диссоциация плавиковой кислоты: HFH++F–
Ka
=
![]()
Диссоциация аммиака в водном растворе: NH3·H2O NH4+ + OH–
Kb
=

Слабые многоосновные кислоты, HxA, и многокислотные основания, Me(OH)x, диссоциируют ступенчато.
Каждая ступень диссоциации характеризуется своей константой.
Например, в растворе ортофосфорной кислоты устанавливаются следующие равновесия.
Первая ступень диссоциации:
H3PO4 H+ + H2PO4–

Вторая ступень диссоциации:
H2PO4– H+ + HPO42–

Третья ступень диссоциации:
HPO42– H+ + PO43–

Константы диссоциации слабых электролитов приводятся в справочниках (одновременно это проверка, к сильным или слабым относится электролит: если слабый, то его константа, меньшая единицы, приведена в справочнике).
6.4 Расчет материального баланса в реакциях диссоциации слабых
электролитов. Электролитическая диссоциация воды; pH и pOH водных растворов
Уравнение диссоциации воды H2OH++OH–
Константа равновесия (константа диссоциации воды):
|
|
(6.3.1) |
Из величины константы видно, что степень диссоциации воды очень мала, и поэтому можно считать, что [H2O]C(H2O) = 1000/18 = 55,6 моль/л.
Тогда постоянной величиной (константой) можно считать
KH2O [H2O] KH2O ∙C(H2O) [H+][OH–] 1,8·10–16·55,6 1·10–14
Произведение [H+][OH–] назвалиионным произведением воды и обозначилиKw:
|
Kw = [H+][OH–] = 1·10–14 |
(6.3.2) |
Из ионного произведения воды следует, что в воде и водных растворах любых веществ произведение равновесных молярных концентраций ионов H+ и OH– – величина постоянная (при постоянстве температуры) и называется ионным произведением воды (закон действующих масс применительно к диссоциации воды). При 298 К (25 0С) Kw = 1·10–14.
В чистой воде [H+] =
[OH–] =![]() 10–7 моль/л. В растворах кислот
[H+] > [OH–],
т.е. [H+] > 10–7моль/л, [OH–] < 10–7моль/л.
10–7 моль/л. В растворах кислот
[H+] > [OH–],
т.е. [H+] > 10–7моль/л, [OH–] < 10–7моль/л.
Примеры
1) Рассчитать концентрацию, моль/л, ионов [H+] и [OH–] в 0,1 М растворе серной кислоты.
Решение: H2SO42H++SO42–
Из уравнения реакции видно, что концентрация ионов H+в 2 раза больше концентрации кислоты, т.е. С(H+) = 0,1·2 = 0,2 моль/л (ионамиH+из воды можно пренебречь).
Концентрацию ионов OH–, рассчитаем из ионного произведения воды:Kw = [H+][OH–] = 1·10–14: [OH–] = 1·10–14/0,2 = 5·10–14моль/л.
2) Рассчитать концентрацию, моль/л, ионов [H+] и [OH–] в 0,1 М растворе гидроксида калия.
Решение: KOHK++OH–
Из уравнения реакции видно, концентрация ионов OH–равна концентрации щелочи, т.е. С(OH–) = С(КОН) = 0,1 моль/л.
Концентрацию ионов H+рассчитаем из ионного произведения воды:
Kw = [H+][OH–] = 1·10–14: [H+]= 1·10–14/0,1 = 1·10–13моль/л.
Как видно из приведенных примеров, концентрация ионов H+иOH–может меняться в очень широких пределах. По этой причине в расчетах удобнее использовать не концентрации, а их логарифмы (lg).
Прологарифмировав уравнение (6.4.2), получим:
lgKw=lg[H+] +lg[OH–] = –14
Умножим левую и правую части полученного уравнения на (–1):
–lgKw = – lg[H+] – lg[OH–] = 14
Математическое действие «– lg» обозначим значком «p», и в результате получимлогарифмическую форму ионного произведения воды:
|
pKw = pH + pOH = 14 |
(6.3.3) |
В уравнении (6.3.3) pH – отрицательный десятичный логарифм молярной концентрации ионов водорода:
|
pH = – lg[H+] |
(6.3.4) |
pOH – отрицательный десятичный логарифм молярной концентрации гидроксид-ионов водорода:
|
pOH = – lg[OH–] |
(6.3.5) |
pKw– отрицательный десятичный логарифм ионного произведения воды:
pKw = – lgKw
В чистой воде
[H+] = [OH–], поэтому –lg[H+] = –lg[OH–] и соответственно
pH = pOH = pKw/2 = 14/2 = 7
В растворах кислот [H+] > [OH–], поэтомуpH <7, pOH > 7.
В растворах оснований[H+] < [OH–], поэтомуpH >7, pOH < 7.
Пример1
Рассчитать pHиpOHв 0,15 М растворах:
а) серной кислоты
Решение: H2SO42H++SO42–
C(H+) = 2C(H2SO4) = 0,15·2 = 0,3 моль/л; pH = – lgС(H+) = 0,3 = 0,52;
pOH = 14 – 0,52 = 13,48.
б) 0,15 М гидроксида калия
Решение: KOHK++OH–
С(OH–) = С(KOH) = 0,15;pOH= 0,82;pH= 14 – 0,82 = 13,18.
Диссоциация слабых одноосновных кислот и однокислотных оснований
HAH++A– ![]()
Пример 2
Рассчитать равновесную концентрацию ионов и недиссоциированных молекул в растворе кислоты концентрации С(HA), моль/л, имеющей константу диссоциацииК.
Решение: из уравнения диссоциации видно, что
[H+] = [A], и [HA] = С(HA) – Сдис.(HA) = С(HA) – [H+].
Тогда выражение константы преобразуется
в следующее:  или
[H+]2+K[H+]
–KC(HA) = 0
или
[H+]2+K[H+]
–KC(HA) = 0
Решая это уравнение, определим [H+], [A–] и [HA], моль/л.
Довольно часто полученное расчетное
уравнение можно упростить: если электролит
очень слабый, то [H+]
<< С(HA), и величиной [H+]
в знаменателе можно пренебречь. Тогда
получим: , откуда
, откуда
|
[H+] = [A–]
=
|
(6.3.6) |
Эти уравнения применимы для расчетов
в тех случаях, когда
![]() 10–2.
10–2.
Пример 3
Рассчитать концентрацию продуктов диссоциации и pHв 0,15 М растворе кислоты, имеющей константу диссоциации Ка= 5·10–7.
Решение: HAH++A– ![]() = 5·10–7
= 5·10–7
Проверим, выполняется ли условие
![]() 10–2:
10–2:
![]() 6,6·10–7 < 10–2, т.е. условие
выполняется, и расчет можно вести по
упрощенным формулам:
6,6·10–7 < 10–2, т.е. условие
выполняется, и расчет можно вести по
упрощенным формулам: ,
,
[H+]
= [A–]
=
![]() =
=
![]() = 1,07·10–4
моль/л
= 1,07·10–4
моль/л
pH = – lg[H+] = – lg(1,07·10–4) = – lg1,07 – lg10–4 = 3,97.
Пример 4
Рассчитать концентрацию продуктов диссоциации и pHв 0,15 М растворе основания (KatOH), имеющего константу диссоциации Кb= 3·10–9.
Решение: KatOHKat++OH–
![]() =
3·10–9
=
3·10–9
Проверим, выполняется ли условие
![]() 10–2:
10–2:
![]() 210–8 <
10–2, т.е. условие выполняется, и
расчет можно вести по упрощенным
формулам:
210–8 <
10–2, т.е. условие выполняется, и
расчет можно вести по упрощенным
формулам:![]() и
и
[Kat+] = [OH–]
=
![]() =
=![]() =2,12·10–5моль/л
=2,12·10–5моль/л
pOH=–lg[OH–] =–lg(2,12·10–5) = 4,68
pH= 14 –pOH= 14 – 3,68 = 10,32.
6.5 Диссоциация слабых многоосновных кислот
Пример
Рассчитать концентрации продуктов диссоциации в 0,1 М растворе фосфорной кислоты (K1 = 7,5·10–3, K2 = 6,3·10–8, K3 = 1,3·10–12).
Уравнения диссоциации:

H3PO4 H+ + H2PO4–
H2PO4– H+ + HPO42–


HPO42– H+ + PO43–
Как следует из уравнений диссоциации, в растворе имеются недиссоциированные молекулы H3PO4, а также ионы (в порядке уменьшения их концентраций): H+, H2PO4–, HPO42–, PO43–.
Полный расчет материального баланса для сопряженных равновесий довольно сложен. В то же время для практических задач его часто можно упростить. Дело в том, что если константы ступенчатой диссоциации различаются на 4 порядка и более (что в нашем примере выполняется), то концентрацию ионов H+ можно рассчитывать с учетом только первой ступени диссоциации, как для одноосновной кислоты (см. пример 2). На том же основании можно не учитывать уменьшение концентрации ионов H2PO4– за счет их диссоциации по второй ступени, т.е. можно принять, что [H+] [H2PO4–]. На основании этого получим исходное расчетное уравнение для первой ступени диссоциации:

В
отличие от примера, рассмотренного
ранее, в данном случае не выполняется
условие
![]() 10–2,
и поэтому необходимо решать полное
квадратное уравнение, выведенное из
константы равновесия:
10–2,
и поэтому необходимо решать полное
квадратное уравнение, выведенное из
константы равновесия:
[H+]2 + K[H+] – KC(HA) = [H+]2 + 7,5·10–3·[H+] – 7,5·10–4 = 0, откуда
[H+] = [H2PO4–] = 0,024 моль/л.
Подставим полученные величины в константу диссоциации по второй ступени:

В числителе и знаменателе дроби оказались равные величины
[H+] = [H2PO4–], из чего следует, что [HPO42–] = K2 = 6·10–8 моль/л.
Таким образом, равновесная молярная концентрация двухзарядных анионов слабой многоосновной кислоты равна второй константе диссоциации.
Еще раз подчеркнем, что последний вывод справедлив при условии, что константы ступенчатой диссоциации различаются не менее чем на четыре порядка (для большинства неорганических кислот – сернистой, сероводородной, угольной и др. – это условие выполняется).
Наконец, из константы диссоциации по третьей ступени рассчитаем равновесную молярную концентрацию фосфат-ионов:

[PO43–] = 5·10-13·6·10–8/0,024 = 1,25·10–18 моль/л.
Степень диссоциации слабых электролитов
Степень диссоциации (α) показывает, какая часть электролита продиссоциировала:
|
α = Nдис./Nнач. = nдис./nнач. = Сдис./Снач. |
(6.4.1) |
Для расчета степени диссоциации слабой кислоты HAH++A–
в растворе с концентрацией Снач= С(HA) можем записать, что Сдис= α ∙ С(HA).
Учитывая, что Сдис.= [H+] = [A–], получим: Сдис.= [H+] = [A–] = α∙ С(HA).
Подставив эти обозначения в выражение константы диссоциации, получим следующее уравнение для расчета степени диссоциации:
![]() =
=![]()
![]()
![]() .
.
Если α << 1, то в полученном уравнении можно считать, что (1 – α) 1;
тогда Ka= α2С(HA), и
|
|
(6.4.2) |
Таким образом, степень диссоциации слабого электролита обратно пропорциональна корню квадратному из его концентрации. Зависимость (6.4.2) была выведена Оствальдом и носит его имя –закон разбавления Оствальда.
Закон разбавления можно вывести также
из ранее полученного уравнения [H+]
=![]() ,
подставив в него [H+]
= α∙C(HA),
получим то же уравнение (6.4.2):
,
подставив в него [H+]
= α∙C(HA),
получим то же уравнение (6.4.2):
α =
 =
=
Аналогичные уравнения можно вывести
для степени диссоциации слабого
основания. Отличие будет только в том,
что вместо константы диссоциации кислоты
(Ка) в уравнении будет константа
основания (Kb).
Еще раз отметим, что упрощенный расчет
допустим при условии, что α << 1 (при![]() 10–2); при невыполнении этого
условия решается полное квадратное
уравнение.
10–2); при невыполнении этого
условия решается полное квадратное
уравнение.
6.7 Смещение равновесий диссоциации слабых электролитов (влияние одноименных ионов на диссоциацию)
В соответствии с принципом Ле Шателье равновесие диссоциации слабой кислоты HAH++A– можно изменить, если изменить температуру или концентрации веществ, участвующих в равновесии.
Диссоциация – процесс эндотермический, поэтому при увеличениитемпературыравновесие сместится вправо(степень диссоциации и концентрация ионов в растворе увеличивается); при охлаждении раствора равновесие сместится в обратном направлении.
При увеличении концентрации кислотыравновесие сместится в прямомнаправлении(концентрация ионов в растворе увеличится, но степень диссоциации уменьшится – см. закон разбавления Оствальда).
Если в раствор добавить сильную кислоту, увеличив тем самым концентрацию ионов H+, то равновесие сместится влево (степень диссоциации и концентрация анионовA–уменьшатся, но концентрация ионовH+будет большей, чем до добавления сильной кислоты).
Если в раствор добавить растворимую соль слабой кислоты (KatA), увеличив тем самым концентрацию анионовA–, то равновесие сместится в сторону их связывания, т.е. влево (степень диссоциации и концентрация ионовH+уменьшатся, а концентрация анионовA–будет больше, чем до прибавления соли).
Пример 1.В 0,1 М раствор кислоты, имеющей константу диссоциации Ка= 2·10–7, добавили соляную кислоту, С(HCl) = 0,5 моль/л. Рассчитать степень диссоциации слабой кислоты в полученном растворе и егоpH.
Решение:HAH++A–HClH++Cl–
1) После добавления сильной кислоты диссоциация слабой кислоты будет подавлена, и концентрацией ее «собственных» ионов водорода можно пренебречь, считая, что в полученном растворе С(H+) = С(HCl) = 0,5 моль/л.
Тогда pH= –lgС(H+) = –lg0,5 = 0,3.
2) Вследствие того, что ионы водорода в растворе, в основном, из соляной кислоты, их концентрация теперь не может быть показателем степени диссоциации слабой кислоты – это отражает только концентрация ее анионов A–. Последнюю можно рассчитать через константу диссоциации, с учетом того, что [H+] = С(HCl) и [HA]С(HA):
![]() =
2·10–7 [A–]
= 2·10-7·0,1/0,5 = 4·10–8 моль/л
=
2·10–7 [A–]
= 2·10-7·0,1/0,5 = 4·10–8 моль/л
Тогда степень диссоциации кислоты α = [A–]/С(HA) = 4·10–8/0,1 = 4·10–7.
Буферные растворы
«Буферными» называют системы и устройства, смягчающие внешние воздействия на систему, устройства и т.д. Вспомните буферные устройства между железнодорожными вагонами; бамперы автомобилей – те же буферы; «буферные зоны» при международных конфликтах и т. д.
Буферными называютрастворы, при добавлении к которым кислот или щелочей ихpHменяется незначительно. Механизм буферного действия основан на том, что в состав раствора входят анионы слабых кислот или (и) катионы слабых оснований, способные превращать сильные кислоты или основания в слабые. В соответствии с изложенным выше буферными свойствами обладают:
а) растворы, содержащие слабые кислоты (HA) и их соли (KatA) – кислотные буферные растворы: HA H+ + A– KatA Kat+ + A–
Если в такой раствор добавить, например, соляную кислоту
HClH++Cl–, то ее ионы водорода будут связывать анионы соли,образуя слабуюкислоту (HA):H++A– HA.
Если в раствор добавить, например, гидроксид натрия NaOHNa++OH–, то гидроксид-ионы свяжутся ионами водорода кислоты,образуя воду: HA+OH– H2O+A–
б) растворы, содержащие слабые основаня (KatOH) и их соли (KatA) – основные буферные растворы:
KatOH Kat+ + OH– KatA Kat+ + A–
Если в такой раствор добавить, например соляную кислоту
HClH++Cl–, то ее ионы водорода будут связывать гидроксид-ионы основания,образуя воду:KatOH + H+ H2O + Kat+