
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
10.3 Составление уравнений овр методом электронного баланса
При написании уравнений ОВР используют два метода расстановки коэффициентов: метод электронного баланса (окислительных чисел) и метод полуреакций (ионно-молекулярный метод).
В методе электронного баланса сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуются правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Метод электронного баланса рассмотрим на примере реакции

Для расстановки коэффициентов выполняем следующие действия.
1. Определяем элементы, атомы которых изменяют степень окисления:

2. Находим окислитель и восстановитель в данной ОВР и пишем отдельно электронные уравнения процессов окисления и восстановления:


3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс):

4. Коэффициенты 5 и 2 из электронных уравнений переносим в молекулярное уравнение ОВР:

5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения:

Составление уравнений ОВР методом полуреакций
Mетод полуреакций основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Этот метод используется для записи ОВР, протекающих в водных растворах.
Следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение его восстановителем происходит по-разному в кислой, нейтральной и щелочной средах в соответствии со следующими правилами:
1) если исходные вещества полуреакции содержат больше атомов кислорода, чем продукты реакции, то в кислых растворах кислород связывается протонами водорода в воду, а в нейтральных и в щелочных средах молекулами воды в гидроксид-ионы:
O2-+2H+ = H 2O
O2-+HOH = 2OH-
2) если исходные вещества полуреакции содержат меньше атомов кислорода, чем образующие, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных за счет гидроксид-ионов:
H2O = O2-+2H+
2OH- = O2-+ H2O
Используем метод полуреакций для записи реакции взаимодействия сульфита натрия с перманганатом калия в кислой среде.
Для расстановки коэффициентов выполняем следующие действия.
1. Записываем полное ионно-молекулярное уравнение реакции. При этом, сильные электролиты записываем в виде ионов, а слабые электролиты, газы и малорастворимые вещества – в виде молекул:

2. Записываем полуреакции окисления и восстановления, уравниваем число атомов кислорода и водорода, алгебраическую сумму зарядов слева и справа в полуреакциях.

Чтобы связать 4 моль атомов кислорода, требуется 8 моль атомов водорода (процесс идет в кислой среде):

Уравниваем алгебраическую сумму зарядов слева и справа с помощью определенного числа электронов, которые участвуют в процессе:


Чтобы получить 1 моль атомов кислорода для окисления SO32-до SO42-, требуется 1 моль молекул H2O (процесс идет в кислой среде):

Уравниваем алгебраическую сумму зарядов слева и справа:

3. Уравниваем число электронов в полуреакциях окисления и восстановления с помощью дополнительных коэффициентов (как в методе электронного баланса). С учетом этих коэффициентов записывают сокращенное ионно-молекулярное уравнение ОВР:

4. Записываем молекулярное уравнение ОВР:

Метод полуреакций позволяет определить все продукты окислительно-восстановительной реакции.
Составим уравнения реакций взаимодействия сульфита натрия Nа2SO4 с перманганатом калия КМпО4 в нейтральной и щелочной среде.
В нейтральной среде:


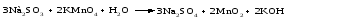
В щелочной среде:


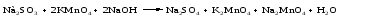
Лекция 11
Вопросы
11.1 Типичные окислители и восстановители
11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
