
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
Тема 4. Основные положения химической кинетики
Лекция 6
Вопросы
6.1 Понятие скорости химической реакции
6.2 Факторы, влияющие на скорость химической реакции
6.3 Химическое равновесие
6.4 Смещение химического равновесия. Принцип Ле-Шателье
Понятие скорости химической реакции
Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакций. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени. При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время – в секундах [с], поэтому размерность скорости реакции равна [моль/л·с].
Рассмотрим реакцию взаимодействия водорода с парами йода:

Обозначим концентрацию паров йода в начале некоторого отрезка времени t1 через C1, а при t2 через C2. Так как йод в процессе реакции расходуется, то C1>C2. Скорость реакции может быть найдена из равенства
 (1)
(1)
По мере расходования исходных веществ скорость реакции уменьшается (рис. 6.1). Поэтому говорят о скорости реакции в данный момент времени (истинная скорость), которая выражается производной от концентрации во времени:
 (2)
(2)
Производная берется со знаком минус, если C ‒ концентрация исходного вещества (C убывает), и со знаком плюс, если C ‒ концентрация продукта реакции (C возрастает).

Рисунок 6.1 – Изменение концентрации реагирующего вещества во времени
Факторы, влияющие на скорость химической реакции
Скорость реакции зависит от природы реагирующих веществ, их концентрации и внешних условий (температуры, давления, присутствия катализатора).
6.2.1 Зависимость скорости реакции от природы реагирующих веществ
В зависимости от природы реагирующих веществ реакции могут протекать как очень медленно (некоторые реакции между органическими веществами, многие реакции с участием твердых веществ, как, например, коррозия металлов), так и очень быстро (ионные реакции в растворах). В промежуточном случае скорость реакции может быть такой, что ее нетрудно измерять в ходе короткого опыта.
Зависимость скорости реакции от природы веществ очень сложна, она связана с их составом и строением. Химический процесс всегда представляет собой некоторую перегруппировку атомов, т. е. их обмен местами, разъединение или, наоборот, объединение отдельных атомов или молекул в более сложные. Совершенно естественно, что подобные процессы могут развертываться лишь при достаточно тесном сближении молекул реагентов. А на этот процесс в значительной степени влияет состав и строение реагирующих веществ.
6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
Необходимым условием того, чтобы между частицами исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ – продуктов реакции. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ.
Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентрации реагирующих веществ.
Чтобы исследовать зависимость скорости реакции от концентрации реагирующих веществ, рассмотрим гомогенную реакцию (реагирующие вещества находятся в одном агрегатном состоянии), протекающую по уравнению
А + В → АВ
Для
ее осуществления необходимо, чтобы
молекулы А и В в некоторый момент времени
оказались в каком-то элементе объема,
имеющем «молекулярные размеры», т.е.
столкнулись. Вероятность того, что
молекула А окажется в этом элементе
объема ( ),
пропорциональна количеству молекул А
в единице объема, т.е. их концентрации:
),
пропорциональна количеству молекул А
в единице объема, т.е. их концентрации:
 ~
~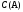 (3)
(3)
Подобным же образом вероятность того, что молекула В окажется в том же элементе объема, пропорциональна концентрации молекул В:
 ~
~ (4)
(4)
Вероятность одновременного осуществления двух независимых событий равна произведению вероятностей каждого из событий. Следовательно, вероятность того, что и молекула А, и молекула В окажутся в одном и том же элементе объема:
 ~
~ (5)
(5)
Соответственно и скорость реакции будет пропорциональна произведению концентраций веществ А и В, т.е.
 ,
(6)
,
(6)
где k – коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости реакции постоянная для данной химической реакции величина, которая зависит от химической природы реагирующих веществ, температуры и катализатора, но не зависит от концентраций реагирующих веществ. Она равна той скорости, с которой должна совершаться реакция, если концентрация каждого из реагирующих веществ равна 1 моль/л.
Если химический процесс осуществляется в ходе одновременного столкновения двух частиц А и одной частицы В, то легко показать с помощью рассуждений, аналогичных приведенным выше, что
 (7)
(7)
Уравнение, описывающее зависимость скорости реакции от концентрации реагирующих веществ, называется кинетическим уравнением реакции. Для гомогенной реакции с участием а молекул вещества А и b молекул вещества В: аА + bВ → cАВ оно имеет вид
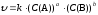 (8)
(8)
Таким образом, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, численно равными коэффициентам в уравнении реакции.
Сумма показателей степени в кинетическом уравнении реакции называется порядком реакции (п). Различают суммарный порядок реакции (т. е. сумма показателей степени в кинетическом уравнении) и частные порядки по какому-либо из реагентов, т. е. показатели степени при концентрации данного вещества в кинетическом уравнении.
Если сумма показателей степени в кинетическом уравнении составляет единицу, то реакцию называют реакцией первого порядка, если она равна двум ‒ реакцией второго порядка и т.д. Порядок реакции может быть нулевым и дробным.
Если реакция имеет нулевой порядок, то скорость реакции не зависит от концентрации реагента:
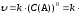 (9)
(9)
Для гетерогенных реакций (реагирующие вещества находятся в разных агрегатных состояниях, например, т–ж, т–г), протекающих на границе раздела фаз, концентрация твердого вещества, реагирующего с газом или раствором, остается постоянной, поэтому в кинетическое уравнение концентрация твердых веществ не включается. Так, для реакции

кинетическое уравнение имеет вид
 (10)
(10)
