
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
Тема 2. Химическая связь
Лекция 3
Вопросы
Общие представления о химической связи. Первые теории химической связи
Квантово-механическая теория химической связи
Основные характеристики и свойства химической связи
Общие представления о химической связи. Первые теории химической связи
Учение о химической связи – центральная проблема современной химии. Только установив, какова природа химической связи, за счет каких сил атомы соединяются в молекулы, можно объяснить устойчивость тех или иных соединений, обосновать их строение, реакционную способность и свойства.
Химической связью называют совокупность взаимодействий атомов, приводящую к образованию устойчивых систем (молекул, кристаллов, комплексов и т.д.).
Первые попытки создания теории химической связи относятся к началу 19 века. Берман и Бертолле предложили гравитационную теорию химической связи, согласно которой взаимодействие частиц связывалось с силами всемирного тяготения. Однако свойства сил тяготения – пропорциональность массе, действие на любых расстояниях – не подтверждались при образовании химической связи.
Берцелиус выдвинул электрохимическую теорию химической связи, согласно которой каждый атом состоит из двух полюсов (положительного и отрицательного), причем преобладает у каждого атома какой-то один полюс. За счет электростатического взаимодействия полюсов противоположной полярности атомы связываются между собой. Данная теория не объясняла существование прочных молекул, состоящих из одинаковых по полярности атомов.
В 1915 г. немецкий ученый Коссель предложил первую научную теорию ионной связи. В основу своей теории Коссель положил представление об особой устойчивости электронов в атомах инертных газов. Коссель считал, что инертные газы не обладают способностью к образованию химической связи, т.к. имеют стабильные и энергетически устойчивые электронные группировки (1s2 у гелия и ns2 np6 у других инертных газов). Атомы других элементов, вступая во взаимодействие, стремятся образовать стабильную электронную структуру ближайшего инертного газа. Одним атомам это удается путем потери электронов, другим – путем присоединения.
Например, при взаимодействии калия и фтора атом калия отдает свой валентный электрон атому фтора и превращается в положительный однозарядный ион с электронной конфигурацией инертного газа аргона. Атом фтора, присоединяя электрон, превращается в отрицательный однозарядный ион с электронной конфигурацией инертного газа неона. Разноименно заряженные ионы стягиваются силами электростатического притяжения, образуя ионную молекулу фторида калия.
Эта теория применима лишь в ограниченном кругу соединений с противоположной электроотрицательностью, под которой понимают способность атома притягивать к себе электроны, участвующие в образовании химической связи. Существует огромное число соединений, состоящих из двух и более атомов с одинаковой или близкой электроотрицательностью, которые не укладываются в рамки теории Косселя.
В 1916 г. Льюис выдвинул положение об образовании химической связи за счет общих электронных пар – теорию парно-электронной связи. Согласно этой теории тенденция атомов достроить свой внешний электронный слой может быть реализована путем обобществления нескольких электронов путем образования общих электронных пар, дополняя число электронов во внешнем слое до двух или восьми. Химическая связь, возникшая за счет обобществления электронов, получила название ковалентной.
Теория Льюиса являлась более универсальной, т.к. обобществлять электроны могли атомы как с противоположной, так и с одинаковой электроотрицательностью. Однако причины спаривания электронов при образовании химической связи оставались неясными, ведь электроны имеют одинаковый заряд и должны отталкиваться.
Квантово-механическая теория химической связи
Новым этапом в развитии теории химической связи явилось создание квантово-механической теории химической связи. Квантовая механика распространяет закономерности микромира, установленные для атомов, на более сложную систему – молекулу. Описание химической связи в молекуле есть, по существу, описание распределения в ней электронной плотности.
Существует два приближенных метода описания распределения электронной плотности: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Метод ВС основан на представлениях Гейтлера и Лондона. Этот метод базируется на следующих основных положениях:
каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар, расположенных на валентных орбиталях;
общая электронная пара устойчива благодаря тому, что электроны имеют противоположно направленные спины;
при образовании связи происходит перекрывание электронных облаков, ведущее к увеличению электронной плотности между атомами и уменьшению общей энергии системы;
связь образуется в том направлении, при котором возможно максимальное перекрывание электронных облаков.
В данном методе валентность рассматривается как возможность атома образовывать химические связи с другими атомами. Валентность в определенной мере зависит от числа неспаренных электронов, расположенных на валентных орбиталях атома. Так, водород имеет один неспаренный электрон на 1s-энергетическом подуровне, и, следовательно, одновалентен. Гелий имеет на 1s-энергетическом подуровне два спаренных электрона, поэтому не вступает в химические реакции и имеет нулевую валентность.
Однако валентность может и не совпадать с числом неспаренных электронов в основном состоянии атома. Число неспаренных электронов увеличивается при возбуждении атома. Возбуждение атома требует затраты энергии на распад двухэлектронных орбиталей на одноэлектронные. Возбуждение атома возможно лишь в том случае, когда затрата энергии на возбуждение окупается энергией, выделяемой при образовании химической связи.
Например, в основном состоянии атомы бериллия не имеют неспаренных электронов. Переход одного электрона с 2s на 2р-орбиталь (в пределах одного энергетического уровня) требует затраты 259 кДж/моль энергии, которая компенсируется при образовании атомом бериллия двух связей с другими атомами.
|
↑↓ |
|
|
|
|
|
↑ |
|
↑ |
|
|
|
2s |
|
|
2p |
|
2s |
|
|
2p |
|
Для атома гелия переход одного электрона с 1s на 2s-орбиталь (на другой энергетический уровень) требует затрата энергии 1672 кДж/моль энергии, которая не компенсируется при образовании атомом связей с другими атомами. Поэтому гелий и не образует химических соединений.
Для атома бора характерно не одновалентное, а трехвалентное состояние:
|
↑↓ |
|
↑ |
|
|
|
↑ |
|
↑ |
↑ |
|
|
2s |
|
|
2p |
|
2s |
|
|
2p |
|
У атома углерода в основном состоянии имеется два неспаренных электрона, но в органических соединениях углерод четырехвалентен:
|
↑↓ |
|
↑ |
↑ |
|
|
↑ |
|
↑ |
↑ |
↑ |
|
2s |
|
|
2p |
|
2s |
|
|
2p |
|
Элемент третьего периода хлор может иметь один, три, пять и семь валентных электронов. Для перехода из одновалентного (3s23p5) в семивалентное (3s13p33d3) надо перевести один 3s и два 3p-электрона на 3d-подуровень.
Таким образом:
возбуждение электронов в обычных химических реакциях происходит только в пределах данного энергетического уровня и не сопровождается изменением главного квантового числа;
получаемые при возбуждении электроны являются совершенно равноправными с точки зрения энергии образуемых ими связей, они переходят на особый гибридный подуровень, вследствие чего сами переходы s→p, p→d называются гибридизацией, а образующиеся электронные облака, валентности и соответствующие им химические связи – гибридными.
Более универсальным квантово-механическим методом описания химической связи является метод МО, идея которого развита в трудах Хунда, Леннарда-Джонса и Малликена.
Теория рассматривает молекулу как единое целое, каждый электрон принадлежит молекуле в целом и движется в поле всех ее ядер и электронов. Если в атоме каждому электрону соответствует своя атомная орбиталь, то в молекуле каждый электрон находится на своей молекулярной орбитали, характеризуемой определенным набором квантовых чисел. Молекулярные орбитали, в отличие от атомных, являются многоцентровыми, т.к. охватывают не менее двух ядер. Образование молекулярной орбитали можно упрощенно рассматривать как линейную комбинацию атомных орбиталей.
Основные характеристики и свойства химической связи
Основными характеристиками химической связи являются длина связи между атомами и энергия связи.
Согласно современным представлениям, химическая связь осуществляется электронами, энергия связи которых с ядром атома имеет тот же порядок величины, что и энергия химической связи.
Электроны, участвующие в образовании химической связи, называются валентными электронами.
У s- и p-элементов валентными являются электроны внешнего энергетического уровня, у d- и f-элементов – электроны внешнего энергетического и недостроенного предвнешнего уровней.
Силы, вызывающие образование химической связи, имеют электростатическое происхождение.
Химическая связь возникает только в том случае, если при сближении атомов полная энергия системы понижается, т.е. энергия системы двух атомов, связанных химической связью, ниже энергии системы тех же атомов, не связанных между собой. Понижение энергии происходит вследствие перекрывания электронных облаков неспаренных электронов, принадлежащих двум соединяющимся атомам. Чем больше перекрывание, тем больше понижение энергии системы.
Мерой прочности химической связи между атомами А и В служит энергия связи ЕА-В, которая выделяется при образовании химической связи между двумя атомами. На рисунке 3.1 энергия связи соответствует точке А.
Энергия связи численно равна энергии, которую нужно затратить на разрыв данной связи, поэтому энергия связи – главная характеристика, являющаяся мерой прочности связи. Чем больше энергия связи, тем прочнее данная связь.

Рисунок 3.1 – Зависимость потенциальной энергии Е от расстояния между ядрами r для молекулы Н2
Длина связи – это среднее расстояние между центрами связанных между собой атомов. Это расстояние соответствует минимуму энергии системы. Из сопоставления величины орбитального радиуса атома водорода (0,053 нм) и длины связи в молекуле (0,074 нм) видно, что при образовании химической связи (H − H) происходит частичное перекрывание орбиталей атомов водорода. А поскольку химическую связь можно представить как стягивание ядер атомов повышенной электронной плотностью в области перекрывания орбиталей, то (в соответствии с законом Кулона) чем меньше длина связи (т.е. меньше атомные радиусы) и больше заряды ядер, тем прочнее связь.
Свойствами химической связи являются ее полярность, поляризуемость и направленность.
Полярность связи – это степень смещения электронной плотности к одному из атомов.
Если молекула образована двумя атомами с близкими значениями электроотрицательности, то распределение отрицательного заряда общего электронного облака более или менее симметрично. В предельном случае, если молекула образована двумя одинаковыми атомами, то отрицательный заряд электронов распределяется между ними поровну. В этом случае возникающая в молекуле связь неполярна. Если соединяются два атома с различными значениями электроотрицательности, то облако отрицательного заряда общей электронной пары смещается в сторону более электроотрицательного атома, а образующаяся связь является полярной. Это смещение тем значительнее, чем больше разность электроотрицательности элементов, образующих связь. При прочих равных условиях, чем больше полярность связи, тем больше ее энергия и, следовательно, меньше длина.
Поляризуемость связи – это способность связи перераспределять электронную плотность между атомами под действием соседних групп атомов или окружающей среды.
Например, связь в молекуле хлорида водорода под действием диполей воды поляризуется до полной диссоциации HCl , т. е. распада молекул на ионы. В то же время HF, несмотря на большую полярность связи, диссоциирует в воде лишь частично вследствие слабой поляризуемости связи из-за малого радиуса фтора.
Если мы рассматриваем молекулу, состоящую из трех и более атомов, возникает вопрос о расположении атомов в пространстве, т.е. о направленности связей. Связи возникают по направлениям, по которым осуществляется максимальное перекрывание электронных облаков атомов, участвующих в образовании связи. Отсюда следует, что форма молекул должна определяться формой и ориентацией этих электронных облаков.
Лекция 4
Вопросы
Типы химических связей и их свойства
Типы химических связей и их свойства
Различают следующие типы химических связей: ковалентная, ионная, металлическая и водородная.
Наиболее распространенный тип связи – ковалентная связь.
Ковалентная связь образуется парой или несколькими парами электронов, обобществляемых между двумя соседними атомами.
Под «общей электронной парой» подразумевается сгусток электронной плотности, образующийся между двумя атомами в результате перекрывания электронных облаков принадлежавших им неспаренных электронов.
При этом образование общей электронной пары может осуществляться по двум механизмам:
1) обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
2) донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой – вакантную орбиталь, на которой она может разместиться.
Рассмотрим пример обменного механизма – образование двухатомной молекулы хлороводорода. Атомы водорода и хлора имеют следующие электронные конфигурации:
Н: 1s1;
Сl: 1s12s22p63s23p5
При этом валентные электроны распределяются по орбиталям следующим образом:
|
H |
|
|
|
|
|
Cl |
|
|
|
|
↑ |
|
|
|
|
↑↓ |
|
↑↓ |
↑↓ |
↑ |
|
1s |
|
|
|
|
3s |
|
|
3p |
|
Таким образом, и у водорода, и у хлора имеется по одному неспаренному электрону. Наличие на внешних орбиталях как неспаренных, так и спаренных электронов, т. е. двух электронов с противоположно направленными спинами, можно изобразить следующим образом:

Тогда образование из атомов водорода и хлора молекул НС1 можно изобразить следующей схемой:

На схеме общая для обоих соединяющихся атомов электронная пара обозначена двумя точками между символами элементов. Электронные пары, не используемые атомами для образования связи, обозначены парами точек около символа соответствующего элемента; такие электронные пары называют неподеленными. Этот способ изображения электронного строения молекул называют электронными формулами.
Рассмотрим пример донорно-акцепторного механизма образования ковалентной связи. Он характерен для взаимодействия частиц, одна из которых имеет пару электронов (А), другая – свободную орбиталь (В):
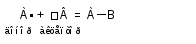
Частица, предоставляющая для связи двухэлектронное облако, называется донором; частица со свободной орбиталью, принимающая эту электронную пару, называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого называется донорно-акцепторным.
Рассмотрим валентные возможности атома бора. Это элемент 2-го периода, и следовательно, его валентные электроны распределяются по четырем орбиталям внешнего слоя: одной 2s- и трем 2р-:

Поскольку у бора имеются энергетически близкие свободные 2р-орбитали, при возбуждении этот элемент может приобрести новую электронную конфигурацию:

В соответствии с числом непарных электронов атом В может образовать три ковалентные связи, например, с атомами водорода:

Атом бора имеет свободную орбиталь, поэтому в молекуле ВН3 имеется дефицит электронов.
Простейший донор электронной пары – гидрид-ион Н-. Присоединение отрицательного гидрид-иона к молекуле ВН3 приводит к образованию сложного (комплексного) иона ВН4- с отрицательным зарядом:

Ковалентная связь может быть полярной и неполярной.
Если молекула образована двумя атомами с близкими значениями электроотрицательности, то распределение отрицательного заряда общего электронного облака более или менее симметрично. В предельном случае, если молекула образована двумя одинаковыми атомами, то отрицательный заряд электронов распределяется между ними поровну. В этом случае возникающая в молекуле связь неполярна. Если соединяются два атома с различными значениями электроотрицательности, то облако отрицательного заряда общей электронной пары смещается в сторону более электроотрицательного атома, а образующаяся связь является полярной.
Атомы могут быть связаны между собой более чем одной электронной парой. Число электронных пар, связывающих два атома, называется кратностью связи между этими атомами. Простой (ординарной) связи соответствует одна общая электронная пара, двойной или тройной связи – соответственно две или три общие электронные пары:
|
|
|
|
В зависимости от способа перекрывания и симметрии образующегося облака различают σ-(сигма), π-(пи) и δ-(дельта) связи (рисунок 4.1).
σ-связь осуществляется при перекрывании облаков вдоль линии соединения атомов.
π -связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов.
δ-связь обязана перекрыванию всех четырех лопастей d-электронных облаков, расположенных в параллельных плоскостях.
Электроны s-орбиталей могут участвовать лишь в σ-связывании, р-электроны – уже в σ- и π-связывании, а d-электроны – как в σ- и π-, так и в δ-связывании. Для f-орбиталей способы перекрывания еще разнообразнее.
|
|
|
|
|
s-s |
p-p |
p-p |
|
|
|
|
|
|
|
|
|
d-d |
d-d |
d-d |
Рисунок 4.1 – Виды связей
Ионная связь – предельный случай ковалентной полярной связи. Если соединяются элементы, электроотрицательность которых сильно различается, то валентный электрон (или электроны) электроположительного атома полностью переходит к электроотрицательному атому, в результате чего атомы превращаются в заряженные частицы – ионы. Атом, отдавший электроны, превращается в положительный ион (катион), атом, принявший электроны, – в отрицательный ион (анион). Связь при этом будет осуществляться за счет взаимного притяжения противоположно заряженных ионов.
Ионная связь – связь, образующаяся между атомами, электроотрицательность которых сильно различается.
Как правило, ионные связи образуют между собой элементы начала и конца периодов таблицы Менделеева. Это объясняется тем, что различные атомы в различной степени способны принимать на свои орбиты электроны. Элементы седьмой группы, имеющие на внешней орбите семь электронов, легко принимают один электрон, недостающий до полного октета. Элементы же первой группы имеют на внешней орбите всего один электрон, который они легко отдают. Примером может быть образование хлорида натрия. Атом электроположительного элемента натрия, характеризующегося сравнительно невысокой энергией ионизации, легко теряет внешний электрон. Атом электроотрицательного элемента хлора, обладающего значительным сродством к электрону, напротив, способен принять на внешний электронный уровень дополнительный электрон. За счет электростатического притяжения между ионами возникает ионная связь.

Характерными свойствами ионной связи являются: ненасыщаемость, ненаправленность и поляризуемость.
Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, сила притяжения зависит только от зарядов ионов и расстояния между ними. Иначе говоря, ионная связь характеризуется ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей (рисунок 4.2).

Рисунок 4.2 – Распределение электрических силовых полей двух разноименных ионов
В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям.
К одному иону может притягиваться любое число ионов противоположного знака. Следовательно, ионная связь характеризуется ненасыщаемостью. Вместе с тем число ионов противоположного знака, которое может окружить данный ион, не безгранично. Оно определяется равновесием между силами их притяжения и отталкивания. Чаще всего энергетически оказывается выгодно, когда ион окружен числом ионов противоположного знака в количестве 6 или 8.
Очень важным свойством ионной связи является ее поляризуемость.
Поляризуемость ионов – способность электронной оболочки ионов к деформации.
Поляризующее действие – способность ионов деформировать, поляризовать другой ион.
Поляризуемость и поляризующее действие ионов приводит к тому, что ионная молекула превращается в полярную ковалентную. Это происходит следующим образом. Обычно у катиона преобладает поляризующее действие, он способен оттягивать избыточную электронную плотность от аниона, деформировать его. У анионов преобладает поляризуемость, их электронная оболочка легко деформируется. Чем меньше радиус катиона и больше его заряд, тем большим поляризующим действием он обладает. Чем больше радиус аниона и больше его заряд, тем легче он деформируется.
Ионная связь наиболее характерна для неорганических соединений. Отличительными чертами ионных соединений являются: мгновенность протекания реакций, диссоциация в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов и расплавов.
Отметим, что, если чисто ковалентная связь осуществима практически (в решетке алмаза, в молекуле водорода), то ионная связь в чистом виде не встречается, т.к. величина потенциала ионизации атома даже наименее электроотрицательного элемента – Cs – больше, чем значение сродства к электрону у наиболее электроотрицательного – F. Как следствие, во фториде цезия не происходит полной передачи электронов от Cs к F, а лишь на 93 % . Это значит, что 7 % времени связывающие электроны находятся в общем пользовании атомов данных элементов, т.е. связь на 7 % ковалентная. В хлориде натрия связь лишь примерно на 80 % ионная. Поэтому уловились считать, что связь ионная, если ковалентная составляющая в ней менее 50 %.
Металлическая связь – это связь между атомами в кристаллах металла.
Металлы отличаются от других веществ высокой электропроводностью, теплопроводностью, пластичностью. В обычном состоянии металлы являются кристаллическими веществами.
У металлов имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Таким образом, в металлах небольшое количество электронов обобществляется всем кристаллом и связывает большое количество атомных ядер. Связь является сильно делокализованной.
Согласно одной из теорий металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом электронным газом.
Металлическую связь нельзя отнести ни к ионному, ни к ковалентному типу. Например, литий кристаллизуется в кубической объемно-центрированной решетке, и каждый его атом имеет в кристалле по восемь близлежащих соседних атомов (рисунок 4.3).
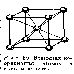
Рисунок 4.3 – Кристаллическая решетка лития
Для образования ковалентной связи атом лития должен был бы представить восемь электронов, что невозможно, так как он имеет лишь один валентный электрон. В кристалле лития каждый атом представляет на связь четыре валентные орбитали и всего лишь один валентный электрон. Число электронов в кристалле значительно меньше числа орбиталей, кроме этого атомы металлов отличаются невысокой степенью ионизации – валентные электроны слабо удерживаются в атоме и легко перемещаются по всему кристаллу. Возможность перемещения электронов по кристаллу определяет высокую электрическую проводимость металлов.
Практически не наблюдается чисто металлической связи, т.к. из-за электростатического притяжения ядер электроны чаще, чем в других областях пространства решетки металла, фиксируются между данными двумя атомами, образуя ковалентную связь. Причем, чем больше заряд ядра и меньше радиус атома, тем больше ковалентная составляющая связи и тем более прочен металл. В наиболее чистом виде металлическая связь характерна только для щелочных и щелочно-земельных металлов. Для других металлов не более 20 % электронов находятся в состоянии обобществления, а остальные осуществляют направленные ковалентные связи между атомами.
Многочисленные экспериментальные данные свидетельствуют о том, что атом водорода способен соединяться одновременно с двумя другими атомами, входящими в состав разных молекул или одной и той же молекулы. С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В).

Последняя связь получила название водородной и обозначается тремя точками.
Водородная связь образуется между активными атомами водорода и сильно электроотрицательными атомами (фтор, кислород, азот, реже хлор, бром, сера). Активными называются атомы водорода, связанные с другим атомом сильно полярной ковалентной связью.
Возможность образования водородной связи является результатом особых свойств атома водорода, а именно – наличия у него одного единственного электрона. Если этот электрон полностью или частично переходит к другому атому, то остается в той или иной мере неэкранированный протон, т.е. частица с единичным положительным зарядом и очень малым радиусом. Это создает возможность протону очень близко подходить к неподеленной электронной паре, принадлежащей сильно электроотрицательному атому и взаимодействовать с ней. При этом атом водорода (положительный заряд) внедряется в электронное облако другого атома (отрицательный заряд).
Водородная связь по своему характеру в основном является электростатической. Ее энергия значительно ниже (в 15–20 раз) энергии ковалентной связи и равна 4–33 кДж/моль, тем не менее она в значительной мере определяет как химические, так и физические свойства соединений.
Возникновение водородной связи приводит к ассоциации молекул, т.е. их объединению в димеры или полимеры.
Водородная связь весьма распространена и играет важную роль в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации. Она обуславливает строение воды и льда, жидкого и твердого аммиака, кристаллов солей.
Водородная связь играет большую роль в химии органических соединений и полимеров. Вследствие незначительной прочности водородные связи легко возникают и разрываются при обычной температуре, что весьма существенно для биологических процессов. Предполагают, что водородная связь играет большую роль в процессе передачи наследственной информации; действие памяти связывают с хранением информации в молекулярных конфигурациях с водородными связями.












