
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
11.1 Типичные окислители и восстановители
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей из возможных для них степеней окисления и поэтому могут понижать свою степень окисления.
Аналогично в роли восстановителей могут выступать простые или сложные вещества, содержащие атомы, которые находятся не в высшей из возможных для них степени окисления и потому могут повышать свою степень окисления.
В качестве типичных окислителей могут выступать:
1) простые вещества, образуемые атомами с большой электроотрицательностью, т.е. типичные неметаллы, расположенные, прежде всего, в главных подгруппах шестой и седьмой групп периодической системы;
2) катионы металлов в высших положительных степенях окисления (Fе3+);
3) кислородсодержащие анионы, соответствующие высшим положительным степеням окисления элемента (нитрат, сульфат);
4) перекисные соединения (пероксиды, супероксиды и т.д.).
Конкретными веществами, применяемыми на практике в качестве окислителей, являются, например, кислород и озон, хлор, бром, пероксид водорода и пероксиды металлов, хроматы, дихроматы и перманганаты, кислородные кислоты хлора и их соли, азотная кислота, концентрированная серная кислота.
В качестве типичных восстановителей могут выступать:
1) простые вещества, особенно те, атомы которых имеют низкую электроотрицательность («активные» металлы);
2) катионы металлов в низших положительных степенях окисления (Fе2+);
3) простые, элементарные анионы, например сульфид-ион;
4) кислородсодержащие анионы, соответствующие низшим положительным степеням окисления элемента (нитрит, сульфит).
Конкретными веществами, применяемыми на практике в качестве восстановителей, являются, например, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогеноводороды (кроме НF), соли двухвалентного железа, органические вещества – формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, монооксид углерода и алюминий при высоких температурах.
Если какое-то вещество содержит некоторый элемент в промежуточной (не высшей и не низшей из возможных для него) степени окисления, то будет ли это вещество вести себя как окислитель или как восстановитель зависит от его «партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель.
Так, нитрит-ион NО2- в кислой среде выступает в роли окислителя по отношению к иону I-:
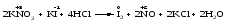
и в роли восстановителя по отношению к перманганат-иону МnО4-:

Характер продуктов окисления восстановителя и восстановления окислителя зависит от «партнера» по реакции, концентрации реагентов, характера среды (кислая, нейтральная, щелочная) и температуры.
11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
Рассмотрим поведение в ОВР некоторых типичных окислителей и восстановителей.
Перманганат калия КМnО4
В зависимости от характера среды КМnО4 восстанавливается до разных продуктов. Из приведенной ниже схемы видно, что его окислительные свойства проявляются в наибольшей степени в кислой среде, при этом он восстанавливается до иона Мn2+, в щелочной же среде его окислительные свойства выражены в наименьшей степени, и он восстанавливается до Мn(+6):

Например:


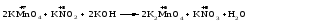
Хроматы и дихроматы
В зависимости от характера среды хром (VI) может находиться в водных растворах в виде хроматов (анион СrO42-) или дихроматов (анион Сr2O72-):

Окислительные свойства хрома (VI) сильнее всего проявляются в кислой среде, где он находится в виде дихромат-иона. В водном растворе дихромат восстанавливается до иона Сr3+, например:

Восстановительные же свойства хрома сильнее всего проявляются в щелочной среде, при этом он окисляется до хроматов, например:
 Kислоты
Kислоты
Всякая кислота диссоциирует с образованием ионов водорода. Эти ионы, взаимодействуя с металлами, стоящими в ряду напряжений левее водорода, восстанавливаются до свободного водорода, например:

Поэтому всякая кислота, взаимодействуя с металлом с выделением водорода, выступает в роли окислителя за счет восстановления ионов водорода.
Кроме того, у кислородных кислот центральный атом может понижать свою степень окисления, в результате чего анион этой кислоты также может выступать в роли окислителя. Так, в молекуле серной кислоты имеется атом серы в степени окисления +6, который может восстанавливаться до более низкой степени окисления: до +4 (SO2), 0 (S), ‒2 (H2S). Следовательно, молекула серной кислоты может выступать в роли окислителя еще и за счет восстановления серы в степени окисления +6.
Чтобы особо выделить такие кислоты, называем их кислотами-окислителями.
Это, например, концентрированная серная кислота, а также азотная кислота как концентрированная, так и разбавленная. Окислительные свойства таких кислот приводят к тому, что при их действии на металлы водород вообще не выделяется. Это связано с тем, что окислителем в данном случае является не Н+, а более сильный окислитель ‒ анион кислоты. Поэтому кислоты-окислители могут окислять даже металлы, стоящие справа от водорода в ряду напряжений, неметаллы (например, серу, фосфор, углерод), а также некоторые сложные вещества, в частности, сульфиды металлов. Если в такой кислоте растворяется оксид металла, в котором последний находится в низкой степени окисления, то происходит окисление металла до более высокой степени окисления. При реакции с неметаллами последние окисляются либо до кислоты (если последняя устойчива), либо до ангидрида такой кислоты (если кислота неустойчива).
Что касается самой кислоты, то, в зависимости от активности восстановителя (например, металла), концентрации кислоты и температуры, кислота может восстанавливаться до разных продуктов, соответствующих разным степеням окисления центрального атома кислоты, причем чаще всего протекают параллельные реакции и получается смесь продуктов восстановления.
Концентрированная серная кислота при нагревании реагирует даже с теми металлами, которые стоят в ряду напряжений после водорода, например, с медью. При реакции концентрированной серной кислоты с металлами водород не выделяется. При этом в зависимости от активности металла образуется оксид серы(IV), элементарная сера или сероводород. Чем выше активность металла, тем более глубоко идет процесс восстановления серной кислоты. Продукты восстановления кислоты можно представить следующей схемой:
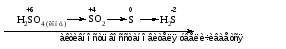
Например:



При контакте холодной концентрированной серной кислоты со многими металлами (прежде всего Аl, Сr, Fе) наблюдается пассивирование металла, т.е. образование на его поверхности защитной оксидной пленки, препятствующей дальнейшему протеканию реакции. Однако при нагревании взаимодействие металла с кислотой делается возможным. Так, железо растворяется в горячей концентрированной кислоте, при этом оно окисляется до степени окисления +3:

Концентрированная серная кислота при нагревании реагирует со многими неметаллами, при этом она восстанавливается до сернистого ангидрида, а неметалл окисляется до соответствующей кислоты (или ее ангидрида, если кислота неустойчива):


Азотная кислота обладает окислительной способностью при любой концентрации. Она реагирует почти со всеми металлами, кроме Аu, Pt и некоторых других. Следует помнить, что водород не выделяется практически при любой концентрации азотной кислоты. Характер продуктов восстановления кислоты зависит от активности восстановителя, например, металла, и концентрации кислоты. С возрастанием активности восстановителя и уменьшением концентрации кислоты степень окисления азота в продукте восстановления уменьшается:

Азотная кислота реагирует также с неметаллами. При этом концентрированная кислота восстанавливается до NО2, а разбавленная ‒ до NО.
Например:







Продукты восстановления азотной кислоты можно условно представить следующей схемой:

Очень сильным окислителем является «царская водка»: смесь одного объема концентрированной азотной кислоты с тремя объемами концентрированной соляной кислоты. Царская водка способна окислять даже металлы, стоящие в крайней правой части ряда напряжений, например, золото и платину. Окислительные свойства царской водки связаны с наличием в ней промежуточного соединения ‒ нитрозилхлорида NОCl, образующегося при окислении НС1 азотной кислотой:

Нитрозилхлорид легко распадается с образованием атомарного хлора, который является очень сильным окислителем:

Протеканию реакции между царской водкой и такими металлами, как золото или платина, способствует также связывание образующихся ионов металла в прочный комплекс, например:
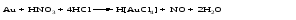
Для простоты эту реакцию обычно записывают следующим образом:

