
- •1 Круговорот азота в природе
- •1.1 Азотофиксация. Нитрогеназа
- •2 Реакции биосинтеза аминокислот
- •2.2 Трансаминирование кислот
- •2.3 Взаимопревращения аминокислот
- •2.4 Прямое аминирование фумаровой кислоты
- •2.5 Синтез незаменимых аминокислот
- •3 Биосинтез белка
- •3.1 Синтез ДНК – репликация
- •3.2 Синтез РНК – транскрипция
- •3.3 Биологический код
- •3.4 Схема передачи генетической информации от ДНК к белку
- •3.5 Биосинтез белков – трансляция
- •3.6 Понятие о мутациях
- •4 Переваривание белков
- •4.1 Биологическая ценность белков
- •5 Катаболизм аминокислот
- •5.1 Дезаминирование аминокислот
- •5.2 Декарбоксилирование аминокислот
- •5.3 Обезвреживание аммиака и биогенных аминов
- •5.4 Орнитиновый цикл мочевинообразования
- •Список используемой литературы
АК = |
А |
× 100 , |
(1) |
В |
|
||
|
|
|
где А – количество, мг, незаменимой аминокислоты в 1 г исследуемого белка;
В – количество, мг, этой же незаменимой аминокислоты в 1 г идеального белка (данные аминокислотной шкалы ФАО/ВОЗ).
По вычисленному скору определяют лимитирующую биологическую ценность изучаемого белка – аминокислоту с наименьшим скором.
Таким образом, для нормального роста и гармоничного развития организма человека большое значение имеют составление и подбор пищевых продуктов, содержащих оптимальный аминокислотный состав и обеспечивающих физиологически полноценное питание для различных групп населения.
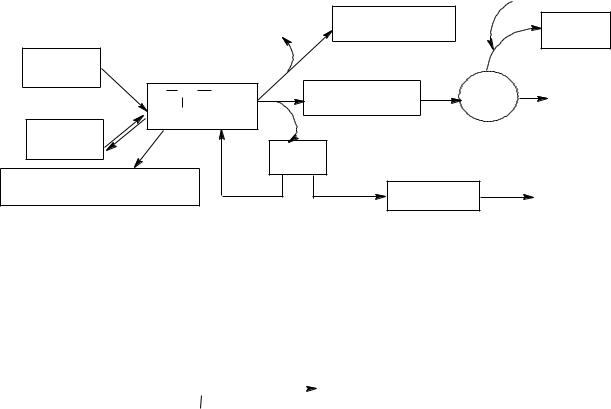
5 Катаболизм аминокислот
Аминокислоты, образовавшиеся в результате распада белков (гидролиз белков пищи, гидролиз тканевых белков), или синтезированные в организме, могут подвергаться различным превращениям. Их роль в организме определяется тем, что они служат строительными блоками для биосинтеза белков, а избыточные аминокислоты подвергаются расщеплению.
Общие пути обмена аминокислот можно представить в виде следующей схемы:
|
|
|
Глюконеогенез |
|
|
СО2 |
Биогенные |
|
Глюкоза |
|
амины |
|
||
Белки |
|
декарбоксилирование |
|
|
пищи |
|
|
|
|
R CH COOH |
|
α -Кетокислоты |
ЦТК |
СО +Н О |
NH2 |
|
дезаминирование |
|
дыхание 2 2 |
Белки |
|
|
|
|
тканей |
NH3 |
|
|
|
|
|
|
||
Для биосинтеза других |
|
|
|
Экскреция |
N-содержащих соединений |
|
Мочевина |
|
|
5.1 Дезаминирование аминокислот
При дезаминировании аминокислот NН2-группа освобождается в виде аммиака. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты, кетокислоты.
Доказано существование 4 типов дезаминирования аминокислот. 1. Внутримолекулярное дезаминирование:
R |
|
CH2 |
|
HC |
|
COOH |
|
R |
|
CH |
|
CH |
|
COOH + NH3 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
NH2 |
|
Ненасыщенная |
||||||||
|
|
|
|
|
карбоновая кислота |
|||||||||
|
|
|
|
|
|
|
|
|||||||
31

Например, в высших растениях содержится фермент фенилаланин-амми- ак-лиаза, который отщепляет аммиак от фенилаланина с образованием коричной кислоты:
|
|
CH |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
||||||
HC |
C CH2 |
CH |
|
|
C |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
C CH CH C |
|
OH + NH3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фенилаланин- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
NH2 |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
аммиак-лиаза HC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
HC |
|
|
CH |
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
CH |
|||||||||||||||||||||||||||||||||||||
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|||||
|
|
Фенилаланин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Коричная кислота |
||||||||||||||||
|
|
2. Восстановительное дезаминирование: |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
R |
|
|
|
|
CH |
|
|
COOH |
+2Н |
R |
|
|
CH2 |
|
|
|
|
|
|
|
COOH + NH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
H2N |
|
|
|
|
|
|
|
|
|
|
Карбоновая |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|||||||||||||||||||||||||
|
|
3. Гидролитическое дезаминирование: |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
R |
|
|
|
HC |
|
|
COOH |
|
+Н2О |
R |
|
CH |
|
|
|
|
|
|
|
|
COOH + NH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гидроксикислота |
|||||||||||||||||||||
|
|
4. Окислительное дезаминирование: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
R |
|
|
HC |
|
COOH + 1/2О2 |
|
|
|
R C |
|
|
|
|
COOH + NH3 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кетокислота |
||||||||||||||||
Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим является окислительное дезаминирование.
Окислительное дезаминирование аминокислот протекает в две стадии. Сначала аминокислота окисляется в иминокислоту при участии специфической дегидрогиназы с НАД+ или НАДФ+ в качестве кофермента и акцептора водорода. Затем иминокислота спонтанно гидролизуется на кетокислоту и аммиак:
COOH |
НАД+ НАДН + Н+ |
COOH |
Н2О |
COOH |
||
CH2 |
|
CH2 |
CH2 |
|||
|
|
|
|
|||
CH2 |
|
Глутаматдеги |
|
CH2 |
|
CH2 + NH3 |
HC NH |
2 |
дрогеназа |
|
C NH |
|
C O |
|
|
|
|
|
|
|
COOH |
|
|
COOH |
|
COOH |
|
Глутаминовая |
Иминокислота |
|
α − Кетоглутаровая |
|||
кислота |
|
|
|
|
||
|
|
|
|
кислота |
||
Внекоторых случаях дегидрогиназы аминокислот представлены флавопротеинами, т.е. содержат в качестве кофактора ФАД или ФМН.
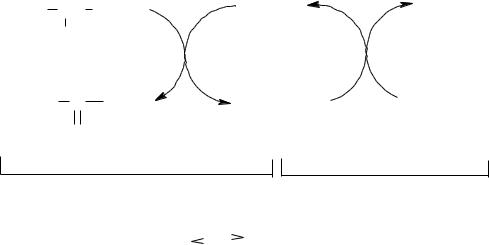
Врастениях дезаминирование аминокислот может осуществляться при участии полифенолоксидазы по следующей схеме:
32
R |
CH COOH |
Хинон |
Н2О |
|
NH2 |
|
|
R |
C COOH |
Полифенол |
1/2О2 |
HN Иминокислота
дегидрогеназа полифенолоксидаза
R |
|
C |
|
COOH + Н2О |
|
R |
|
C |
|
COOH + NН3 |
||||
|
|
|
||||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
||||
|
|
NH |
|
|
|
|
|
|||||||
Дегидрогеназа, отнимая от аминокислоты водород, передает его хинону, который при этом превращается в полифенол. Полифенол снова окисляется полифенолоксидазой с образованием воды и хинона, который опять может вступать в реакцию. Иминокислота, присоединяя воду, дает кетокислоту и аммиак.
Окислительное дезаминирование аминокислот имеет большое положительное значение в ряде бродильных производств, основанных на использовании спиртового брожения. Именно в результате дезаминирования образуется целый ряд побочных продуктов спиртового брожения, оказывающих большое влияние на качество готовой продукции – спирта, вина, пива. При дезаминировании аминокислот дрожжами образуются кетокислоты, которые подвергаются в дальнейшем окислительно-восстановительным превращениям, в результате которых образуются так называемые сивушные масла – смесь различных одноатомных спиртов, – придающие неприятный запах и привкус этиловому спирту, вину или пиву. Так, лейцин в ходе последовательных реакций дезаминирования, декарбоксилирования и восстановления превращается в изоамиловый спирт.
Универсальными для всех живых организмов являются реакции расщепления аминокислот, в которых не происходит прямого выделения аммиака, в то время как аминогруппа от аминокислоты переносится на α-кетокислоту. Эти реакции называют реакциями трансаминирования и протекают они при участии ферментов аминотрансфераз. Подробно – смотри реакции синтеза аминокислот (см. п.2).
33
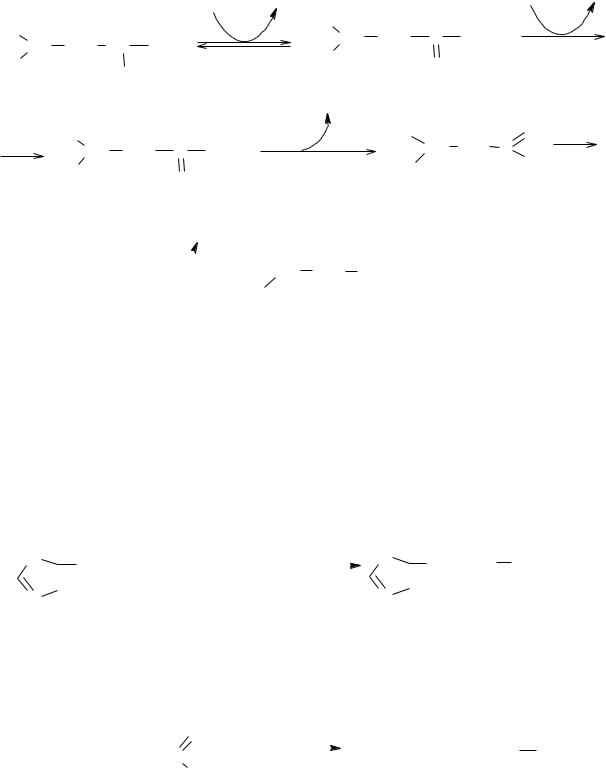
|
|
|
НАД+ НАДН + Н+ |
|
|
|
|
Н2О |
NН3 |
|
H3C |
HC COOH |
H3C CH |
CH |
2 |
C COOH |
|
|
|||
CH CH2 |
H3C |
|
|
|
|
|
||||
H3C |
|
NH2 |
Дегидрогеназа |
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Лейцин |
|
|
|
Иминокислота |
|
|
|
|||
|
|
|
СО2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
CH2 C |
|
|
H3C |
CH CH2 |
C |
O |
|
|
|
|
|
|
|
||||||
CH |
COOH |
|
H3C |
H |
|
|||||
H3C |
|
O |
Декарбоксилаза |
|
|
|
|
|||
|
|
|
|
|
|
Изовалериановый |
|
|||
Кетокислота |
альдегид |
|
НАДН + Н+ НАД+
 H3C
H3C CH CH2 СН2ОН Дегидрогеназа H3C Изоамиловый спирт
CH CH2 СН2ОН Дегидрогеназа H3C Изоамиловый спирт
5.2 Декарбоксилирование аминокислот
Третий важный тип диссимиляции аминокислот – декарбоксилирование. В результате этой реакции удаляется α-карбоксильная группа и образуются физиологически активные соединения – биогенные амины. Биогенные амины оказывают сильное фармакологическое действие на множество физиологических функций человека и животных.
Реакции декарбоксилирования катализируют ферменты декарбоксилазы, простетической группой которых является пиридоксальфосфат (активная форма витамина В6).
Например, при декарбоксилировании гистидина образуется гистамин:
H |
|
|
|
|
|
O |
Гистидин- |
H |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
||||
N |
|
|
|
|
|
|
|
|
|
|
CH |
|
CH2 |
NH2 + СО2 |
||||
CH |
|
|
CH |
|
C |
|
OH |
|
||||||||||
|
|
2 |
|
|
|
декарбоксилаза |
N |
|
2 |
|||||||||
|
|
|
|
|
||||||||||||||
N гистидин |
NH2 |
|
|
гистамин |
|
|||||||||||||
|
|
|
|
|||||||||||||||
Он вызывает усиление деятельности желез внутренней секреции и снижает кровяное давление.
Декарбоксилирование является важной реакцией при разложении белков в результате жизнедеятельности гнилостных бактерий. Так, при декарбоксилировании лизина образуется кадаверин:
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
Лизин- |
H2N |
|
CH |
|
(СН2) |
|
CH2 |
NH2 + СО2 |
H N |
|
CH |
|
(СН |
|
) |
|
|
|
HC |
|
C |
|
|
|
|
||||||
|
|
|
|
|
|
|
декарбоксилаза |
|
2 |
3 |
||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
2 |
2 |
|
2 |
|
3 |
|
|
|
|
OH |
|
|
|
кадаверин |
|
|
||||||
|
|
лизин |
|
|
|
|
|
NH2 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Из тирозина – тирамин, триптофана – триптамин, орнитина – путресцин.
34

|
|
|
|
|
|
|
O |
|
|
Тирозин- |
|
|
|
CH |
|
CH |
NH |
+ СО |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
CH |
|
CH C |
OH |
|
|
|
|
|
2 |
2 |
2 |
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
2 |
|
|
|
|
|
|
|
декарбоксилаза |
|
|
|
тирамин |
|
|
||||
HO |
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
||||||
|
тирозин |
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Образующиеся при декарбоксилировании кадаверин, путресцин, триптамин являются основной причиной порчи мясных и рыбных продуктов.В то же время кадаверин и путресцин используются для синтеза полиаминов – спермидина и спермина. Играют важную роль в процессах клеточного деления, роста и дифференцировки ткани, а также в регуляции синтеза ДНК, РНК и белка.
При дальнейших превращениях, например, триптамина, образуются скатол и индол – ядовитые соединений, от которых в основном зависит запах гниющего мяса.
Декарбоксилирование аминокислот у растений приводит к биосинтезу алкалоидов – азотсодержащих органических соединений, обладающих более выраженной физиологической активностью, чем амины.
Продуктами декарбоксилирования аминокислот могут являться не только амины и диамины. Так, при декарбоксилировании дикарбоновых кислот, в частности глутаминовой кислоты образуется ϒ-аминомасляная кислота:
O |
|
|
|
|
O |
|
O |
|
|
|
|
||
C CH |
|
CH2 |
|
CH |
|
C |
Глутамат- |
|
C |
(СН2) |
|
CH2 NH2+ СО2 |
|
2 |
|
|
OH |
декарбоксилаза HO |
2 |
||||||||
HO |
H2N |
γ − аминомасляная кислота |
|||||||||||
|
|
|
|
|
|
||||||||
Глутаминовая кислота
ϒ-аминомасляная кислота накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. Аналогично этому из аспарагиновой кислоты получается β-аланин, который принимает участие в синтезе пантотеновой кислоты (витамин В3).
O |
|
|
|
|
|
|
O |
Аспартат- |
|
|
|
|
|
O |
|
|
|
|
|
|
CH |
|
CH |
|
C |
+ СО2 |
|||
C |
|
CH |
|
|
CH |
|
C |
|
|
|
||||
|
|
|
|
декарбоксилаза |
2 |
2 |
||||||||
|
2 |
|
|
|||||||||||
|
|
OH |
OH |
|||||||||||
HO |
|
|
|
|
|
|
H2N |
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
NH2 |
|
β − аланин |
|
|||||||
Аспарагиновая кислота |
|
|
|
|
|
|
|
|||||||
Для микроорганизмов свойственно ω-декарбоксилирование. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
O |
|
|
|
|
|
|
|
O |
Аспартат- |
|
|
|
|
O |
|
|
|
|
|
|
|
H3C |
CH |
|
C |
+ СО2 |
|||
C |
|
CH |
|
|
CH |
|
C |
|
|
|
||||
|
|
|
|
|
декарбоксилаза |
|
||||||||
|
2 |
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
OH |
OH |
||||||||||
HO |
|
|
|
|
|
|
|
|
NH2 |
|||||
|
|
|
|
NH2 |
|
|
||||||||
Аспарагиновая кислота |
|
α − аланин |
|
|||||||||||
35
