
Тесты в ЭМИРСе / ВСЕ ТЕСТЫ ПО ХИМИИ
.docxВопрос: Укажите формулу несолеобразующего оксида 1. H2O 2. Na2O2 3. PbO2 4. Cl2O7 5. CO Ответ: 5 Правильно!
Вопрос: Укажите оксид, реагирующий с Na2O. 1. MgO 2. BaO 3. CO 4. CO2 5. SiO Ответ: 4 Правильно!
Вопрос: Укажите формулу метафосфорной кислоты. 1. HPO2 2. H3PO4 3. HPO3 4. H4P2O7 5. H3PO3 Ответ: 3 Правильно!
Вопрос: Укажите название солей хлорноватистой кислоты. 1. хлораты 2. хлориты 3. хлориды 4. гипохлориты 5. перхлораты Ответ: 4 Правильно!
Вопрос: Укажите схему суммарной диссоциации гидроксида олова (II) 1. H2SnO2 ⇄ H+ + HSnO2- 2. Sn (OH)2 ⇄ SnOH+ + OH- 3. Sn (OH)2 ⇄ Sn2+ + 2OH- 4. Sn2+ + 2OH- ⇄ Sn (OH)2 ⇄ SnO22- + 2H+ 5. H2SnO2 ⇄ 2H+ + SnO22- Ответ: 3 Неправильно!
Вопрос: Укажите вещества, при добавлении которых ослабляется диссоциация сероводородной кислоты. 1. KOH 2. K2S 3. H2SO4 4. NaNO3 5. K2SO4 Ответ: 2,3 Правильно!
Вопрос: Укажите группу формул, соответствующих следующим солям: метафосфат калия; сульфат никеля II; сульфит хрома III 1. K3PO4; NiSO3; Cr2S3 2. NiSO4; Cr2(SO3)3; KPO3 3. Ni(PO3)2; Cr2(SO4)3; K4P2O7 4. CrPO4; NiS; K2SO3 5. KPO2; Ni(HS)2; Cr(NO3)3 Ответ: 2 Правильно!
Вопрос:
Укажите
формулу хлорной кислоты
1.
H - O - Cl
2.  3.
H - O - Cl ═ O
4.
3.
H - O - Cl ═ O
4. 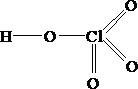 5.
H - Cl
Ответ: 4
Правильно!
5.
H - Cl
Ответ: 4
Правильно!
Вопрос: Укажите формулу средней (нормальной) соли 1. CrOHSO4 2. Cr(HS)3 3. Cr2(SO4)3 4. Na3[Cr(OH)6] 5. KCr(SO4)2 Ответ: 3 Правильно!
Вопрос: Укажите формулу кислой соли 1. KNO3 2. KAl(SO4)2 3. CaNO3Cl 4. Ca(HSO4)2 5. AlOHSO4 Ответ: 4 Правильно!
Вопрос: Укажите формулу основной соли 1. [Cu(NH3)4]SO4 2. CuSO4 3. K2[Cu(OH)4] 4. CuOHCl 5. Cu(HSO4)2 Ответ: 4 Правильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить основную соль
1. ![]() 2.
2. ![]() 3.
3. ![]() 4.
H3PO4 +
NaOH →
5.
4.
H3PO4 +
NaOH →
5. ![]() Ответ: 1
Правильно!
Ответ: 1
Правильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить кислую соль
1. ![]() 2.
2. ![]() 3.
3. ![]() 4.
K2SO4 +
Al2(SO4)3 →
5.
4.
K2SO4 +
Al2(SO4)3 →
5. ![]() Ответ: 3
Правильно!
Ответ: 3
Правильно!
Вопрос: Укажите формулу гидросульфида меди (II) 1. (CuOH)2SO4 2. Cu(HSO4)2 3. Cr2S3 4. Cu(HS)2 5. KCr(SO4)2 Ответ: 4 Правильно!
Вопрос: Для последовательного осуществления превращений по схеме PbO → Pb(NO3)2 → Pb(OH)2 → PbOHCl → PbCl2 необходимы вещества____ 1. HNO3; NaOH; HCl(недост.); HCl(избыт) 2. NO2; К2О; Cl2; HCl(избыт) 3. HNO2; КОН; H2О; HCl(избыт) 4. NH4OH; HNO3; HCl(избыт); Cl2 Ответ: 1 Правильно!
Вопрос: С помощью каких реагентов можно отличить в растворах NaCl и Zn(NO3)2 1. HNO3 2. K2S 3. AgNO3 4. HCl 5. H2SO4 Ответ: 5 Неправильно!
тест "Способы выражения концентрации растворов"
Вопрос: К 400 г 10% раствора сульфата натрия добавили еще 20 г вещества. Определить процентную концентрацию вновь полученного раствора. 1. 15% 2. 9,52% 3. 14,3% 4. 5% 5. 20% Ответ: 3 Правильно!
Вопрос: До какого объема следует упарить 1,5 л 0,05 н. раствор для получения 0,1 н. раствора? 1. 0,75 л 2. 1,0 л 3. 0,5 л 4. 0,25 л 5. 1,25 л Ответ: 1 Правильно!
Вопрос: Вычислить процентную концентрацию 8 н. раствора HNO3, плотность которого 1,26 г/мл. 1. 50,4% 2. 40,0% 3. 25,2% 4. 20,0% 5. 60,0% Ответ: 2 Правильно!
Вопрос: Сколько граммов азотной кислоты содержится в 200 мл 0,1н. раствора? 1. 1,26 г 2. 0,05 г 3. 3,15 г 4. 0,5 г 5. 2,52 г Ответ: 1 Правильно!
Вопрос: Какой объем 0,125 н. раствора NaOH требуется для реакции с 15 мл 0,25 н. раствора нитрата серебра? 1. 7,5 мл 2. 15,0 мл 3. 22,5 мл 4. 11,25 мл 5. 30 мл Ответ: 5 Неправильно!
тест "Гидролиз"
Вопрос: Сульфат натрия при растворении в воде 1. гидролизуется по катиону 2. гидролизуется по аниону 3. гидролизуется по катиону и аниону 4. не гидролизуется Ответ: 4 Правильно!
Вопрос: Сульфит натрия при растворении в воде 1. гидролизуется по одной ступени 2. гидролизуется по первой ступени 3. гидролизуется необратимо 4. не гидролизуется Ответ: 2 Правильно!
Вопрос: Нитрат калия при растворении в воде образует 1. основание и кислоту 2. кислую соль и основание 3. основную соль и кислоту 4. не гидролизуется Ответ: 4 Правильно!
Вопрос: рН среды в растворе сульфата натрия 1. =7 2. > 7 3. <7 4. ≥ 7 Ответ: 1 Правильно!
Вопрос: При гидролизе _________ образуется основная соль 1. KCN 2. K2Cr2O7 3. (NH4)2S 4. FeCl3 Ответ: 4 Правильно!
Вопрос: pH наибольшее в растворе соли _____ при равной концентрации всех солей (KHF = 1·10-4; KHClO = 3·10-8; KHCN = 5·10-10; KCH3COOH = 2·10-5). 1. NH4F 2. NH4ClO 3. CH3COONH4 4. NH4CN Ответ: 1 Неправильно!
Вопрос: Константа гидролиза фторида натрия равна __, если KHF = 1·10-4. 1. 2·10-12 2. 3·10-14 3. 5·10-8 4. 1·10-10 Ответ: 4 Правильно!
Вопрос: Уравнение S2- + HOH ⇔ HS- + OH- относится к гидролизу соли_____ 1. F2S3 2. Cr2S3 3. K2S 4. (NH4)2S Ответ: 3 Правильно!
Вопрос: При гидролизе _____ образуются слабое основание и слабая кислота 1. Na2CO3 2. Na2SO4 3. Al2S3 4. CH3COONa Ответ: 3 Правильно!
Вопрос: Полному необратимому гидролизу подвергается 1. FeCl3 2. K2SO4 3. Ca(CN)2 4. Al2S3 Ответ: 4 Правильно!
тест "Строение атома, химическая связь"
Вопрос: Укажите количество способов ориентации в пространстве характерное для d-подуровня: 1. 1 2. 3 3. 5 4. 7 5. 2 Ответ: 3 Правильно!
Вопрос: Укажите, по какому принципу рассчитывается количество электронов на подуровне: 1. по уравнению Де-Бройля 2. по принципу Паули 3. по уравнению Шредингера 4. по правилам Клечковского 5. по правилу Хунда Ответ: 2 Правильно!
Вопрос: Укажите относительную энергию электронов на подуровнях 3p 4f 5d 6s: 1. 3,4,5,6 2. 2,4,3,1 3. 1,3,2,0 4. 4,7,7,6 5. 3,7,5,1 Ответ: 1 Неправильно!
Вопрос: Укажите электронную формулу, соответствующую атому в возбужденном состоянии: 1. 1s22s22p63s2 2. 1s22s22p63s13p1 3. 1s22s22p3 4. 1s22s1 5. 1s22s22p5 Ответ: 2 Правильно!
Вопрос: Укажите положение ( № группы, подгруппу и № периода) в таблице Д.И.Менделеева элемента электронный паспорт которого заканчивается на ....3р4 1. Ш период IVА группа 2. IV период IVB группа 3. V период IVА группа 4. III период VIA группа 5. V период IVВ группа Ответ: 4 Правильно!
Вопрос: Для веществ, образованных металлической связью, характерно ____ 1. теплоизоляция 2. диссоциация в расплавах 3. электропроводность 4. летучесть Ответ: 3 Правильно!
Вопрос: σ- и π-связи образуются в молекуле 1. H2S 2. С2Н4 3. SiCl4 4. I2 Ответ: 2 Правильно!
Вопрос: Расположите связи в порядке возрастания их полярности: а) As-O, б) S-O, в) Se-O, г) Ga-O, д) Zn-O 1. а, б, в, г, д 2. д, г, в, б, а 3. д, г, а, в, б 4. б, в, а, г, д Ответ: 4 Правильно!
Вопрос: Дипольный момент молекулы ______ равен нулю 1. CO 2. GeS 3. HCl 4. SiCl4 Ответ: 4 Правильно!
Вопрос: В молекуле __________угол между связями равен 90°: 1. H2O 2. SеCl6 3. AsCl3 4. BeCl2 Ответ: 2 Правильно!
Вопрос: sp2- гибридизация в молекуле 1. CS2 2. C2H2 3. C2H4 4. CO2 Ответ: 3 Правильно!
Вопрос: Наименьшей степенью ионности обладает связь ______ 1. H-Se 2. H-F 3. K-F 4. H-Cl Ответ: 3 Неправильно!
Вопрос: Атомную кристаллическую решетку образует 1. кремний 2. кадмий 3. йод 4. хлорид натрия NaCl Ответ: 1 Правильно!
тест "Электролитическая диссоциация и физические свойства растворов"
Вопрос: pOH 1•10–1 н раствора слабой одноосновной кислоты равен 11.Определить константу диссоциации кислоты. 1. 1•10–5 2. 1•10–3 3. 1•10–4 4. 1•10–21 5. 1•10–2 Ответ: 1 Правильно!
Вопрос: Определить нормальную концентрацию раствора NaOH, если эффективная концентрация ионов OH– равна 0,18 моль/л, кажущаяся степень диссоциации NaOH равна 90%. 1. 0,1 моль-экв/л 2. 0,2 моль-экв/л 3. 0,4 моль-экв/л 4. 1,0 моль-экв/л 5. 2 моль-экв/л Ответ: 2 Правильно!
Вопрос: Степень диссоциации уксусной кислоты СH3CООН составляет при 18 ºС 1%. Определить концентрацию раствора, если Кдисс кислоты при данной температуре 2·10–5. 1. 2·10–5 моль/л 2. 2 моль/л 3. 0,2 моль/л 4. 0,01 моль/л 5. 4 моль/л Ответ: 3 Правильно!
Вопрос: Определить рН раствора, в 1л которого содержится 196г H2SO4. Диссоциацию кислоты считать полной. 1. 0,6 2. 13,4 3. 6 4. 8 5. 7 Ответ: 3 Неправильно!
Вопрос: Вычислить произведение растворимости гидроксида магния при 18℃ , если его растворимость при этой температуре равна 1,7·10–4 моль/л. 1. 1,7•10–4 2. 3,4•10–4 3. 1,96·10–11 4. 4,08•10−3 5. 5,78•10−3 Ответ: 3 Правильно!
Вопрос: Имеются растворы KCN, Ca(NO3)2, Na3PO4, Al2(SO4)3, содержащие по 0,5М растворённого вещества в 500 г воды. Какой из растворов замерзает при более низкой температуре, если кажущаяся степень диссоциации этих солей примерно одинакова? 1. КСN 2. Ca(NO3)2 3. Na3PO4 4. Al2(SO4)3 5. замерзают при одинаковой температуре Ответ: 4 Правильно!
Вопрос: Определить температуру замерзания раствора, содержащего 0,2 моля неэлектролита (μ = 37) в 200 мл воды. Ккр = 1,86 1. -0,186°С 2. -0,372°С 3. -1,86°С 4. -3,72°С 5. 1,86°С Ответ: 3 Правильно!
Вопрос: Раствор, содержащий 3,04 г камфоры C10H16O в 100 г бензола, кипит при 80,714°С, температура кипения бензола 80,2°С. Вычислить эбуллиоскопическую константу бензола. 1. 5,14 2. 1,28 3. 3,4 4. 2,57 5. 0,26 Ответ: 4 Правильно!
Вопрос: Определить давление пара раствора, содержащего 4 г NaOH (μ = 40) в 180 г воды при 100°С, если кажущаяся степень диссоциации NaOH составляет 80%. 1. 99,5 кПа 2. 103,1 кПа 3. 99,8 кПа 4. 102,1 кПа 5. 101,3 кПа Ответ: 1 Правильно!
Вопрос: Вычислить температуру кипения 3,38 %-ного раствора нитрата кальция, если соль диссоциирована на 65%. 1. 99,745°С 2. 66,456°С 3. 102,0°С 4. 100,255°С 5. 98,0°С Ответ: 4 Правильно!
тест "Окислительно-восстановительные реакции"
Вопрос: Элементы в высшей степени окисления в ОВР ________ электроны 1. могут и отдавать и принимать 2. только принимают 3. только отдают Ответ: 3 Неправильно!
Вопрос: С увеличением потенциала ионизации металлические свойства __________ 1. ослабевают 2. усиливаются 3. не изменяются Ответ: 1 Правильно!
Вопрос: Из приведенных примеров наиболее сильным восстановителем является 1. Sr 2. Al 3. Na 4. Ge 5. Sn Ответ: 3 Правильно!
Вопрос: Ионы ClO4- в ОВР могут быть ________ 1. и окислителями и восстановителями 2. только восстановителями 3. только окислителями Ответ: 3 Правильно!
Вопрос: Превращение _________ соответствует процессу окисления 1. SO32- → S 2. MnO42- → MnO4- 3. Zn2+ → Zn 4. NO3- → N2 5. NO3- → NH3 Ответ: 2 Правильно!
Вопрос: В реакции Si + KOH + H2O → H20 + SiO32- продуктом восстановления является ________ 1. Si 2. KOH 3. H2O 4. H20 5. SiO32- Ответ: 4 Правильно!
Вопрос: Окислительно-восстановительная реакция KNO3 → KNO2 + O2 относится к типу _______ 1. внутримолекулярного ОВ 2. диспропорционирования 3. межмолекулярного ОВР Ответ: 1 Правильно!
Вопрос: В реакции KMnO4 + KI + H2O → MnO2 + I2 участвует ______ электронов 1. 3 2. 4 3. 2 4. 5 5. 6 Ответ: 1 Неправильно!
тест "Химическая термодинамика и химическая кинетика"
Вопрос: Согласно___________ закону термодинамики: «Энтропия равна нулю только у идеальных кристаллов при абсолютном нуле» 1. второму 2. третьему 3. нулевому 4. первому Ответ: 2 Правильно!
Вопрос: При образовании 92г газообразного N2O4 поглощается 9,6 кДж тепла. Стандартная энтальпия образования N2O4 равна______ кДж/моль. 1. -9,6 2. +9,6 3. -4,8 4. +19,2 Ответ: 2 Правильно!
Вопрос: Изменение энтропии ΔS°298 в реакции N2(г) + 3H2(г) = 2NH3(г) соответствует 1. ΔS > 0 2. ΔS < 0 3. ΔS = 0 4. ΔS ≤ 0 Ответ: 2 Правильно!
Вопрос: При сгорании 2,4 г. магния выделяется 60,25 кДж тепла. Определить стандартную энтальпию образования MgO. 1. -60,25 кДж/моль 2. +60,25 кДж/моль 3. -602,5 кДж/моль 4. -1205 кДж/моль Ответ: 3 Правильно!
Вопрос: Самопроизвольное протекание химической реакции при высоких температурах определяется величиной изменения ______ 1. энтальпии 2. энтропии 3. энергии Гиббса 4. теплового эффекта Ответ: 2,3 Правильно!
Вопрос: Для реакции N2 + 2O2 = 2NO2 ΔH>0. Самопроизвольно реакция протекает ______ 1. при низких температурах 2. при высоких температурах 3. при любых температурах 4. невозможна ни при каких условиях Ответ: 2 Неправильно!
Вопрос: Вычислить изменение ΔG°298 в реакции CuO(к) + Ca(к) = CaO(к) + Cu(к) 1. -604,2 кДж 2. +129,9 кДж 3. -474,3 кДж 4. +474,3 кДж Ответ: 3 Правильно!
Вопрос: Вычислить ΔG для реакции CaO(к) + СО(г) = Са(к) + СО2(г) при 1000 К, если ΔS°298,Ca = 41,63Дж/моль•К. Зависимостью ΔН и ΔS от температуры пренебречь. 1. +481,1 кДж 2. -352,5 кДж 3. +352,5 кДж 4. +334,37 кДж Ответ: 4 Правильно!
Вопрос: При каких концентрациях (моль/л) йода (CI) и водорода (CH) скорость реакции H2 + I2=> 2HI численно равна константе скорости? 1. CH = 0.2 CI = 2.0 2. CH = 0.2 CI = 6.5 3. CH = 0.7 CI = 1.5 4. CH = 5.0 CI = 0.2 5. CH = 3.9 CI = 3.3 Ответ: 4 Правильно!
Вопрос: Как изменится скорость прямой реакции в системе O2 + 4HCl → 2H2O + 2Cl2, если объем смеси увеличить в 2 раза. 1. увеличится, x4 2. увеличится, x16 3. уменьшится, x32 4. увеличится, x32 5. уменьшится, x16 Ответ: 5 Неправильно!
Вопрос: В какой из приведенных газофазных реакций равновесие не нарушается с повышением давления? 1. CH4 + 2H2S <=> CS2 + 4H2 2. 2SO2 + O2 <=> 2SO3 3. 4FeO + O2 <=> 2Fe2O3 4. 2CO + O2 <=> 2CO2 5. N2 + O2 <=> 2NO Ответ: 4 Неправильно!
Вопрос: Исходные концентрации азота и водорода в реакции N2 + 3H2 <=> 2NH3 равны 8 и 4 моль/л соответственно. К моменту достижения равновесия в реакцию вступило 10% исходного азота. Чему равна константа равновесия? 1. 0.0868 2. 0.22 3. 0.139 4. 11,52 5. 0,356 Ответ: 1 Правильно!
Вопрос: Во сколько раз увеличится скорость реакции при увеличении температуры на 20℃, если температурный коэффициент скорости равен 2.5? 1. 50 2. 5 3. 6.25 4. 1.25 5. 0.5 Ответ: 3 Правильно!
тест "Комплексные соединения "
Вопрос: Продуктами диссоциации в водном растворе соединения (NH4)2[ZnCl2(CN)(NO2)] являются 1. 2NH4+ + Zn2+ + CN- + NO2- + Cl2 2. 2NH4 + Zn2+ + 2Cl- + CN- + NO2 3. 2NH4Cl + Zn2+ + CN- + NO2- 4. 2NH4+ + [ZnCl2(CN)(NO2)]2- Ответ: 4 Правильно!
Вопрос: Величина и знак заряда комплексного иона [Cr+3(NH3)2Cl2(CN)2] равны 1. 1+ 2. 3+ 3. 3- 4. 1- Ответ: 1 Неправильно!
Вопрос: Соединение [Ni(NH3)6](OH)2 относится к классу 1. кислот 2. солей 3. оснований 4. аммиакатов Ответ: 3,4 Правильно!
Вопрос: Из соединений [Ni(NH3)4](OH)2 и Ni(OH)2 более сильным основанием является 1. оба слабые 2. оба сильные 3. Ni(OH)2 4. [Ni(NH3)4](OH)2 Ответ: 4 Правильно!
Вопрос: Самым неустойчивым комплексным ионом из представленных является 1. [Au(CN)2]-, Kн ≈ 10-39 2. [Cu(CN)4]2-, Kн ≈ 10-28 3. [Cd(CN)4]2-, Kн ≈ 10-17 4. [Ag(NH3)2]+, Kн ≈ 10-3 Ответ: 1 Неправильно!
Вопрос: Комплексный ион [Au(CN)2]- имеет __________ форму 1. линейную 2. тетраэдрическую 3. квадратную 4. октаэдрическую Ответ: 1 Правильно!
Вопрос: Концентрация ионов CN- в 0,1 моль/л растворе соли K[Au(CN)2], если Кн = 1•10-39, составляет_______ 1. 2,9•10-8 2. 1,45•10-12 3. 2,2•10-13 4. 5,85•10-14 Ответ: 4 Правильно!
тест "Электрохимия"
Вопрос: Для измерения стандартных электродных потенциалов металлов используется _______ 1. окислительно-восстановительный электрод 2. электрод, обратимый по аниону 3. электрод первого рода 4. водородный электрод Ответ: 4 Правильно!
Вопрос: Электродный потенциал серебра, опущенного в 0,01М раствор его соли, равен ______ В 1. −0,86 2. +0,682 3. +0,741 4. −0,918 Ответ: 2 Правильно!
Вопрос: Величина ЭДС гальванического наибольшая, если в качестве в качестве анода при никелевом катоде взять ______ 1. медь 2. кадмий 3. магний 4. цинк 5. серебро Ответ: 3 Правильно!
