
voronina
.pdf
них РНК від 10 до 70%). Низький ступінь спіралізації, очевидно, пов'я- заний із їх функцією в процесі біосинтезу білка.
Рис.23. Вторинна структура фрагме- Рис. 24. Вторинна структура РНК нта РНК, що містить спіралізовану ділянку зі спареними комплементар-
ними основами
Третинна структура РНК характеризується більшою укомплек- тованістю в просторі і може мати вигляд одиночного ланцюга, ком- пактного стрижня або клубка. Усі три структури можуть переходити одна в одну в залежності від умов навколишнього середовища – кон- центрації солей, рН, температури і т.ін. (див. рис. 25).
Рис. 25. Різновиди макромолекулярної структури РНК (за О.С.Спіріним): а – розгорнута нитка; б – компактний стрижень; в – компактний клубок
Якщо ДНК міститься головним чином у ядрах клітин, то РНК пе- реважно знаходиться в цитоплазмі, у рибосомах. Загальна роль РНК
101
полягає в безпосередній участі в біосинтезі білка. РНК, що містяться в клітині, відрізняються складом, розміром, функцією і локалізацією. У цитоплазмі містяться кілька РНК: транспортна РНК (тРНК), мат- рична, або інформаційна (мРНК, або іРНК), рибосомна (рРНК).
Крім перелічених типів РНК, у ядрі клітини виявлена ще одна – так звана гетерогенна ядерна РНК (гяРНК). Вона синтезується в яд- рі на ДНК і є попередником усіх типів РНК. Утворення різних типів РНК із попередників називають процесингом. Окрім клітинних РНК, існують вірусні РНК, що входять до складу більшості вірусів.
Характеристика основних видів РНК
Транспортна РНК (тРНК). На її частку припадає 10–15% від усієї РНК клітини. Це найбільш низькомолекулярні молекули РНК. Вони містять у собі від 75 до 90 нуклеотидів, М.м. = 23000–30000 дальтон. Раніше їх називали розчинними і позначали sРНК (від англ. soluble – розчинний). Основна функція тРНК полягає в тому, що вони транс- портують α-амінокислоти з цитоплазми до місця синтезу білка, тоб- то до рибосом, і розташовують їх у певному порядку в поліпептид- ному ланцюзі під час його біосинтезу. Таким чином, тРНК беруть участь у процесі трансляції, тобто служать своєрідним переклада- чем – перекладають послідовність нуклеотидів у послідовність амі- нокислотних залишків білкової молекули (див. Біосинтез білка). Проведені дослідження показали, що тРНК мають високу специфіч- ність. Кожна α-амінокислота має свою тРНК. Чисельність тРНК пе- ревищує чисельність α-амінокислот, які беруть участь у побудові біл- ків. Це зумовлено тим, що деякі α-амінокислоти транспортуються не однією, а декількома тРНК. Першою вивченою тРНК була алані- нова тРНК (Р.Холлі, США, 1965 р.). У 1967 р. російським вченим О.О.Баєвим зі співробітниками була визначена послідовність нукле- отидів у валіновій тРНК. Молекули тРНК являють собою одиночний полінуклеотидний ланцюг 5'→3' із частковою спіралізацією. Усі тРНК побудовані за одним планом і описуються як модель «листка конюшини», який вміщує в основному 5 петель (стеблин). Структура типу «листок конюшини» пояснює характерну реакційну здатність нуклеотидних ланцюгів у різних ділянках тРНК (див. рис.26). Акцеп- торна ділянка (1) певної тРНК приєднує до 3'-кінця полінуклеотид- ного ланцюга специфічну α-амінокислоту, друга петля (2) забезпечує приєднання тРНК до ферменту, який забезпечує приєднання α-амі- нокислоти до акцепторної ділянки тРНК, третя петля (3) містить так званий «антикодон» – ділянку, до складу якої входять три поряд розташовані нуклеотиди (триплет) і яка відповідає за приєднання до кодону мРНК. Тому, антикодон і кодон забезпечують специфічну взаємодію тPНK з мРНК. Існує петля (5), відповідальна за приєд-
102

нання тРНК до рибосоми. Таким чином, тРНК з'єднує між собою всі ділянки, необхідні для біосинтезу білків.
Рентгеноструктурні дослідження показали, що молекула тРНК більш компактна, що зумовлено зближенням окремих петель і стеб- лин «листка конюшини» з утворенням третинної структури L-подібної форми (ліктьовий згин), яка утримується додатковими ван-дер-вааль- совими зв'язками з чітко визначеними функціональними центрами.
Рис. 26. Вторинна (праворуч) та третинна (ліворуч) структури тРНК
Транспортна PНK у своїй структурі має багато мінорних основ. Мінорні нуклеотиди містяться в основному в петлях. Вони не всту- пають у комплементарну взаємодію з іншими основами і тому пе- решкоджають утворенню подвійної спіралі і тим самим вносять свій внесок у формування певної просторової структури тРНК.
Таким чином, тРНК зв'язує попередньо активовану α-амінокис- лоту і транспортує її до рибосом, де своїм антикодоном вона знахо- дить відповідний кодон на мРНК, що забезпечує заданий порядок розташування α-амінокислот у процесі біосинтезу специфічного білка.
Матрична РНК (мРНК). Оскільки мРНК переносить відкопійо- вану з ділянки ДНК інформацію про первинну структуру білка, не- рідко її називають інформаційною РНК (іРНК). Матрична PНК становить близько 2–6% усієї клітинної РНК, її молекулярна маса варіюється від 300000 до 4000000 дальтон і складається з одного полінуклеотидного ланцюга, довжина якого залежить від поліпеп- тидного ланцюга, який повинен синтезуватися на цій матриці. Окрім того, мРНК може містити ще й некодуючі ділянки. Оскільки матрицею для синтезу мРНК є ДНК, то синтезована мРНК (див. рис. 29), мігруючи у цитоплазму, переносить генетичну інформацію до місця біосинтезу білка – рибосом. Кожній амінокислоті відпові- дає на мРНК конкретний триплет (кодон), який складається із трьох поряд розташованих нуклеотидів. Нaприклад, для синтезу
103
білкової молекули, складеної з 200 амінокислотних залишків, необ- хідна мРНК, складена з 600 нуклеотидів (з урахуванням триплетно- сті коду). Можна сказати, що кожному кодону в ДНК відповідає комплементарний антикодон у мРНК. Як правило, антикодони в мРНК називають просто кодонами і нуклеотидний код для α-амі- нокислот записують також у вигляді нуклеотидних послідовностей у мРНК. Такий код відомий тепер для всіх амінокислот. Процес копіювання генетичної інформації одержав назву транскрипції.
Потім до мРНК, яка знаходиться в рибосомі, прикріплюються своїми антикодоновими ділянками тРНК, які несуть α-амінокислоти. Між зближеними α- амінокислотами утворюється пептидний зв'язок.
Рибосомна РНК (рРНК). Рибосомна РНК є тією основою, на якій розташовуються білки, що утворюють рибосоми – найдрібніші внут- рішньоклітинні структури, які містять близько 70% рРНК. Звідси і походить її назва. Рибосоми беруть активну участь у біосинтезі білка. Вони локалізовані головним чином у цитоплазмі, крім того, – в мі- тохондріях і хлоропластах. Відомо декілька різновидів рРНК з різ- ними коефіцієнтами седиментації 28SPHK, 18SPНK, 5SРНК, де S – коефіцієнт седиментації, який вимірюється в одиницях Сведберга і визначається швидкістю седиментації молекул при ультрацентрифу- гуванні.
Фізико-хімічні властивості нуклеїнових кислот
Фізико-хімічні властивості нуклеїнових кислот визначаються ви- сокою молекулярною масою і рівнем структурної організації.
Нуклеїнові кислоти – це речовини білого кольору, волокнис- тої будови, слабкорозчинні у воді у вільному стані, але добре роз- чинні у воді у вигляді солей лужних металів. Вони також добре розчинні в сольових розчинах: РНК – у розбавлених, а ДНК – у більш концентрованих. Розчинність двоспіральних нуклеїнових кислот гірша, ніж односпіральних.
Молекулярна маса ДНК – від 0,5 млн до 20 млн і вище, а її моле- кула складається з багатьох тисяч нуклеотидів; молекулярна маса РНК – від 30 тис. до 2 млн, а нуклеотидів у молекулі – до 4–6 тис.
Завдяки негативному заряду молекули нуклеїнових кислот ру- хаються в електричному полі. Нуклеїнові кислоти міцно зв'язують іони металів, зазнають модифікації шляхом алкілування і дезамі- нування. При фізіологічних значеннях рН усі нуклеїнові кислоти є поліаніонами й оточуються протиіонами з білків і неорганічних ка- тіонів. Усі нуклеїнові кислоти здатні поглинати світло в ультрафіо- летовій частині спектра близько 260 нм. Порушення нативності ну- клеїнових кислот супроводжується підвищенням поглинання світ- ла – має місце так званий гіпохромний ефект. Величина гіпохром- ності – найважливіша ознака ступеня спіралізації нуклеїнових кис-
104
лот. У зв'язку із цим гіпохромний ефект використовується для вив- чення процесів денатурації і ренатурації нуклеїнових кислот, а та- кож гібридизації спіралей ДНК-РНК тощо.
Денатурація і ренатурація нуклеїнових кислот. Під впливом де-
натуруючих факторів (температура 70°–100°С, вплив хімічних речо- вин, сильнокисле і лужне середовище тощо) відбувається розрив во- дневих і ван-дер-ваальсових зв'язків, що стабілізують вторинну і тре- тинну структуру нуклеїнових кислот. Внаслідок розриву водневих і гідрофобних зв'язків ланцюги нуклеїнових кислот розходяться і на- бувають конформації безладного клубка. Денатурація супроводжу- ється підвищенням поглинання світла при 260 нм (гіпохромний ефект). Поглинання може збільшуватись приблизно в 1,5 рази. Це – зручний метод дослідження денатурації. Денатурацію можна вияви- ти також за зменшенням в'язкості розчину і зміною кута обертання площини поляризованого променя. Якщо розчин нуклеїнової кисло- ти, денатурований нагріванням, повільно охолоджувати, то полінук- леотидні ланцюги ДНК об'єднуються за принципом комплементар- ності (див.рис.27). При цьому утворюється нативна подвійна спіраль ДНК. Це явище називається ренатурацією. При швидкому охолоджу- ванні ренатурація не відбувається.
Гібридизація ДНК-ДНК. Якщо змішати розчини ДНК, виділені з організмів різних видів (наприклад, кроля і жаби), нагріти цю суміш (денатурувати ДНК), а потім повільно охолодити, то знову утворюва- тимуться двоспіральні структури. При цьому, разом із двоспіральни- ми молекулами, ідентичними вихідним молекулам ДНК, можуть утворюватися гібридні молекули, що мають один нуклеїновий ланцюг із ДНК кроля, а другий – із ДНК жаби. Такі гібридні молекули бувають недосконалими: спіралізовані ділянки чергуються в них з неспіралізо- ваними. Недосконалість гібридів ДНК-ДНК можна визначити за до- помогою електронного мікроскопа. Вивчення гібридизації ДНК-ДНК дозволило зробити такі важливі для біологів висновки:
1.ДНК всіх органів і тканин одного і того ж організму ідентичні;
2.ДНК, виділені із тканин різних істот одного біологічного виду, ідентичні. Однак можуть бути невеликі розбіжності, які не можна виявити методом гібридизації (подвійна спіраль не утворюється, якщо некомплементарні ділянки містять більше 3–5 нуклеотид- них залишків);
3.ДНК, отримані від істот різних біологічних видів, – неіденти- чні, утворюють недосконалі гібридні молекули. Ступінь недоскона- лості гібридів ДНК-ДНК тим більший, чим віддаленіші за філогене- тичною спорідненістю види. У зв'язку з цим метод гібридизації ДНК-ДНК виявився зручним при вивченні систематики організмів.
105

Рис.27. Вплив повільного і швидкого охолоджування на структуру ДНК
З результатів вивчення ДНК методом гібридизації випливає, що первинна структура ДНКхарактеризується видовою специфічністю.
Гібридизація ДНК-РНК. Подібним шляхом може відбуватися і гі- бридизація ДНК-РНК: у цьому випадку гібридна молекула містить один дезоксирибонуклеотидний ланцюг і один рибонуклеотидний. При гібридизації ДНК із РНК (первинних транскриптів), виділених із одного організму, утворюються справжні гібриди. Інакше кажучи, уся РНК організму комплементарна ДНК того ж організму. Це означає, що всі викладки щодо видової специфічності ДНК однаковою мірою можуть бути використані і для РНК.
Дослідження процесів гібридизації мають важливе значення не тільки для вивчення первинної структури різноманітних видів нук- леїнових кислот, але і для наукових і практичних досліджень у галузі генної інженерії.
Біологічна роль ДНК і РНК
Нуклеїнові кислоти виконують в організмі різні функції. Найва- жливіші з них – це участь у передачі спадкових ознак і в процесі біо- синтезу білка та його регуляції. Основним носієм генетичної інфор- мації для більшості організмів є ДНК. Виняток становлять тільки окремі фаги, віруси, у яких носієм спадкової інформації служить мо- лекула РНК.
106
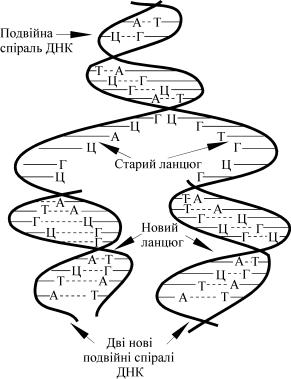
Комплементарність ланцюгів ДНК складає хімічну основу най- важливішої функції ДНК – зберігання і передачу спадкових (генетич- них) ознак. При поділі клітин подвійна спіраль ДНК розкручується і розділяється на два ланцюги. На кожному окремому ланцюзі, як на матриці, відбувається біосинтез нового ланцюга ДНК із врахуванням принципу комплементарності. Новоутворений ланцюг не ідентич- ний, а комплементарно подібний до матриці (рис. 28).
Рис. 28. Біосинтез ДНК
Внаслідок цього утворюються дві нові подвійні спіралі, кожна з яких включає один старий (материнський) і один новосинтезований ланцюги. Такий процес точного копіювання молекули ДНК, у ре- зультаті якого утворюються дві однакові двоспіральні молекули, на- зивається реплікацією. Реплікація лежить в основі забезпечення дочі- рніх клітин молекулами ДНК, повністю ідентичними з ДНК мате- ринських клітин.
Таким чином спадкові ознаки зберігаються в поколіннях.
107

Аналогічним шляхом в ядрі відбувається синтез молекули інфо- рмаційної (матричної) РНК, яка потім сама служить матрицею для біосинтезу білка в цитоплазмі (рис.29).
Рис. 29. Синтез мРНК на ділянці ДНК
Утворений ланцюг мРНК комплементарний тій ділянці ДНК, на якому він синтезується. При цьому, однак, аденіновій основі в ДНК буде відповідати урацилова основа в РНК, а як пентозний залишок у ланцюзі РНК буде використовуватися рибоза (див. рис.29).
Синтез мРНК є, в сутності, переписуванням (транскрипцією) ге- нетичної інформації з ділянок (генів, цистронів) ДНК на мРНК. Остання потім використовується як матриця, де в присутності рибо- сом і відповідних тРНК, що несуть залишки α-амінокислот, відбува- ється синтез необхідного білка.
Генетична інформація, тобто інформація про синтез певних біл- ків, записана (закодована) в нуклеотидній послідовності ДНК. Як уже зазначалося, одну амінокислоту кодує тринуклеотидна послідов- ність, тому код називається триплетним. Три нуклеотиди, що конт- ролюють включення даної амінокислоти у відповідний білок у про- цесі його біосинтезу, називають кодоном.
Збереження нуклеотидної послідовності і точність її транскрип- ції є запорукою безпомилкової передачі спадкової інформації.
Виключне значення нуклеотидів не обмежується лише тим, що вони є будівельними матеріалами для нуклеїнових кислот. Нуклео- тиди входять до складу небілкової частини (коферменту) фермента- тивних систем і беруть участь в обміні речовин. Важливу групу кофе- рментів складають не тільки монофосфати (АМФ, ГМФ, ЦМФ та ін.), але і нуклеозидполіфосфати (АДФ, ATФ, ГДФ, ГТФ та ін.). У процесі обміну речовин в організмі як універсальне джерело й аку- мулятор енергії використовуються АТФ, ГТФ та ін. В окислювально- відновлювальних процесах беруть участь і багато інших кофермен- тів, які мають нуклеотидну природу (НАД, ФАД і т.ін.).
108
ГЛАВА 4. ФЕРМЕНТИ
Поняття про ферменти
У живих організмах протікають одночасно з величезною швид- кістю тисячі хімічних реакцій, які забезпечують синтез і розпад різ- номанітних органічних сполук і йдуть у строго визначеній послідо- вності – взаємообумовлено і взаємопов’язано, що забезпечується дією біологічних каталізаторів білкової природи. Білкові речовини, що виконують біокаталітичні функції, одержали назву «ферменти» чи «ензими» – від латинських слів «fermentum» – закваска, дріжджі, «fermentatio» – бродіння і від грецьких слів «en zyme» – у дріжджах, у заквасці. Походження термінів пов'язане з тим, що початково фе- рментативні процеси було відкрито і вивчено в бродильному виро- бництві (спиртове бродіння).
Ферменти – найважливіший клас білкових речовин (простих і складних). Це високоспеціалізовані, універсальні за своєю біологічною функцією білкові речовини, які синтезуються в процесі життєдіяльно- сті всіх живих організмів, і виконують функції каталізаторів біохіміч- них процесів, тобто прискорюють і здійснюють перебіг певних хіміч- них реакцій у живому організмі. Ферменти можуть проявляти свою активність як в організмі, так і виділеними з нього. Це дозволяє ши- роко застосовувати ферменти в народному господарстві, медицині.
Значення ферментів для життєдіяльності надзвичайно велике. У присутності ферментів хімічні процеси в організмі протікають за десяті, тисячні, мільйонні і навіть мільярдні частки секунди. Без фе- рментів ці ж хімічні реакції йшли б роками, добами, годинами, а це несумісно з тим рівнем обміну речовин і енергії, який властивий жи- вій матерії. Наприклад, в організмі людини за одну секунду руйну- ється і синтезується три мільйони еритроцитів, а еритроцити – це складні утворення, адже до складу одного еритроцита входить 300–400 мільйонів молекул гемоглобіну – гемпротеїну з молекулярною ма- сою 65000–68000. Два грами пепсину (ферменту, який виробляється в шлунку і гідролізує білки) здатні розщепити за 2 год 100 кг денатуро- ваного яєчного білка, а 1,6 г ферменту підшлункової залози амілази за добу гідролізують 175 кг крохмалю. І.П.Павлов вважав, що фер- менти «є збудниками всіх хімічних перетворень в організмі». О.М.Бах підкреслював, що без ферментів організм задихнувся б у присутності кисню і не засвоював би харчові продукти.
Вивчення будь-якої проблеми в галузі пізнання механізмів жит- тєдіяльності обов'язково пов'язане із дослідженням відповідних фе- рментних систем. Такий інтерес до біологічних каталізаторів не ви- падковий. Ферменти є найважливішими компонентами клітини, во- ни тісно пов'язані із найрізноманітнішими процесами життєдіяльно- сті. Сукупність біохімічних реакцій, які каталізуються ферментами, складає сутність обміну речовин, котрий є обов'язковою рисою всіх живих організмів. Через ферментативний апарат відбувається і ре- гуляція швидкості метаболічних реакцій, їх спрямованість.
109
На сьогодні охарактеризовано декілька тисяч ферментів, більше тисячі з них отримано в індивідуальному стані. Для багатьох сотень білків-ферментів з’ясована амінокислотна послідовність, а найбільш відомі з них розшифровані за допомогою рентгеноструктурного аналізу до рівня повної просторової структури.
Вивчення ферментів має величезне значення для будь-якої фун- даментальної та прикладної галузі біології, для багатьох практичних галузей хімічної, харчової та фармацевтичної індустрії, що займа- ються приготуванням каталізаторів, антибіотиків, вітамінів, аміно- кислот, пептидів та інших біологічно активних речовин, які викорис- товуються в народному господарстві, у медицині, а також для орга- нізації безвідходного хімічного, у тому числі й фармацевтичного ви- робництва, оскільки ферментативний каталіз протікає без побічних продуктів. Окрім того, ферменти широко використовуються в нау- ково-дослідних роботах як високоспецифічні реагенти, як інструмен- ти для дослідження будови біополімерів (наприклад, нуклеїнових ки- слот), у генно-інженерних розробках тощо.
Останнім часом наука про ферменти відокремилася в окрему галузь біохімічної науки – ферментологію (ензимологію), яка інтенси- вно розвивається в тісному зв'язку з багатьма науками, зокрема, з ор- ганічною, неорганічною, фізичною хімією, фізіологією, токсикологією, мікробіологією, генетикою, фармакологією та ін. Таким чином, ця га- лузь знань знаходиться на стику хімічних, біологічних і медичних наук.
Історичний нарис. Ферментативні процеси відомі людству з да- вніх-давен. Народи багатьох країн здавна володіли мистецтвом ви- готовлення хліба, сиру, вина, оцту тощо на основі переробки рослин- ної і тваринної сировини. Однак початок сучасному етапу в розвитку ензимології було покладено у XIX столітті. У 1814 р. петербурзький вчений К.С.Кірхгоф установив, що крохмаль під дією деяких речо- вин, які знаходяться в проростаючих зернах ячменю, перетворюєть- ся в цукристу речовину (мальтозу). Речовина, яка вилучається з про- рослого ячменю і має здатність перетворювати крохмаль у мальто- зу, отримала назву амілази (від лат. amylum – крохмаль). У 1836 р. І.Берцеліус узагальнив установлені факти прискорення протікання хімічних реакцій і назвав це явище каталізом, а каталізатори, що по- стачаються живими клітинами, були названі ферментами.
Незабаром розгорілася суперечка стосовно природи спиртового бродіння, у якій брали участь видатні представники природознавства того часу. Так, Л.Пастер (1856 р.) притримувався думки, що бродіння викликають живі мікроорганізми і, звідси, воно пов'язане винятково з їх життєдіяльністю. У той же час Ю.Лібіх та інші відстоювали хімі- чну природу бродіння, вважаючи, що воно пов'язане з певними речо- винами, подібними до амілази. Суперечка була повністю вирішена наприкінці минулого століття. У 1871 р. російська вчена М.М. Мана- ссеїна довела, що ферменти можуть виявляти свою дію і поза кліти- нами. Шляхом розтирання дріжджів вона отримала фільтрат дріж- джового соку, який мав таку ж властивість зброджувати вуглеводи, як і власне дріжджові клітини. Дані М.М.Манассеїної підтвердили
110
