
voronina
.pdf
ділянку ферменту, активність його буде дуже низькою – фермента- тивна реакція блокується.
Рис. 41. Схема конкурентного гальмування сукцинатдегідрогенази малонатом
Багато фармакологічно активних сполук змінюють протікання метаболічних процесів унаслідок дії на ферменти. Деякі з них висту- пають у ролі конкурентних інгібіторів, завдяки подібності за струк- турою до метаболітів. Такі сполуки називають антиметаболітами.
Метаболіти – це природні субстрати (хімічні сполуки), які вхо- дять у нормі до складу живих організмів (білки, нуклеїнові кислоти, вуглеводи, ліпіди, вітаміни, гормони тощо), а також продукти їх тка- нинного перетворення – метаболізму.
Антиметаболіти – це сполуки, які мають структурну подібність (аналоги) з метаболітами і можуть конкурувати з останніми за фер- мент. При утворенні комплексу фермент – антиметаболіт фермен- тативна активність втрачається.
Наприклад, сульфаніламідні препарати є антиметаболітами па- раамінобензойної кислоти (ПАБК). ПАБК є метаболітом, який син- тезується в мікроорганізмах. ПАБК за структурою подібна до суль- фанілової кислоти, похідні якої складають групу бактеріостатичних, так званих сульфаніламідних препаратів.
141
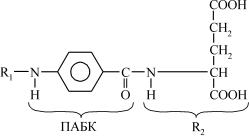
У мікроорганізмах у присутності ПАБК синтезується вітамін- фолієва кислота (назва походить від джерела її виділення з рослин: folium – листок), яка є важливим коферментом ряду ферментів, ко- трі беруть участь у синтезі нуклеїнових кислот, а відповідно, і біл- ків. Таким чином, фолієва кислота є фактором росту бактерій: ста- філококів, пневмококів та ін. Цим забезпечується ріст і розмно- ження мікроорганізмів.
У фолієвій кислоті ПАБК має два замісники: за аміногрупою – гетероциклічне похідне, яке позначимо R1, і за карбоксильною гру- пою – глутамінову кислоту – R2:
Під час прийому сульфаніламідних препаратів вони конкурують із ПАБК (структурна подібність) на стадії утворення фолієвої кисло- ти, оскільки в організмі створюється достатньо висока їх концентра- ція. Наявність сульфамідної групи в сульфаніламідних препаратах перешкоджає взаємодії ПАБК із глутаміновою кислотою. Таким чи- ном припиняється (блокується) біосинтез фолієвої кислоти. Блокада синтезу фолієвої кислоти в мікроорганізмах призводить до пору- шення біосинтезу нуклеїнових кислот і білка, внаслідок чого пригні- чується ріст і розмноження бактерій.
Таким чином, сульфанілова кислота та її N-заміщені аміди є ан- тиметаболітами ПАБК і через антиметаболітне гальмування фер- ментів зумовлюють бактеріостатичний ефект. Оскільки організм людини не здатний синтезувати вітамін-фолієву кислоту, а отримує її із їжею, він мало чутливий до дії сульфаніламідів у низьких конце- нтраціях. Антиметаболітне гальмування є різновидом конкурентно- го пригнічення активності ферментів.
Конкурентними інгібіторами ферменту ацетилхолінестерази (АХЕ), який каталізує розщеплення ацетилхоліну на холін і оцтову кислоту, є фармакологічні препарати прозерин, фізостигмін та ін. Наприклад, прозерин, маючи у своїй молекулі четвертинний амоніє- вий азот, легко приєднується (електростатично) до посадочної діля- нки активного центру АХЕ (рис.42):
Прозерин конкурентно гальмує АХЕ, внаслідок чого накопичу- ється ацетилхолін, який і викликає фармакологічний ефект при пев- них захворюваннях (міастенії, паралічах, рухових порушеннях після травм, при лікуванні і попередженні атонії кишечника, у тому числі і післяопераційної, і т.ін.). Дія прозерину є оборотною, вона поступово
142

закінчується, оскільки ацетилхолін витискує інгібітор-прозерин з ак- тивного центру і займає своє місце на посадочній ділянці. При цьому утворюється фермент-субстратний комплекс, і каталітична ділянка за участю молекули води вступає в реакцію розщеплення ацетилхо- ліну (процес гідролізу), що дає можливість згодом уникнути пере- збудження в синапсах через накопичення ацетилхоліну.
Рис.42. Схема конкурентного гальмування ацетилхолінестерази прозерином
Вибірково виключаючи той чи інший фермент, можна здійсню- вати своєрідний аналіз участі конкретного ферменту в обміні речо- вин. Конкурентне гальмування відкриває можливості для спрямова- ного пошуку антиметаболітів з метою отримання специфічних фар- мпрепаратів.
Неконкурентним гальмуванням називається гальмування, пов'я-
зане із впливом інгібітора на каталітичне перетворення, але не на зв'язування субстрату з ферментом, тому конкурентних відносин між субстратом і інгібітором немає, і ступінь гальмування залежить тільки від концентрації останнього. Неконкурентний інгібітор або зв'язується безпосередньо з каталітичними групами активного центру ферменту, або, зв’язуючись із ферментом поза активним центром, змінює кон- формацію активного центру і, таким чином, впливає на структуру ка- талітичної ділянки, заважаючи взаємодії із нею субстрату.
Найважливіші неконкурентні інгібітори, утворювані в живих ор- ганізмах, є проміжними продуктами метаболізму, здатні зв'язувати- ся зі специфічними ділянками (алостеричний центр) на поверхні де- яких ферментів і змінювати при цьому активність їх каталітичних центрів (див. нижче).
Прикладом необоротного неконкурентного гальмування може бути дія фосфорорганічних препаратів, подібних до хлорофосу. Фос- форорганічні сполуки (ФОС) блокують необоротно в каталітичній
143

ділянці ферменту ацетилхолінестерази (АХЕ) залишок амінокисло- ти серину (рис.43); внаслідок чого фермент стає неактивним, відзна- чається накопичення ацетилхоліну, що призводить до отруєння ор- ганізму. Тому ФОС застосовують для боротьби зі шкідниками сіль- ського господарства, побутовими комахами та гризунами тощо. У медичній практиці, наприклад, при очних захворюваннях, також застосовуються ФОС (фосфакол, армін, пірофос та ін.), які утворю- ють стійкий комплекс з АХЕ, і, якщо не застосовувати спеціальні ре- активатори, активність ферменту не відновлюється. Нормальний процес гідролізу ацетилхоліну почнеться знову лише тоді, коли здій- сниться біосинтез нової АХЕ. Неконкурентними інгібіторами є, на- приклад, ціаніди, які міцно з'єднуються з тривалентним залізом, що входить у каталітичну ділянку гемінового ферменту – цитохромок- сидази. Блокада цитохромоксидази призводить до виключення тка- нинного дихання, і клітина швидко гине. До неконкурентних інгібі- торів ферментів належать іони важких металів та їх органічні сполу- ки. Тому іони важких металів – ртуті, свинцю, миш'яку тощо – дуже токсичні. Вони блокують, наприклад, SH-групи, які входять у каталі- тичну ділянку ферменту (рис. 44, а). Комплекс фермент – інгібітор здатний приєднати субстрат, але перетворення його не відбувається, оскільки каталітичні групи заблоковані. Зняти дію неконкурентного інгібітора надлишком субстрату (як у разі конкурентного гальмуван- ня) неможливо. Це можна зробити лише речовинами, які зв'язують інгібітор (реактиваторами – див. рис. 44, б).
Рис.43. Неконкурентне гальмування ФОС ацетилхолінестерази
Важкі метали лише в невеликих концентраціях виконують роль неконкурентних інгібіторів. У великих кількостях вони є інактивато- рами, діючи як денатуруючі агенти.
144

Рис. 44. Схема дії неконкурентного інгібітора (іони ртуті) і механізм реак- тивування ферменту, заблокованого неконкурентним інгібітором
У фармакологічній практиці знайшли застосування препарати, що містять ртуть, миш'як, вісмут, які неконкурентно гальмують фе- рменти в клітинах організму або хвороботворних бактерій, чим і ви- значається їх той чи інший ефект. Наприклад, під час дії похідних миш'яку сульфгідрильні групи ферментів (наприклад, дегідрогеназ) з'єднуються, утворюючи циклічні неактивні сполуки:
У разі інтоксикації цими препаратами проводиться їх зв'язуван- ня або витіснення з комплексу фермент – інгібітор різними реакти- ваторами, або протиотрутами. До них належать, наприклад, SH- вмісні комплексони (цистеїн, унітіол тощо), лимонна кислота, ети- лендиамінтетраоцтова кислота та ін.
Безконкурентне гальмування. Спостерігається в тому випадку,
коли інгібітор оборотно взаємодіє з ферментом тільки після утво- рення ES-фермент-субстратного комплексу, тобто безконкурентний інгібітор не поєднується з ферментом у відсутності субстрату. Окрім того, інгібітор полегшує приєднання субстрату, а потім, зв’язуючись, гальмує фермент. Це більш рідкісний вид гальмування.
Алостерична регуляція активності ферментів
У багатьох суто біосинтетичних реакціях основним типом регу- ляції швидкості багатоступінчатого ферментативного процесу є ало- стеричне гальмування, зокрема, за типом зворотного зв'язку, коли
145

кінцевий продукт біосинтетичного ланцюга пригнічує активність ферменту, який каталізує ключову реакцію. Як вже зазначалося, де- які ферменти (регуляторні) крім активного центру мають алостери- чний центр для зв'язування алостеричних ефекторів (модифікато- рів), які після взаємодії з алостеричним центром роблять фермент або активним, або неактивним. Алостерична регуляція характерна, головним чином, для ферментів, які мають четвертинну структуру. Негативні ефектори гальмують перетворення субстрату, тобто, з'єд- нуючись з алостеричним центром, змінюють конформацію фермен- ту і цим перешкоджають формуванню активного центру на фермен-
ті (див. рис. 45, 46).
Рис.45. Схема дії інгібітора, який викликає алостеричну регуляцію:
а– приєднання субстрату до активного центру можливе;
б– приєднання субстрату до активного центру неможливе
Позитивні алостеричні ефектори сприяють формуванню актив- ного центру і таким чином прискорюють ферментативну реакцію (див. рис. 46). Тому їх називають алостеричними активаторами.
Рис.46. Взаємодія алостеричного ферменту із субстратом і ефекторами (схема). а – активний комплекс; б – неактивний комплекс; 1 – активний центр; 2 – алостеричний центр; 3 – субстрат; 4 – позитивний ефектор; 5 – негативний ефектор
146

Алостеричними ефекторами найчастіше виступають різні мета- боліти хімічних перетворень в організмі, кофактори, гормони та їх похідні, іони металів та ін. Іноді й субстрат може виконувати функ- цію алостеричного ефектора. Очевидно, що в таких ферментів акти- вний центр за конфігурацією схожий на алостеричний, але останній не має каталітичної ділянки, чим і відрізняється від активного центру ферменту. Подібні ферменти мають нібито власний конт- роль.
Окремі ферменти мають по декілька алостеричних центрів: одні з них специфичні до алостеричних активаторів, інші – до інгібіторів. Чим більше алостеричних центрів і ефекторів, тим чутливіше реа- гують ферменти на зміни в обміні речовин.
Алостеричні ферменти відіграють важливу роль в обміні речо- вин клітини. Вони займають «ключове» положення в метаболізмі, оскільки тонко реагують на зміни в обміні речовин і регулюють швидкість проходження речовин системою ферментів. Наприклад, алостерична регуляція проявляється у вигляді гальмування кінцевим продуктом першого ферменту ланцюга. Зовнішньо така регуляція подібна до регуляції за типом зворотного зв'язку і дає змогу контро- лювати вихід кінцевого продукту, у випадку накопичення якого при- пиняється дія першого ферменту ланцюга. Існування подібного ме- ханізму контролю активності ферментів метаболітами було відкри- то в кишечної палички під час дослідження синтезу L-ізолейцину. Виявилося, що L-ізолейцин, котрий є кінцевим продуктом, вибірково пригнічує активність ферменту треоніндегідратази, яка каталізує пе- ршу ланку процесу перетворення L-треоніну в L-ізолейцин, що нара- ховує 5 ферментативних реакцій:
Існування процесу гальмування за типом зворотного зв'язку до- ведено для всіх живих організмів, і нині він розглядається як один із провідних типів регуляції активності ферментів і клітинного мета- болізму в цілому.
Виявлено алостеричну регуляцію за допомогою гормонів. На- приклад, інсулін є алостеричним активатором гексокінази, котра бе- ре участь у перетворенні глюкози до глюкозо-6-фосфату в присутно- сті АТФ, а алостеричним інгібітором цього ферменту є гормони надниркових залоз – глюкокортикоїди. Жіночі статеві гормони (ест- рогени) є алостеричними інгібіторами ферменту глутаматдегідро- генази, який каталізує дезамінування глутамінової кислоти.
147

Множинні молекулярні форми ферментів. Ізоферменти
Під множинними молекулярними формами ферментів (ММФФ) розуміють ряд форм одного й того ж ферменту, які каталізують одну й ту саму реакцію, але відрізняються за місцем локалізації в органі- змі, за складом, а отже, і за деякими властивостями: швидкістю пе- ресування в електричному полі, оптимумом рН, імунологічними ха- рактеристиками і т.ін. Група споріднених ферментів, що є рядом форм одного і того ж ферменту з четвертинною структурою органі- зації і які відрізняються один від одного за якістю субодиниць, одер- жала назву ізоферментів. На даний час ізоферменти виявлені більш ніж у 100 ферментів.
Як приклад можна розглянути лактатдегідрогеназу (ЛДГ), яка каталізує утворення й окислення молочної кислоти:
ЛДГ має четвертинну структуру, що складається із 4 субодиниць, які представлені двома типами: типом Н (англ. heart – серце) і ти- пом М (англ. muscle – м'яз) за назвою органів, де виявлена їх найбі- льша активність.
Одиничні ланцюги позбавлені ферментативної активності і тільки утворення тетрамерів ЛДГ у різній комбінації двох типів суб- одиниць дає активний фермент. Різне співвідношення Н та М суб- одиниць призвело до виникнення п'яти ізоферментів ЛДГ: у складі одного ізоферменту присутні 4 субодиниці типу Н (4Н, або ЛДГ–1),
удругому – 3 субодиниці типу Н і одна типу М (3Н1М, або ЛДГ–2),
утретьому – дві субодиниці Н и дві – М (2Н2М, або ЛДГ–3), у четве-
ртому – одна Н и три М (1H3М, або ЛДГ–4) і в п'ятому – 4 субодини- ці типу М (4М, або ЛДГ–5). Ізоферменти позначаються цифpaми в залежності від швидкості пересування їх в електричному полі від ка- тоду до аноду. Ізоферменти ЛДГ мають різну локалізацію в ткани- нах: у серці, мозку, нирках переважають ЛДГ–1, а в печінці і м'язах – ЛДГ–5. Це має важливе значення для діагностики різних захворю- вань і є тестом видужування. Знаючи спектр ізоферментів для кож- ного органу, поставити діагноз уже нескладно (див. рис. 47).
Зміщення в співвідношенні ММФФ (їхня кількість, активність кожної із форм, стабільність) є одним із механізмів регуляції обмін- них процесів.
Поліферментні системи
Кожна клітина організму має свій специфічний набір ферментів. Деякі з них містяться у всіх клітинах, інші присутні тільки в деяких.
148

У клітині робота кожного ферменту, як правило, не індивідуальна, а тісно пов'язана з іншими ферментами, тобто з окремих ферментів формуються поліферментні системи, або конвейєри. Субстрат іноді під час свого перетворення проходить довгий ланцюг реакцій, у яких бере участь багато ферментів. Продукт реакції, яка каталізується першим ферментом, служить субстратом для другого ферменту і т.д. Прикла- дом може бути процес гліколізу. Усі ферменти гліколізу наявні в роз- чинному стані. У процесах перетворення глюкози до молочної кисло- ти бере участь цілий ряд ферментів. Положення кожного ферменту в ланцюзі встановлюється за спорідненістю із субстратами (починаю- чи з глюкози), кожен з яких відповідно є продуктом реакції, каталізо- ваної попереднім ферментом. Це збільшує швидкість ферментатив- них реакцій, і в такому ланцюзі проміжні продукти не накопичуються.
Чимало поліферментних ансамблів структурно зв'язані з якою- небудь органелою (мітохондрії, рибосоми, ядро) або з біомембрана- ми і складають високоорганізовані системи, що забезпечують життє- воважливі функції, наприклад, тканинне дихання, тобто, перенос еле- ктронів і протонів від субстратів до кисню через систему дихальних ферментів, закріплених на внутрішній мембрані мітохондрій.
Рис. 47. Проявлені проби ізоферментів після електрофорезу сигналізують про захворювання різних органів
Деякі ферменти, що беруть участь у реакції одного ланцюга метаболізму, об'єднуються в мультиензимні комплекси з певною функцією. Типовим прикладом подібних надмолекулярних компле-
149
ксів є піруватдегідрогеназний комплекс, що складається з декількох ферментів, які беруть участь в окисленні піровиноградної кислоти до ацетил-КoА, або синтетаза жирних кислот, що складається із семи структурно зв’язаних ферментів, котрі виконують функцію синтезу жирних кислот.
Іммобілізовані ферменти та їх застосування
Ферменти виявляють свою активність не тільки в мікропросторі клітини, але й поза організмом. Вони є виключно активними і спе- цифічними каталізаторами, котрі мають недосяжну для хімічних ка- талізаторів активність і вибірковість і, крім того, прискорюють ба- гато реакцій, для яких взагалі не відомі хімічні каталізатори. Тому практичне використання ферментів відкриває величезні можливості для розробки багатьох хімічних процесів, які йдуть у м'яких умовах з високим виходом цільових продуктів. Однак, по-перше, ферменти, ідеально пристосовані для роботи в живій клітині і у разі вилучення зі свого оточення стають дуже нестійкими і не можуть функціонува- ти достатньо тривалий термін. По-друге, ферменти, як правило, є гомогенними каталізаторами, що дуже незручно з технологічної то- чки зору, оскільки такий каталізатор важко відокремити від продук- тів реакції і використати знову. По-третє, деякі хіміко-технологічні процеси бажано проводити за підвищеної температури, наприклад, для того, щоб не допустити забруднення продуктів синтезу (особли- во лікарських препаратів) мікрофлорою; проте з підвищенням тем- ператури стабільність ферментів катастрофічно знижується. Окрім того, дуже часто потрібні органічні речовини можна одержувати з ви- соким виходом лише в тому випадку, коли реакція йде виключно в се- редовищі органічного розчинника. Але в цих умовах звичайні фер- менти також не здатні нормально працювати і швидко втрачають каталітичну активність. З цього випливає, що фермент, виділений із живої клітини, потребує значного вдосконалення.
За останні 15–20 років проблему вдалося розв’язати, і ферменти стали повноправними компонентами технологічних схем виробницт- ва. Це було досягнуто шляхом розвитку методів іммобілізації ферме- нтів, тобто фіксації їх на якихось нерозчинних матеріалах, які запобі- гають руйнуванню ферментів, збільшують термін їхньої дії, перетво- рюють їх у гетерогенний каталізатор (наприклад, у вигляді зерен).
Під іммобілізацією розуміють таку процедуру, внаслідок якої молекула ферменту тим чи іншим способом прикріплюється до пев- них об'єктів (носіїв), нерозчинних у воді (англ. immobilis – нерухо- мий). Ці об'єкти разом із ферментом легко відокремлюються від розчину після завершення реакції. Хімічне «пришивання» ферменту до носія закріплює конформацію ферменту, що й є причиною підви- щення стійкості та зниження лабільності.
Іммобілізовані ферменти є начебто моделлю структурно орга- нізованих у клітині ферментів (мембрана – це та ж нерозчинна осно- ва для сполучення із ферментом).
150
