
voronina
.pdfПриблизно в 70-х рр. XX ст. на стику певних хімічних і біологіч- них дисциплін сформувався новий науково-інженерний напрямок: інженерна ензимологія (найважливіший розділ біотехнології), стрі- мкий розвиток якої зумовив створення нових типів гетерогенних біоорганічних каталізаторів – іммобілізованих ферментів.
Ферменти і ферментні системи традиційно застосовуються в най- різноманітніших галузях практичної діяльності: у харчовій, фармацев- тичній, текстильній, хутровій, шкіряній та інших галузях промисловос- ті, у медицині, сільському господарстві, органічному синтезі, хімічно- му аналізі. Останніми роками ферменти стали застосовувати для здійснення таких реакцій органічної хімії, як окислення, відновлення, метилювання, ацетилювання, дезамінування, декарбоксилювання, де- гідратація, конденсація для поділу і відокремлення ізомерів тощо. Вже зараз стало очевидним, що застосування біокаталізу в тонкому органічному синтезі відкриває шлях до безвідходних і низькотемпера- турних процесів, які протікають до того ж у неагресивних середови- щах. Немає сумнівів, що впровадження біокаталітичних процесів у хі- мічну технологію неминуче сприятиме економії сировини й енергії, зменшенню шкоди, якої сучасна промисловість завдає навколишньому середовищу. Оволодіння тонкими механізмами дії ферментів, без сумніву, надасть необмежені можливості одержання у величезних кі- лькостях і з великою швидкістю корисних речовин у лабораторних і заводських умовах майже зі 100% виходом.
Таке широке застосування ферментів сприяло налагодженню промислового їх одержання у великих кількостях. Сировиною для цього служать тканини різних рослин і тварин, але найчастіше – мік- роорганізми, які вирощують на селективних середовищах. Окрім то- го, мікроорганізми швидко накопичують свою біомасу, тому для їх культивування можуть бути використані дешеві поживні середови- ща. Наприклад, методами селекції, мутагенезу та генної інженерії вдалося одержати штами різноманітних видів бактерій, що проду- кують ті чи інші ферменти в значних кількостях: іноді з виходом по- над 50% від загальної маси клітинного білка.
Таким чином, іммобілізовані ферменти – це штучно одержа- ний комплекс ферменту з нерозчинним у воді носієм. Однак, по- няття «іммобілізація» необхідно розуміти ширше, тобто як будь- яке обмеження свободи руху білкової молекули ферменту в прос- торі. Окрім зв'язування з нерозчинним носієм, цього можна також досягти, наприклад, шляхом внутрішньомолекулярної або міжмо- лекулярної «зшивки» білкових молекул ферменту низькомолекуля- рними біфункціональними реагентами або ж приєднанням ферме- нту до розчинного полімеру (рис. 48).
Іммобілізація здійснюється шляхом фізичної адсорбції фермен- тів на нерозчинному матеріалі; включенням ферментів до комірок гелю, а також ковалентним зв'язуванням ферменту з нерозчинним матеріалом або молекул ферменту між собою з утворенням нероз- чинних поліферментних комплексів. Як адсорбенти використовують скло, силікагель, гідроксиапатити, целюлозу та її похідні, хітин, дек-
151

страни та ін. Для включення ферменту до комірок гелю використо- вують різноманітний гелеутворюючий матеріал, найчастіше поліак- риламідний гель. Як матеріал для ковалентного зв'язування ферме- нтів застосовують поліпептиди, білки, похідні стиролу, поліакрила- мід, нейлон, різні похідні целюлози, крохмаль, агар, агарозу, а також скло, силікагель тощо. При ковалентному зв'язуванні ферменти зна- ходяться на хімічному поводку біля нерозчинного носія.
При іммобілізації ферментів використовують ті ж самі принци- пи, що і при афінній хроматографії. Афінна хроматографія ґрунту- ється на біоспецифічній взаємодії біополімеру, що виділяється, або групи полімерів із певною речовиною. Цей вид хроматографії засто- совується до ферментів, імуноглобулінів, рецепторних білків, які здатні вибірково за типом комплементарності зв'язуватися із субстра- тами, рецепторами, антигенами, інгібіторами, кофакторами. Прин- цип цього методу хроматографії полягає в тому, що на нерозчинно- му носії закріплюють речовину, здатну специфічно зв'язуватися з біл- ком, що виділяється, зокрема, ферментом. Цю речовину називають лігандом. Оброблений таким чином носій (адсорбент) розміщують у колонці і через неї пропускають суміш білків. З адсорбентом зв'язу- ється тільки той білок, який має спорідненість зі специфічним ліган- дом (рис. 49). Потім білок знімають із колонки розчином, що викли- кає дисоціацію комплексу, який утворився між білком і лігандом.
Рис. 48. Різні способи іммобілізації ферментів: «зшивка» білкового ланцюга (а); приєднання молекули ферменту до поверхні інертного носія (б); включення в пористу матрицю (в)
152
Під час одержання іммобілізованих ферментів вживають усіх за- побіжних заходів для збереження активності ферменту. Іммобілізова- ні ферменти, як правило, менш активні, ніж вільні, оскільки зв'язуван- ня з носієм послаблює індукційний ефект і контакт із субстратом.
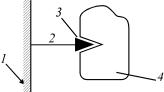
Рис. 49. Схема методу афінної хроматографії:
1– носій (матриця); 2 – «ніжка»; 3 – ліганд; 4 – білок (фермент)
Упорівнянні з нативними попередниками іммобілізовані фер- менти мають ряд переваг у разі їхнього використанні з прикладною метою.
По-перше, іммобілізований фермент як гетерогенний каталізатор можна легковилучити зреакційногосередовища, щодаєможливість:
–зупинити в потрібний момент реакцію;
–іще раз використати каталізатор;
–одержати продукт, не забруднений ферментом, що є особливо важливим для харчового і фармацевтичного виробництва.
По-друге, використання гетерогенних каталізаторів дозволяє
здійснювати ферментативний процес безперервно, наприклад, у про- точних колонках, і регулювати швидкість реакції, яку каталізують, а також вихід продукту шляхом зміни швидкості потоку.
По-третє, іммобілізація або модифікація ферменту сприяє ціле- спрямованій зміні властивостей каталізаторів, у тому числі його специфічності, залежності каталітичної активності від рН, іонного складу та інших параметрів середовища, і, що дуже важливо, його стабільності стосовно різного роду денатуруючих впливів.
По-четверте, іммобілізація ферментів дає можливість регулю- вати їхню каталітичну активність шляхом зміни властивостей носія під впливом деяких фізичних факторів (світло, звук та ін.). На цій основі створюються механіко-звукочутливі датчики, посилювачі сла- бких сигналів і безсрібляні фотографічні процеси.
Основні вимоги, яким мають відповідати носії:
–висока хімічна і біологічна стійкість;
–висока механічна міцність;
–достатня проникність для ферменту і субстратів;
–висока пористість;
–можливість одержання у вигляді зручних у технологічному від- ношенні форм (гранул, мембран, труб, листів і т.ін.);
–легке переведення в реакційно-здатну форму (активація):
–висока гідрофільність, яка забезпечує можливість проведення реакції зв'язування ферменту з носієм у водному середовищі;
–невисока вартість.
153
Як носії для іммобілізації ферментів білки використовують під час фундаментальних біохімічних досліджень, а також з практичною метою, особливо у медицині. Із точки зору практичного значення ва- жливими властивостями білкових носіїв є висока місткість відносно ферментів, здатність до біодеградації, а також можливість застосу- вання деяких із них (завдяки фібрилярній природі), у вигляді тонкої (товщиною 80 мкм) плівки (мембрана). Іммобілізацію на білкових но- сіях можна проводитиі увідсутності, і уприсутності зшиваючих агентів.
До недоліків білків як носіїв медичних препаратів для викорис- тання їх in vivo слід віднести високу імуногенність (виняток станов- лять колаген та фібрин).
Найчастіше як носії використовуються структурні білки (кера- тин, фіброїн, колаген); рухові білки (міозин), а також транспортні бі-
лки, наприклад, сироватковий альбумін.
Природні носії-ліпіди. Питання щодо білок-ліпідних взаємодій давно привертають увагу дослідників, оскільки in vivo більшість фе- рментативних реакцій протікають поблизу або на поверхні біомемб- ран – білок-ліпідних утворень. Тому іммобілізація ферментів на природних ліпідних носіях (конструювання ансамблів білок–ліпід) може розглядатися як найоптимальніше наближення до умов функ- ціонування ферментних систем у живій клітині.
Для такої іммобілізації, як правило, використовуються природні ліпіди – компоненти біомембран (фосфатидилхолін, фосфатидил- етаноламіни, холестерин та ін.). Ліпідні носії застосовуються у вигляді моношарів на різних поверхнях або бішарів (як правило, сферичної форми – ліпосоми). Зазвичай ліпідні носії використовуються у вигляді моношарів на твердих поверхнях, наприклад, сілікагелі, аеросилі. Для приготування ліпосом найчастіше використовують фосфатидилхолін (лецитин), кардіоліпіни, сфінгомієліни. Ліпосоми – це бульбашки роз- міром від 20–30 нм до 1–2 мкм, отримані з різних природних або син- тетичних фосфоліпідів. Розміщені усередині ліпосом ферменти захи- щені від швидкого руйнування протеїназами організму, тому знахо- дяться в ньому відносно тривалий час, виявляючи свою відповідну дію.
Дуже перспективною є галузь утворення багатоферментних сис- тем (за типом поліферментних систем в організмі), закріплених на одному й тому ж носії, у безпосередній близькості один від одного. При цьому іммобілізуються два або декілька ферментів, які працю- ють послідовно, їх активні центри певним чином орієнтовані віднос- но один до одного. Таким шляхом вдається значно збільшити ефек- тивність їх роботи: проміжні продукти, які утворюються під дією од- ного ферменту в такій системі відразу ж потрапляють на інший фе- рмент. Це є особливо важливим, коли проміжні продукти нестійкі та легко руйнуються в навколишньому середовищі: у такій системі вони не виходять назовні, а відразу ж перероблюються.
154
Можна навести низку прикладів, які свідчать про великі можли- вості інженерної ензимології в різних галузях промисловості, меди- цини, сільського господарства. Зокрема, іммобілізовану -гaлaкто- зидaзy (фермент, який розщеплює лактозу до глюкози й галактози), приєднану до магнітного стрижня-мішалки, використовують для зменшення вмісту лактози в молоці, і таким чином вирішують про- блему нестерпності до лактози в деяких людей. Оброблене таким чином молоко в замороженому вигляді зберігається значно довше і не піддається загусненню. За допомогою ферментативної технології отримують продукти харчування, зокрема вуглеводи (крохмаль та глюкозу) із целюлози та ін.
У медичній практиці застосовується препарат «Дальцекс-три- псин», який являє собою лікарську форму трипсину, іммобілізовано- го на диальдегідцелюлозі і має пролонговану протеолітичну дію, за- стосовують для очищення гнійних ран та поліпшення процесу їх ре- генерації. Інший препарат трипсину – «Пакс-трипсин» є іммобілізо- ваним трипсином на полотні трикотажного поліаміду; його викори- стовують як матеріал для перев'язок.
Фармпрепарат «Стрептодеказа», створений на основі іммобілі- зації препарату «Стрептокіназа» (який має тромболітичну актив- ність) на водорозчинній матриці полісахаридної природи, здатний до тривалого існування в системі кровообігу, забезпечуючи пролон- говану фібринолітичну дію в крові протягом 48–72 год. «Стрептоде- каза» з успіхом застосовується при тромбозах, інфаркті міокарда то- що, має перевагу перед стрептокіназою і фібринолізином, які швид- ко руйнуються після введення в організм. Після введення стрепто- декази, якщо це зробити вчасно, тромб майже безслідно зникає.
Моделювання за допомогою інженерної ензимології процесу фотосинтезу з використанням іммобілізованих ферментів, кофакто- рів тощо має велике майбутнє.
Нині здійснюються роботи з іммобілізації не тільки ферментів, але і кофакторів, гормонів, інгібіторів та інших біологічно активних лікувально-профілактичних засобів з метою доставки їх в організм при захворюваннях, пов'язаних із їх недостатністю або відсутністю. Це усуває дефіцит деяких ферментів в організмі; видаляє вже відме- рлі денатуровані структури через дію, головним чином, протеоліти- чних ферментів (зокрема, трипсину та хімотрипсину); забезпечує лі- зіс тромбів, детоксикацію організму і т.ін. Іммобілізовані ферменти почали використовуватися в спеціальних колонках для перфузії (очищення) крові типу «штучна нирка», «штучна печінка». Із лікува- льною та діагностичною метою використовують іммобілізовані фе- рменти та інші речовини, введені в напівпроникні (наприклад, полі- амідні) мікрокапсули розміром приблизно 200 ммк. У таких напів- проникних капсулах ферменти відносно довго зберігаються і чинять відповідну дію на певні органи, до яких капсула заноситься током
155

крові, тобто певною мірою забезпечується ще й спрямовна доставка ферментів за місцем призначення.
Іммобілізовані ферменти застосовуються для отримання амі- нокислот, гідроксикислот, а також природних речовин із дуже склад- ною структурою, наприклад, стероїдів, порфіринів, алкалоїдів, прос- тагландинів, антибіотиків тощо.
Амінокислоти використовують у медицині, сільському госпо- дарстві, прикладній мікробіології і в багатьох галузях науки. Вони необхідні як компоненти харчування при недостатності якої-небудь із природних, особливо незамінних амінокислот, як складова частина внутрішньовенного харчування хворих, для створення лікарських і біологічно активних сполук і т.ін.
Усі амінокислоти засвоюються організмом тільки в L-формі (за виняткомметіоніну), анадходженнядоорганізмуD-формиєнебажаним.
Нижче подано схему безперервного потоку отримання L-аміно- кислоти L-аланіну та регенерації коферменту в модельній системі, куди вихідний субстрат (молочна кислота) подається за допомогою насоса в камеру-реактор, який містить іммобілізовані на декстрані НАД+ та дві НАД-залежні дегідрогенази: лактат- і аланіндегідроге- нази. Із протилежного кінця реактора продукт реакції L-аланін вида- ляється із заданою швидкістю методом ультрафільтрації:
Подібні реактори знайшли застосування у фармацевтичній про- мисловості, наприклад, під час синтезу глюкокортикоїдного препа- рату преднізолону з гідрокортизону.
Не менш важливим напрямком для медицини є іммобілізація клі- тин. Як приклад медичного використання досягнень біотехнології мо- жна навести іммобілізацію клітин щитовидної залози для визначення тиреотропного гормону в біорідинах або тканинних екстрактах, отри- маних з організму; введення -клітин підшлункової залози в організм при діабеті та ін. За допомогою іммобілізованих ферментів здійсню- ється не тільки промисловий синтез ряду фармпрепаратів, але й розро- блені високочутливі методи аналізу ліків, експрес-аналіз біологічних компонентів (автомати для аналізу крові, сечі). Ферменти значно
156
спрощують аналіз крові: якщо для біохімічного аналізу необхідно взяти цілу пробірку крові, то створений останніми роками імуноферментний метод аналізу на базі іммобілізації ферментів обмежується всього одні- єюкраплеюкрові і визначаєвміст приблизно 50 речовин одразу.
Нині отримані деякі штучні каталізатори, які функціонують за принципом ферментативного каталізу. Вони отримали назву син- зимів. Окремі синзими дуже ефективні, але специфічності фермен- тів не мають.
Ферментна технологія – ще дуже молодий напрямок біотехно- логії, але в цій галузі вже є значні успіхи і в найближчому майбут- ньому тут можна чекати великих досягнень.
Значення ферментів для медицини
Роль ферментів у розвитку захворювань, їх діагностиці та ліку- ванні розглядаються в самостійному розділі біохімії – медичній фе- рментології.
Розрізняють три основних напрямки медичної ензимології: ен- зимопатологію, ензимодіагностику й ензимотерапію.
Ензимопатологія. Перш за все це спадкові захворювання, які по- в'язані із порушенням біосинтезу білків-ферментів.
Наприклад, фенілпіровиноградна олігофренія відзначається при порушенні синтезу ферменту фенілаланінгідроксилази, яка перетво- рює фенілаланін у тирозин. Це призводить до накопичення феніла- ланіну в організмі, в якому він інтенсивно розпадається з утворен- ням і накопиченням токсичних сполук (у тому числі й фенілпірови- ноградної кислоти), котрі порушують обмін речовин в організмі, особливо в мозку. У хворих дітей гальмується розумовий розвиток, виявляються психічні відхилення.
Причинами інших ензимопатій можуть стати недостатність ко- факторів, наприклад, вітамінів або їхніх похідних (аліментарна ен- зимопатія); дія токсинів, отрут, які гальмують активність ферментів (токсична ензимопатія) та деякі інші.
Ензимодіагностика. Значна роль відводиться ферментам у діаг- ностиці захворювань. Використання їх із цією метою пов'язане з тим, що кожен орган або тканина має характерний для них спектр (набір) ферментів та поява їх у крові надає змогу діагностувати патологію. Так, для серцевого м'язу серед великої групи ферментів найспецифі- чнішими є креатинкіназа (КК), аспартатамінотрансфераза (АСТ) і лактатдегідрогеназа (ЛДГ). У печінці переважає аланінамінотранс- фераза (АЛТ), ЛДГ, лужна фосфатаза (ЛФ); у скелетних м'язах – ЛДГ, КК і меншою мірою АСТ; у кістковій системі – ЛФ; у передмі- хуровій залозі – кисла фосфатаза (КФ); у підшлунковій залозі – -амі- лаза. Для ізоферментів також визначена їх локалізація.
Також причиною використання ферментів у діагностиці є те, що в організмі здорової людини підтримується стан динамічної рівно-
157
ваги між процесами анаболізму та катаболізму. Тому вміст у крові ферментів є величиною відносно постійною, а збільшення або зни- ження активності ферментів у ній свідчать про наявність патологіч- них процесів. При інфаркті міокарда відзначається суттєве збіль- шення активності АСТ, КК, ЛДГ-1, при захворюванні печінки збіль- шується активність АЛТ, альдолази, ЛДГ-4 та ЛДГ-5; при запальних процесах у підшлунковій залозі характерне підвищення активності-амілази; при пухлинах у кістковій системі – зростає активність ЛФ, рак простати супроводжується збільшенням КФ.
Вихід ферментів у кров відбувається не тільки при деструкції клітин, але і при підвищенні проникності клітинних мембран. Це відзначається, як правило, на самому початку розвитку патологічно- го процесу, часто до розвитку клінічної картини. Цей факт ще більше підкреслює значення ферментної діагностики. Так, активність КК збільшується через 2–4 год, АСТ – через 4–6 год після інфаркту міо- карда; активність -амілази зростає в декілька разів через 3 год піс- ля початку приступу гострого панкреатиту; активність амінотранс- фераз і ЛДГ значно збільшуються ще в доклінічний період гострого інфекційного гепатиту, коли інші ознаки захворювання відсутні і т.д.
Відзначено пряму залежність між активністю ферментів та кіль- кістю пошкоджених клітин: чим вища активність ферменту, тим бі- льша зона пошкодження тканини, а зниження його активності свід- чить про обмеження некротичного осередку і є також тестом до одужання. Так, наприклад, при гострому гепатиті, який характеризу- ється дифузним характером запального процесу, активність АЛТ у крові зростає в 50–100 разів порівняно із нормою, і утримується на цьому рівні протягом 2–3 тижнів, а при одужанні наближається до норми. У той же час при інфаркті міокарда, що представляє собою ураження обмеженої ділянки серцевого м'язу, активність КК і АСТ у крові досягає максимуму на 3–5 добу, після чого знижується.
Отже, показник визначення активності ферментів значно допома- гає лікарю в питаннях діагностики захворювань, допомагає контролю- вати перебіг хвороби та процес реабілітації. При деяких захворюваннях (спадковиххворобах) ферменти єосновним діагностичнимтестом.
Ензимотерапія – використання ферментів як фармакологічних засобів. Лікування ферментами проводиться, в основному, при їхній недостатності в організмі (заміщувальна ензимотерапія), а також вони використовуються як допоміжні засоби в комплексній терапії різних захворювань.
Так, ферменти пепсин, трипсин, хімотрипсин, амілаза, ліпаза та інші, як у вільному стані, так і в складі різних лікарських форм, знай- шли широке застосування при шлунково-кишкових захворюваннях як препарати, що регулюють процеси травлення. Трипсин застосовуєть- ся зовнішньо для очистки гнійних ран і внутрішньом’язово як проти- запальний засіб при остеомієлітах та гайморитах; фібринолізин реко-
158
мендують для розсмоктування тромбів судин, цитохром с вживають при отруєнні чадним газом та деякими іншими отруйними сполуками, які пригнічують процеси тканинного дихання. Препарати типу тром- біну використовують для запобігання кровотечі або для її зупинки. Нуклеази використовуються під час лікування деяких вірусних захво- рювань. Наприклад, під час лікування вірусного кон’юнктивіту з успіхом використовують очні краплі, які містять ДНК-азу: фермент руйнує ДНК вірусу і таким чином виліковує захворювання.
Аспарагіназу застосовують для лікування деяких форм лейкозів. Лікування ґрунтується на тому, що амід аспарагінової кислоти – ас- парагін – є необхідним для синтезу білків у лейкозних клітинах, од- нак, він не синтезується в цих клітинах, і повинен надходити із плаз- ми. Введена в кров хворого аспарагіназа руйнує аспарагін до аміаку й аспарагінової кислоти, звідси синтез білків у лейкозних клітинах припиняється – клітини гинуть.
Препарати лідаза, ронідаза тощо, які каталізують розщеплення цементуючої речовини сполучної тканини – гіалуронову кислоту, ви- користовуються разом із іншими лікарськими засобами, що значно прискорює їхнє всмоктування та зменшує біль. Гіалуронідазу також застосовують для розсмоктування гематом при крововиливах, ексу- датів у плевральній і черевній порожнинах, рубців та ін.
Для активації діяльності певних ферментів у терапії широко ви- користовують кофактори. З лікувальною метою використовується, наприклад, кокарбоксилаза при серцевих захворюваннях, порушеннях нервової системи і в багатьох інших випадках; ФМН використовують при захворюваннях шкіри, кератитах, кон’юнктивітах, неврастенії.
У медичній практиці використовують також інгібітори фермен- тів – як специфічні препарати для лікування окремих захворювань. Так, при захворюваннях підшлункової залози (панкреатитах) для пригнічення протеїназ, які переводять, наприклад, трипсиноген у трипсин у самій тканині підшлункової залози і, тим самим, викли- кають самоперетравлювання та запалення, застосовують їхні інгібі- тори – трасилол, контрикал та ін.
Ферментологія дає можливість створювати лікарські препара- ти цілеспрямованої дії. Так, сульфаніламідні сполуки позитивно діють при кокових інфекціях. Їх дія ґрунтується на конкурентному гальмуванні, оскільки вони є аналогами субстратів, необхідних для життєдіяльності кокових мікроорганізмів. Нікотинова кислота є необхідною для розвитку туберкульозних бацил, а її структурний аналог – гідразид ізонікотинової кислоти (фтивазид) є ефективним засобом лікування туберкульозу.
Усе вищезазначене підтверджує важливість та необхідність ви- вчення ферментів із метою їх використання в медичній практиці.
Успіхи в розвитку медичної ензимології і надалі відіграватимуть усе більшу роль як у розробці високоспецифічних методів лікування
159
та профілактики захворювань, так і у створенні високоспецифічних лікарських засобів.
Аутоліз тканин і його значення для заготівлі лікарської сировини рослинного
та тваринного походження
Аутоліз, або автоліз (грецьке autos – сам, lisis – розчинення) – це самоперетравлювання тканин, воно спостерігається при відділенні органів та тканин від цілісного організму і, за відсутності процесів регуляції, відбуваються переважно катаболічні зміни. При автолізі більшість ферментів, через оборотну дію каталізу сприяють перевазі процесів катаболізму, а процес синтезу частіше має інший напрямок. Автоліз залежить від кількості та активності ферментів. Наприклад, якщо лікарська рослина на корені, у ній протікають процеси як син- тезу, так і розпаду діючих речовин (переважає, головним чином, син- тез). Якщо рослини зняти з кореня (при заготівлі сировини), діючі біологічно активні речовини можуть розпадатися, і лікарський ефект буде послабленим або відсутнім. Тому при заготівлі лікарської рос- линної сировини часто рослини сушать – цим досягається видалення води, а оскільки більшість ферментів належить до класу гідролаз, їх- ня активність при цьому зменшується; обробляють сировину спир- том, ацетоном, досягаючи при цьому зневоднення та інактивації ферментів. Останні процеси застосувуються під час отримання пре- паратів із сировини тваринного походження.
Автоліз іноді використовують для отримання різних фармпре- паратів із тканин рослин і тварин, наприклад, для отримання препа- рату алое. У рослин зривають листя (відділяють від організму), кла- дуть у темне місце при температурі 7–8 С, при цьому відзначається накопичення продуктів автолізу – так званих біогенних стимуляторів (аміни, аміди, різні органічні кислоти, азотні основи та ін.), які поси- люють більшість ланок обміну речовин та сприяють одужанню.
160
