
экзамен / TEHNIChESKAYa_TERMODINAMIKA
.pdf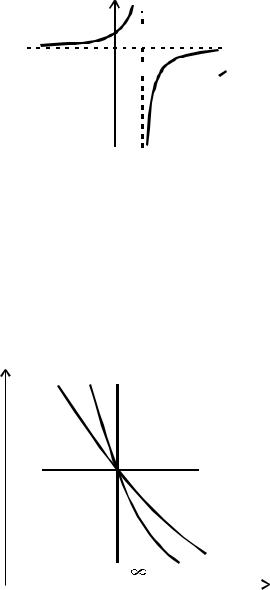
c = cv n-k/n-1 |
и |
n = c-cp/c - cv |
может быть представлена в графической форме, показывающей всё возможное многообразие политропных процессов в виде точек на двух кривых графика:
C
Cp C 

 n 0 1 K
n 0 1 K
Рисунок 2.4 Графическое выражение взаимосвязи С и n
Изображение частных процессов в p-v координатах даёт возможность судить по известному значению показателя политропы каким образом должна выглядеть политропа рассматриваемого процесса:
P
n = 0
|
|
n = 1 |
n = + |
n = k |
V |
|
|
Рисунок 2.5 Частные процессы в диаграмме p - v
Все процессы, идущие вправо от точки пересечения кривых,
соответствуют процессам |
расширения, для которых |
n может |
иметь |
любое значение от -∞ |
до +∞ , а все процессы, идущие влево от точки |
||
пересечения кривых, соответствуют процессам сжатия, для которых n |
также |
||

может иметь любое значение от -∞ до +∞ .
2.3. Расчет энтропии и ее изменений в процессах идеального газа
Любой вид энергетического воздействия характеризуется потенциалом
икоординатой. Произведение потенциала на изменение координаты выражает величину этого воздействия. Так, для процессов деформации (расширения или сжатия) газов, потенциалом является давление (р), координатой – объем (V). Для теплового воздействия потенциалом является температура (Т), координатой – энтропия (S).
Энтропия и ее изменение, как экстенсивный параметр теплового состояния, является важнейшей характеристикой, определяющей наличие и количественную меру теплового воздействия. К недостаткам ее применения относится невозможность практического определения ее величины и изменения. Однако, исходя из известных изменений других параметров системы (давление, объем, температура) в ходе протекания процессов становится возможным рассчитать происшедшее изменение энтропии. При этом возможны два способа его вычисления. В соответствии с общим принципом энергетических воздействий изменение теплового состояния выражается: δQ = TdS, тогда dS = δQ/T, или для удельных величин δq = Tds
иds = δq/T. Если известно изменение не менее двух параметров системы, то есть их начальные и конечные состояния в процессе, то расчет может производится следующим образом:
ds dq |
du dl cvdT pdv |
cvdT |
RT |
dv c |
|
dT R dv |
|
|||
v |
v |
(2.63) |
||||||||
T |
T |
T |
|
T |
|
|
T |
v |
|
|
Используя |
дифференциальную |
форму |
уравнения |
|
состояния |
|||||
dvv dpp dTT , можно получить выражения для изменения энтропии через
31

другие пары параметров:
dT |
|
dv |
|
|
|
dp |
|
|
|
dv |
cv R |
dv |
|
dp |
|
dv |
|
||||||
|
|
dv |
|
|
|
|
|
|
|
||||||||||||||
ds cv T |
R |
v |
cv |
v |
|
p |
|
R |
v |
v |
|
cv p |
cp v |
|
cv |
||||||||
|
|
dT |
|
|
|
|
dp |
|
|
cv |
R |
dT |
|
|
dp |
|
dT |
|
dp |
||||
|
|
|
dT |
|
|
|
R |
cp |
R |
||||||||||||||
|
cv |
T |
R |
|
p |
|
T |
|
p |
T |
|
p |
|||||||||||
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
||||||||
dpp
(2.64)
Интегральные формы уравнения для расчета изменения энтропии в процессах идеального газа (принимая во внимание, что теплоемкости идеальных газов зависят только от условий протекания процесса и, следовательно, ср и сv являются константами), с учетом количества вещества принимают вид:
|
|
|
|
|
|
ln |
T |
|
|
S m s m c |
v |
2 |
|||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
ln |
T |
Rln |
p |
|
|
|
|
m c |
p |
2 |
|
2 |
|
|
|
||
|
|
T |
|
p |
|
|
|
||
|
|
|
1 |
|
|
1 |
|
|
|
Rln |
v |
|
|
|
|
ln |
v |
|
c |
|
ln |
p |
|
|
|
|
2 |
|
m c |
p |
|
2 |
v |
|
2 |
|
|||||
|
v |
|
|
|
v |
|
|
p |
|
|
|||||
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
1 |
|
(2.65) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если известно значение показателя политропы процесса, то изменение энтропии может быть рассчитано через выражение теплоемкости:
ds dq cdT c |
n k |
dT |
(2.66) |
|
T |
T |
v n 1 |
T |
|
или в интегральной форме для известного количества газа:
S m s mc |
n k ln T2 |
(2.67) |
|
|
v n 1 |
T |
|
|
|
1 |
|
Используя уравнения политропных процессов расчет может быть произведен через изменение любого из параметров:
T2 |
|
|
|
n 1 |
|
T2 |
|
|
n 1 |
|
n ; T V n 1 |
T V n 1; |
|
||||||
|
p2 |
V1 |
|
||||||
T |
|
p |
|
1 1 |
2 2 |
T |
V |
2 |
|
1 |
|
1 |
|
|
|
1 |
|
|
|
32

S mc |
n k n 1ln |
p2 |
mc |
n k ln |
p2 |
mc |
n k |
n 1 ln v1 |
|
|||||
|
|
|
v n 1 |
n |
|
p |
v |
n |
p |
|
v n 1 |
v |
2 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
(2.68) |
|
|
|
n k ln v1 mc |
|
k n ln v2 |
|
|
|
|
|
|||||
mc |
v |
v |
|
|
|
|
|
|
||||||
|
|
v2 |
|
v1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
Абсолютные значения энтропии не определяются. Точку отчета, так называемую реперную точку, принимают при расчете процессов идеального газа соответствующей нормальным физическим условиям. То есть при рн =760 мм рт.ст. = 1,01325 бар и tн = 0оС, Tн = 273,15оК, S = О. Тогда знание двух параметров состояния газа позволяет рассчитать значение энтропии:
|
|
ln |
T |
|
Rln |
|
P |
|
|
|
|
ln |
v |
c |
|
ln |
P |
|
|
|||
S m s m c |
p |
273,15 |
|
|
|
m c |
p |
v |
|
v |
|
|
||||||||||
|
|
|
|
|
1,01325 |
|
|
|
н |
|
|
1,01325 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.69) |
|
|
|
|
|
|
|
ln |
T |
Rln |
v |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
m c |
v |
273,15 |
v |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
Два последних выражения требуют определения объема, приведенного к нормальным условиям (по уравнению состояния или уравнению объединенного газового закона), поэтому предпочтение в расчетах отдается, обычно, первому выражению. Диаграмма Т – s, как тепловая диаграмма, дает наглядное представление о характере протекания процесса, как по изменению энтропии, так и отвода или подвода тепла и их количеству, особенно, при определении этих величин в сравниваемых процессах.
2.4. Анализ процессов по диаграммам P-v и T-s
Для политропного процесса с заданным или установленным показателем политропы может быть осуществлен анализ, как до расчета, так и после проведения вычислений, на основе представления его в диаграммах P-v
и T-s.
Численное значение показателя политропы определяет все особенности
33

протекания процесса; его теплоемкость, характер изменения параметров, вид политропы в диаграммах, знаки термодинамических величин процесса, то есть подвод или отвод теплоты, работу расширения или сжатия, увеличение или уменьшение внутренней энергии и точные соотношения между этими величинами.
Основанием для такого анализа является сравнение рассматриваемого процесса, его политропы, с изображением частных процессов, то есть протекающих при постоянстве термодинамических параметров, которые отделяют в диаграммах P-v и T-s характерные зоны по знакам термодинамических величин.
Обращение к обеим диаграммам дает наглядную и полную картину, как для конкретного рассматриваемого процесса, так и для всех возможных процессов.
На представленных диаграммах показаны зоны для процессов расширения при работе l ≥ 0 и процессов сжатия при l ≤ 0: с подводом теплоты q ≥ 0 или отводом q ≤ 0, увеличением внутренней энергии u ≥ 0 или уменьшением u ≤ 0.
p |
|
|
|
|
T |
|
|
|
|
|
I |
|
|
|
|
|
V VI |
|
|
V |
VI |
|
|
|
|
|
q 0 |
|
|||
|
|
|
|
l 0 |
I |
|
|
|
|
u 0 |
|
|
|||
IV |
|
|
u 0 |
|
n=1 |
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
q 0 |
u 0 |
|
|
|
IV |
u 0 |
l 0 |
|
|
|
n=1 |
|
|
||
|
|
|
II |
|
|
|
|
|
III |
|
n= ∞ III |
II |
|
||
|
n=к |
|
|
||||
|
n= ∞ |
|
v |
|
n=к |
s |
|
l 0 |
|
l 0 |
q 0 |
q 0 |
|||
Рисунок 2.6 Разделение политропных процессов на зоны по особенностям энергетики в диаграммах P-v и T-s.
Представленные изображения показывают, что как в процессах расширения, так и в процессах сжатия можно выделить по три зоны.
34
Область расширения:
I. n = - ∞ ÷ 1 q > 0; ∆u ≥ 0; l ≥ 0;
процессы с подводом теплоты, идущей на совершение работы и увеличение внутренней энергии; по мере увеличения n, уменьшается количество теплоты на увеличение внутренней энергии и увеличивается количество теплоты на внешнюю работу.
П. n = 1 ÷ к q ≥ 0; ∆u ≤ 0; l > 0;
процессы с подводом теплоты и уменьшением внутренней энергии за счет процесса расширения; с увеличением n увеличивается роль внутренней энергии или уменьшается роль теплоты; поскольку, несмотря на подвод теплоты, температура газа уменьшается, теплоемкость процесса принимает отрицательные значения.
Ш. n = к ÷ + ∞ q ≤ 0; ∆u < 0; l ≥ 0
процессы расширения идут с отдачей теплоты и уменьшением внутренней энергии; с увеличением n уменьшается доля теплоты, идущая на работу и увеличивается доля теплоты, вызывающая уменьшение внутренней энергии.
Область сжатия:
IV. n = - ∞ ÷ 1 q < 0; ∆u ≤ 0; l ≤ 0;
процессы сжатия с отводом теплоты и уменьшением внутренней энергии; с увеличением n увеличивается работа сжатия, возрастает отвод теплоты и снижается уменьшение внутренней энергии.
V. n = 1 ÷ к q ≤ 0; ∆u ≥ 0; l < 0;
процессы сжатия идут с отводом теплоты и увеличением внутренней энергии; с увеличением n возрастает доля работы, идущая на увеличение внутренней энергии и уменьшается доля отводимого тепла; поскольку, несмотря на отвод теплоты, температура газа повышается, теплоемкость процессов принимает отрицательные значения.
VI. n = к ÷ + ∞ q ≥ 0; ∆u > 0; l ≤ 0;
35
процессы сжатия сопровождаются подводом теплоты и увеличением внутренней энергии, которая растет как за счет теплоты, так и за счет затрачиваемой работы; с увеличением n уменьшается роль работы и ее величина и растет подводимая теплота.
Таким образом, для рассматриваемого процесса с заданным или рассчитанным значением n имеется возможность, установив конкретную из рассмотренных зон, определить с помощью диаграмм P-v и T-s все условия по изменению параметров и по энергетике процесса.
36

3. ЦИКЛЫ
Цикл – совокупность термодинамических процессов, в результате которых рабочее вещество приходит в первоначальное состояние, то есть представляет собой круговой процесс.
Циклы имеют огромное практическое и теоретическое значение. На основе циклов работают многие машины и аппараты. Циклы являются одним из основных методов термодинамического анализа процессов, работы различных устройств и энергетических превращений.
Различают прямые и обратные циклы. Прямые циклы позволяют получить полезную работу, в обратных циклах работа затрачивается.
Прямой цикл. Причина получения полезной работы в прямом цикле обусловлена тем, что работа, как и подведенная теплота, есть функции процесса. Проводя круговой процесс таким образом, что линия расширения будет расположена над линией сжатия, получают большую величину работы, чем затрачена на сжатие. Разность между этими величинами представляет выигрыш в работе – полезную работу цикла Lп. Осуществление такого цикла соответствует протеканию процессов по направлению часовой стрелки. Процесс расширения сопровождается подводом тепла – Q1, процесс сжатия отводом тепла – Q2.
Рисунок 3.1 Прямой термодинамический цикл получения работы в диаграмме р-v
37

На основе уравнения первого закона термодинамики, нетрудно убедиться, что полезная работа получена за счет разности между количествами подведенной и отведенной теплоты, поскольку изменение внутренней энергии за цикл равно нулю:
|
|
δQ = dU + δL; |
|
|
|
|||||
dU = 0 |
δQ = δL |
|
(3.1) |
|||||||
|
|
|
Lп = Q1 – Q2 |
|
|
|
||||
Для характеристики эффективности превращения теплоты в работу |
||||||||||
введено понятие коэффициента полезного действия – |
отношения полезной |
|||||||||
работы цикла к подведенной теплоте: |
η |
L |
|
|
Q1 |
Q |
2 |
(3.2) |
||
п |
|
|
||||||||
|
|
|
|
Q1 |
|
|
Q |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
или через удельные величины |
|
|
|
|
|
|
|
|
|
|
|
l |
|
q q |
2 |
|
|
|
|
|
|
η |
|
п |
1 |
|
|
|
|
|
(3.3) |
|
|
|
|
|
|
|
|
||||
|
q |
q |
|
|
|
|
|
|
||
|
|
1 |
|
1 |
|
|
|
|
|
|
По прямому круговому процессу работают различные машины для получения работы: двигатели внутреннего и внешнего сгорания, паровые и газовые турбины и др.
Обратный цикл. Проведение кругового процесса в обратном направлении, то есть против часовой стрелки, соответствует бóльшей работе, затрачиваемой на сжатие, и меньшей работе, получаемой в результате расширения. Линия расширения лежит под линией сжатия. Такой цикл позволяет передавать тепло с меньшего температурного уровня на более высокий, что возможно только при условии затраты работы.
По обратному круговому процессу работают холодильные установки. Для характеристики эффективности их работы используют холодильный коэффициент, представляющий отношение количества получаемого холода к затраченной работе:
38

ε Q2 |
Q2 |
|
q2 |
|
q2 |
(3.4) |
|
Lз |
Q Q |
2 |
l |
з |
|
q q |
2 |
|
1 |
|
|
1 |
|||
Рисунок 3.2 Обратный термодинамический цикл с затратой работы в диаграмме р-v
По обратному круговому процессу работают также тепловые насосы и компрессоры – машины для сжатия газов.
В виде циклов можно представить работу многих машин и аппаратов и любые энергетические превращения (химические реакции, фазовые превращения, поверхностные явления и другие) и на этой основе произвести их термодинамический анализ. Причем, разомкнутые циклы можно условно принимать за замкнутые, если начальные состояния рабочего тела имеют определенные постоянные параметры.
Такой анализ позволяет выявить основные энергетические величины и характеристики процессов, эффективность их, установить основные закономерности, найти резервы повышения экономичности.
Таким образом, циклы представляют особый прием - метод термодинамического анализа.
39
