
экзамен / TEHNIChESKAYa_TERMODINAMIKA
.pdf6. ЭКСЕРГЕТИЧЕСКИЙ МЕТОД АНАЛИЗА
Второй закон термодинамики показывает, что энергию необходимо разделять на способную совершать работу и неработоспособную. Работоспособную энергию принято называть эксергией. Эксергия – энергия любого вида, способная к превращению в любые другие виды энергии, а, следовательно, и в механическую работу.
Все реальные процессы ведут к снижению работоспособности, к переходу эксергии частично или полностью в неработоспособную энергию, в теплоту с температурой окружающей среды, которую называют анергией. Теоретически все формы энергии, кроме теплоты, полностью работоспособны. Теплота обладает работоспособностью только в том случае, если температура системы или рабочего тела отличается от температуры окружающей среды, причем работоспособной является только часть этой теплоты. Величина эксергии системы зависит от параметров окружающей среды. Различают физическую и химическую эксергии.
С экономических позиций ценность представляет только работоспособная энергия, то есть эксергия. Анализ процессов и работы установок на основе учета изменений в работоспособности систем, учета потерь работоспособной энергии представляет наиболее современный и точный метод анализа – эксергетический метод. Этот метод позволил определять и рассчитывать качественные изменения энергии при протекании процессов, позволил ввести новые характеристики эффективности работы различных установок, машин, аппаратов – эксергетические коэффициенты полезного действия.
6.1.Расчет эксергии и ее изменения в процессах
Рассматривая газ как простую термомеханическую систему, можно
60
установить, что она будет обладать способностью совершать работу, то есть обладать эксергией, только в том случае, если ее параметры – потенциалы: давление или температура отличаются от давления и температуры окружающей среды, несмотря на то, что выше или ниже они соответствующих параметров среды.
Аналитические выражения для эксергии и ее изменения могут быть получены, исходя из подведенной теплоты. Выражение теплоты по второму уравнению первого закона термодинамики позволяет оценить энергетические процессы во взаимосвязи с окружающей средой, поскольку входящая в уравнение располагаемая работа lо имеет место в открытых термодинамических системах и связана с вводом или выводом рабочих тел, то есть с потоком вещества:
dq = di – vdp; -vdp = dlo; dq = di + dlo
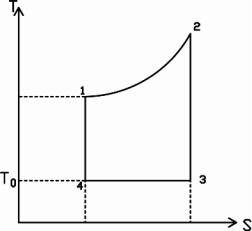
Величину подведенной к системе теплоты выражает площадь под линией процесса 1-2 в Т-s координатах (рис.1).
Рисунок 6.1 Эксергия и анергия подведенной теплоты в Т – s координатах
Максимальное количество теплоты из всей подведенной, которое можно перевести в работу, представляет площадь цикла, в котором тепло отводится при минимальной возможной температуре, то есть при температуре
61

окружающей среды То. Эта величина является эксергией подведенной теплоты. Остальная часть тепла представляет неработоспособную энергию – анергию, подсчитать которую можно как произведение изменения энтропии рабочего тела на температуру То. Расширяя пределы уравнения на неравновесные необратимые процессы, изменения энтропии можно представить по второму закону термодинамики:
ds ds |
p |
ds |
н |
dq |
ds |
н |
(6.1) |
|
|
T |
|
|
где dsp – изменение энтропии равновесного процесса, связанное с подводом или отводом тепла, dsн – изменение энтропии из-за явлений необратимости реальных процессов.
Тогда анергия выразится как:
Т |
|
ds T |
dq |
T ds |
|
(6.2) |
|
о |
o |
T |
o |
н |
|
Вычитание из подведенной теплоты величины анергии дает эксергию подведенного тепла:
dq T |
dq |
T ds |
|
di dl |
|
T ds |
(6.3) |
||
o |
T |
o |
|
н |
|
o |
o |
|
|
T To |
dq T ds |
|
|
di T ds dl |
|
(6.4) |
|||
T |
|
o |
н |
o |
|
|
o |
|
|
Для равновесных обратимых процессов:
ds |
|
0 ; |
T To dq di T ds dl |
|
(6.5) |
|
|
н |
|
T |
o |
o |
|
Уравнение показывает, что эксергия подведенного тепла может пойти на совершение работы dlo и на изменение состояния системы, то есть на изменение ее эксергии:
dex = di - Tods |
(6.6) |
Полученная аналитическая зависимость выражает изменение удельной эксергии через изменение термодинамических функций.
В интегральной форме:

ex = |
i – To s |
(6.7) |
|
или для определенного количества вещества: |
|
|
|
Ex = m. ex = m( i - ToΔs) = I - To S = Ex2 – Ex1, |
(6.8) |
||
Подсчет изменения |
эксергии относительно |
состояния |
равновесия |
системы с окружающей средой, когда i = io и s = so и система, следовательно, не обладает эксергией, дает значение эксергии системы в данном состоянии:
ex = (i – io) – To(s - so) |
(6.9) |
для заданного количества вещества: |
|
Ex = mex = m[(i - io) – To (s -so)]. |
(6.10) |
Таким образом, эксергия – функция состояния при заданных условиях окружающей среды.
Расчетные формулы для идеального газа могут быть представлены на основе известных выражений изменения энтальпии и изменения энтропии:
i c |
p |
T c |
p |
T |
T |
; s c |
p |
ln T2 |
Rln P2 |
(6.11) |
|||||
|
|
2 |
1 |
|
|
|
|
T1 |
|
P1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Тогда изменение эксергии: |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ех = m ех = m[ср(Т2 – Т1) – То (ср ln Т2/Т1 - R ln Р2/Р1)] |
(6.12) |
||||||||||||||
и эксергия для любого состояния: |
|
|
|
|
|
|
|
|
|||||||
Ех = mех = m[ср(Т – То) – То (ср ln Т/То - R ln Р/Ро)] |
(6.13) |
||||||||||||||
Общее балансовое уравнение для эксергии в реальных необратимых |
|||||||||||||||
процессах имеет вид: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T To dq dex dl |
|
|
T ds |
|
|
(6.14) |
|||||||
|
|
T |
|
|
|
|
|
o |
|
|
o |
н |
|
|
|
или в интегральной форме: |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
T To dq ex |
|
ex |
l |
|
|
T s |
|
(6.15) |
|||||
|
|
T |
|
|
|
2 |
1 |
|
|
o |
o |
|
н |
|
|
где То sн – потери эксергии системы из-за необратимости.
63

6.2. Эксергетический КПД
Работа термомеханической системы, в соответствии с балансовым эксергетическим уравнением, может быть совершена за счет эксергии подведенного тепла и за счет эксергии самой системы.
В условиях равновесных обратимых процессов (ΔSн = 0) работа системы максимальна:
l |
2T T |
ex |
|
(6.16) |
||
|
|
o dq ex |
||||
o, p |
1 |
T |
1 |
2 |
|
|
|
|
|
|
|
||
В реальных процессах в соответствии со вторым законом термодинамики происходят потери эксергии или работоспособности системы вследствие явлений необратимости
l |
|
2T T |
ex |
|
T S |
|
(6.17) |
||
o |
|
|
o dq ex |
2 |
н |
||||
|
1 |
T |
1 |
|
o |
|
|||
|
|
|
|
|
|
|
|
||
Величина потерь может быть определена двумя способами: на основе подсчета изменения энтропии из-за необратимости:
lo, н To sн |
(6.18) |
или на основе сопоставления полученной работы с максимально возможной для данной системы работы при равновесных обратимых процессах:
lо,н = lо,р - lo (6.19)
Отношение величины полученной работы к максимально возможной, отражающее потери эксергии вследствие необратимости процесса, получило название эксергетического КПД. Введение такого КПД для тепловых процессов, выделяя работоспособную часть теплоты, позволяет оценивать ее равным образом как и другие работоспособные формы энергии:
η |
|
|
|
lo |
1 |
2 T To |
To sн |
|
|
|
(6.20) |
|
|
ex |
|
l |
|
|
|
1 |
ex |
2 |
|
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
o, p |
|
|
T |
dq ex |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
64

В обратимых равновесных процессах η ех = 1.
Потеря полезной работы или эксергии связана с тем, что некоторая доля работоспособной энергии передается в виде избыточного тепла теплоприемнику (окружающей среде) или остается внутри системы в виде неиспользованного тепла.
В зависимости от рассматриваемых типов процессов, установок или машин выражение эксергетического КПД может видоизменяться. Так для
систем совершающих работу за счет собственной эксергии: |
|
||||
η |
|
|
lo |
|
(6.21) |
|
ex |
|
ex |
|
|
для теплообменных аппаратов |
|
|
|
||
|
|
|
Exп |
|
|
|
ηex - Ex |
т |
(6.22) |
||
|
|
|
|
|
|
где Ехп – увеличение эксергии вещества получающего тепло; |
Ехт – |
||||
уменьшение эксергии теплоносителя отдающего тепло. |
|
||||
Возможность оценивать совершаемую работу или энергетический эффект по отношению к эксергии системы позволяет наглядно представлять устранимые и неустранимые потери энергии и вскрывать резервы повышения экономичности процессов или работы установок.
65
7.РЕАЛЬНЫЕ ГАЗЫ
7.1.Параметры и термодинамические функции реальных газов
Отличия реального газа от идеального, заключающиеся в наличии сил
взаимодействия между молекулами и в учёте собственного объема молекул, которые для идеальных газов не принимались во внимание, приводят к ряду особенностей в их состояниях и процессах. Это выражается, прежде всего, в наличии потенциальной части внутренней энергии, в изменении уравнения состояния, в зависимости теплоёмкости от температуры и давления и в переходе реальных газов при определённых термодинамических параметрах в жидкое и твёрдое состояние. В состояниях далёких от сжижения (высокие температуры и низкие давления) реальные газы ведут себя как идеальные, что позволяет рассматривать процессы во многих машинах, системах, аппаратах с учётом этой особенности, приводящей к существенным упрощениям в расчётах.
Диаграммы состояния реальных газов содержат области трёх агрегатных состояний (газообразного, жидкого и твёрдого) и областей фазовых переходов. Первое уравнение, учитывающее особенности поведения реальных газов, было дано Я.Д. Ван-дер-Ваальсом:
(р + а/v2)(v - b) = RT
в котором а/v2 - выражает силы взаимодействия между молекулами (внутреннее давление), b – объем, занимаемый молекулами.
Уравнения состояния для реальных газов принимают сложный вид, затруднительный для расчётов, поэтому параметры и термодинамические функции состояния с учётом их зависимостей могут быть определены только опытным путём. На основе этих экспериментальных данных составляются таблицы и производятся построения диаграмм. Часть p-v - диаграмм с состояниями газообразным и жидким и областью перехода из жидкого в газообразное иллюстрирует важнейшие зависимости состояний при этих переходах от термодинамических параметров (см. рисунок 7.1).
66
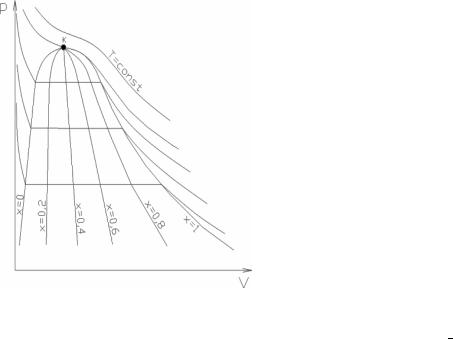
Изотермы реальных газов имеют горизонтальные участки, соответствующие фазовым переходам, происходящим в изобарноизотермических условиях, а, следовательно, и совпадению на этих участках изобар и изотерм. Начала этих участков – состояние кипящей жидкости, окончания – состояние газообразное при этом же давлении и температуре и без жидкой фазы, называемое сухой пар. Подвод тепла к сухому пару вызывает рост температуры – переход в перегретый пар.
Рисунок 7.1 Диаграмма состояния реального газа в p-υ- координатах
Различия между газообразным состоянием и перегретым паром нет. Обычно перегретым паром называют газ вблизи сжижения. С ростом давления растет температура кипения, а, следовательно, и обратного процесса – конденсации. Объединение точек начала кипения образует линию кипящей жидкости или нижнюю пограничную кривую.
Рост давления и температуры фазовых переходов сопровождается уменьшением интервала изменения удельного объёма, сближению пограничных кривых, которые сходятся в точке К – критической точке. Состояние веществ в этой точке называют критическим состоянием, соответствующем исчезновению различия между жидкостью и газом. Различные вещества имеют свои критические параметры этого состояния.
Для водяного пара, широко применяемого и в энергетике и в химико-
технологических процессах: |
|
tкр = 374,15 °C, |
pкр = 221,36 бар (225,65 ат), |
υкр = 0,0033 м3/кг=3,3 дм3/кг, |
ρкр = 315 кг/м3. |
67
При температуре выше критической жидкое состояние вещества не существует.
Область между пограничными кривыми – область двухфазного состояния, называемого влажным паром, для которого вводится параметр сухости – x, отражающий долю сухого пара во влажном паре. Эту величину выражают в долях единицы или в процентах. Тогда, соответственно, (1 – x) – влажность, выражающая долю кипящей жидкости во влажном паре. Следовательно, кипящей жидкости отвечает степень сухости x = 0, а сухому пару – x = 1. В области влажного пара на диаграмме могут быть нанесены линии различной степени сухости: 0,2; 0,4; 0,6; 0,8.
Первоосновой в изучении состояния реальных газов является определение параметров и термодинамических функций на пограничных кривых, которые сводятся в таблицы свойств насыщенного пара. Для кипящей жидкости параметры и термодинамические функции принято обозначать с одним штрихом υ', ρ', i', s', u', а для сухого пара – с двумя штрихами υ'', ρ'', i'', s'', u''. Данные этих величин могут быть представлены в таблицах по давлениям или по температурам по нарастающей до параметров критической точки. В таблицах также даются значения величин теплоты парообразования при соответствующих условиях. Теплота парообразования – это то количество теплоты, которое необходимо затратить при переводе кипящей жидкости в сухой пар или которое выделяется в процессе его конденсации. Наличие таких таблиц позволяет оценить состояние вещества.
Очень часто в справочной литературе приводятся сокращённые варианты таких таблиц, которые, однако, позволяют легко рассчитать не представленные величины по известным соотношениям.
Для расчёта значений внутренней энергии кипящей жидкости или сухого пара используются выражения:
u' i'-p υ', |
(7.1) |
u'' i''-p υ'' . |
|
68
Процесс парообразования и конденсации происходит в изобарноизотермических условиях, что позволяет связать теплоту парообразования с термодинамическими функциями следующими соотношениями:
Поскольку p const , теплота процесса
dq di - υdp
будет равна
dq di ,
тогда теплота парообразования
r i''-i'. |
(7.2) |
И при T const |
|
dq Tds , |
|
r T (s''-s'). |
(7.3) |
Эти выражения могут быть использованы для расчёта не представленных в таблицах величин.
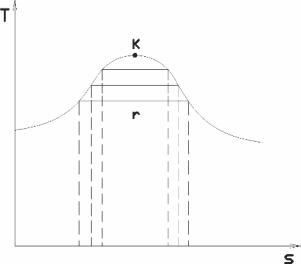
Теплоту парообразования можно наглядно выразить в диаграмме T-s для реальных газов в виде площади под линией фазовых превращений, которая с ростом давления и температуры уменьшается и в критической точке К принимает значение, равное нулю (см. рисунок 7.2).
На основе таблиц свойств насыщенных паров могут производиться расчёты параметров и термодинамических функций состояния влажного и перегретого пара.
Влажный пар Влажный пар, называемый также насыщенным паром, представляет
собой двухфазную систему – смесь сухого пара с капельно-жидкой кипящей
69
