
экзамен / TEHNIChESKAYa_TERMODINAMIKA
.pdf
фазой, находящейся как во взвешенном состоянии, так и в возможном конденсате на стенках или на дне сосудов, чем и насыщен весь объём.
Наличие двух фаз позволяет разделять экстенсивные величины на две составляющие, соответствующие каждой фазе. Эти величины для влажного пара принято обозначать с индексом x. Так, удельный объём влажного пара υx состоит из части объёма, занятого сухим паром, который можно выразить как υ" x (где x – степень сухости, отражающая долю сухого пара), и объёма, занятого кипящей жидкостью υ' 1 x . Таким образом:
|
|
υx υ" x υ' 1 x . |
|
(7.4) |
|
Аналогично, энтальпия влажного пара состоит из энтальпии сухого пара |
|||||
и энтальпии кипящей жидкости: |
|
|
|
||
|
|
ix i" x i' 1 x . |
|
(7.5) |
|
Используя |
ранее |
приведённые |
соотношения |
для |
теплоты |
парообразования, энтальпию влажного пара можно выразить через r: |
|
||||
ix i'' x i' (1 x) i'' x i' i' x i' |
x (i'' i') i' x r . |
(7.6) |
|||
Для энтропии влажного пара: |
|
|
|
||
sx s'' x s' (1 x) s'' x s' s' x s' x (s'' s') s' x |
r . |
(7.7) |
|||
|
|
|
|
T |
|
Внутренняя энергия влажного пара может быть рассчитана как:
ux u'' x u' (1- x) |
(7.8) |
или |
|
ux ix - p υx . |
(7.9) |
Перегретый пар Расчёты термодинамических функций перегретого пара основываются
на состояниях сухого пара и соответствующем перегреве его от этих состояний. Однако при этих расчётах возникает существенная трудность, вызванная необходимостью учитывать зависимость теплоёмкостей реальных газов от температуры (а в более точных расчётах – и от давления). Таким
70

образом, расчёты для перегретого пара требуют привлечения табличных экспериментальных данных, часто с необходимостью интерполяции.
Энтальпия перегретого пара рассчитывается как
T |
|
|
|
|
|
i i" cpdT . |
|
(7.10) |
|||
Tk |
|
|
|
|
|
Энтропия |
|
|
|
|
|
T |
c |
p |
dT |
. |
(7.11) |
s s" |
|
|
|||
Tk |
|
T |
|
|
|
|
|
|
|
|
|
Внутренняя энергия |
|
|
|
|
|
T |
|
|
|
|
|
u u'' cvdT |
|
(7.12) |
|||
Tk
или
(7.13)
В связи с возникающими расчётными трудностями для перегретого пара (в частности водяного пара) составляются таблицы, представляющие собой обширный справочный материал.
7.2 Диаграммы реальных газов
Построение диаграмм реальных газов в соответствии с экспериментально определенными свойствами веществ и с нанесенными изолиниями параметров и термодинамических функций дает возможность широко использовать их для нахождения величин, необходимых для расчетов процессов. Диаграммы дают большую наглядность по состояниям рабочих тел и по протеканию процессов. Благодаря простому и быстрому определению параметров и термодинамических функций, диаграммы предоставляют большие возможности для их использования, как в учебных процессах, так и на практике.
71
Недостатком их в сравнении с таблицами является меньшая точность определения величин, которые могут быть преодолены уточнением искомых данных при обращении к таблицам.
В зависимости от рабочих тел и рассматриваемых процессов целесообразно применение тех или иных видов диаграмм.
Так, достаточно широкое применение находит диаграмма T-s, используемая в расчетах процессов с водяным паром и в расчетах холодильных процессов.
Изображение рассматриваемых процессов в разных видах диаграмм позволяет нагляднее видеть изменение всех параметров, термодинамических функций и величин процессов, полнее осознавать суть и энергетику происходящих изменений.
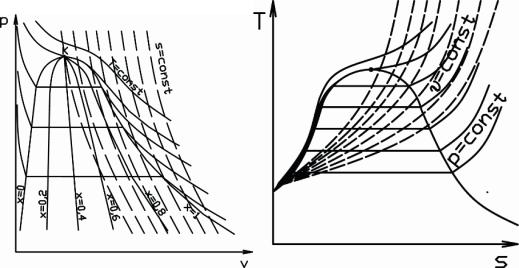
На рисунках 7.3 и 7.4 приведены p-υ- и T-s-диаграммы для реальных газов с изображением основных изолиний параметров и термодинамических функций.
Диаграммы составляются на один кг рабочих тел, то есть экстенсивные параметры (υ, s) и термодинамические функции (i, u) выражаются в удельных величинах.
Рисунок 7.3 p-v-диаграмма |
Рисунок 7.4 Т - s - диаграмма |
реального газа |
реального газа |
72

В связи с тем, что в расчетные формулы очень часто входит величина энтальпии, большое распространение получили диаграммы, в которых значения энтальпий представлены на одной из осей.
Так, для расчетов процессов водяного пара наиболее широко используется диаграмма i-s (рисунок 7.5). Поскольку рассматриваемые процессы обычно соответствуют области перегретого пара или влажного с большой степенью сухости, в диаграммах, применяемых на практике, изображается только эта область состояния пара, что позволяет повысить точность определяемых по диаграммам величин (рисунок 7.6).
Рисунок 7.5 Диаграмма i-s |
Рисунок 7.6 Часть диаграммы |
реального газа |
i-s реального газа |
В расчетах холодильных циклов для таких хладагентов как аммиак или фреоны наряду с диаграммой T-s применяется диаграмма lg p-i.
Необходимые значения внутренней энергии в различных состояниях реальных газов, как правило, определяются расчетами по выражению u i-p υ.
Представление значений внутренней энергии в виде изолиний в диаграммах часто затруднено из-за обилия изолиний других параметров; лишь в отдельных случаях при использовании цветных диаграмм могут быть изображены линии постоянных значений внутренней энергии.
73
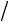
7.3 Расчёты процессов реальных газов
Применение диаграмм для расчёта процессов в реальных газах заключается в поиске точек начального и конечного состояний рабочих тел и определении в этих состояниях величин параметров и термодинамических функций, необходимых для расчётов. Для нахождения начального состояния должны быть даны два параметра, по изолиниям которых и отыскивается на их пересечении нужная точка. Для нахождения точки конечного состояния, как правило, указывается условие протекания процесса, то есть определяется линия процесса, исходящего из начальной точки и параметр конечного состояния.
Определение количества вещества (массы) - не может быть достаточно точно произведено по уравнениям состояния для реальных газов, имеющих сложный вид. Поэтому расчёты массы ведутся, если это необходимо, по величине удельного объёма, определяемого в заданном состоянии по
диаграмме, путём деления известного объёма на удельный объём |
|
m V1 υ1 . |
(7.14) |
В тех случаях, когда количество пара неопределённо, |
расчёты |
производятся на один килограмм, то есть представляются в удельных величинах.
Изменение внутренней энергии, как функции состояния, для любых процессов определяется по разности её значений в конце и начале процесса
U m (u2 u1) |
(7.15) |
или |
|
U m i2 p2 υ2 i1 p1 υ1 . |
(7.16) |
При этом, в отличие от идеальных газов, в этих расчётах учитывается изменение не только кинетической, но и потенциальной части внутренней энергии, то есть энергии взаимодействия молекул (которой идеальный газ не обладает). В связи с этим изотермический процесс для реальных газов имеет
74
изменение внутренней энергии, в то время как для идеальных газов в этих условиях полагают, что изменение внутренней энергии равно нулю.
Изменение сил взаимодействия между молекулами реальных газов, особенно при фазовых переходах, приводит также к тому, что теряет свой физический смысл и значение показателя адиабаты, который уже не остается постоянной величиной (k const ) и не является отношением cp/cv , а
представляет лишь эмпирическую величину, получаемую вследствие формального использования в расчетах уравнения адиабатного процесса идеального газа. Поэтому значение показателя адиабаты оказывается средним значением для конкретного рассматриваемого процесса и, в зависимости от области состояния и интервала изменении состояний, может принимать различные значения в широких пределах (например, для водяного пара k = 1,035÷1,33).
На практике основное внимание уделяют частным процессам реальных газов, для которых даётся рациональная методика вычислений. Произвольно протекающие процессы обычно не рассматриваются. Если процесс сложный, состоит из двух или более частных процессов, то рациональный метод вычислений заключается в подсчёте общего изменения внутренней энергии (как функции состояния) для совокупности процессов по конечному и начальному значениям внутренней энергии в этих состояниях и в расчёте теплоты или работы (как функций процесса) для отдельных стадий процессов с последующим суммированием их с учётом знаков. Выбор расчёта теплот или работ определяется рациональностью вычислений, при этом любая из неизвестных величин совокупности процессов может быть определена по первому закону термодинамики.Расчёты для частных процессов реальных газов производятся следующим образом:
Изохорный процесс (V const )
Неизменность объёма пара при протекании процесса соответствует отсутствию работы, как совершаемой системой, так и затрачиваемой:
75
L pdV m l m pdυ 0.
Таким образом, в соответствии с первым законом термодинамики, тепловой эффект процесса равен изменению внутренней энергии пара :
Q U m u2 u1 m i2 p2 υ i1 p1 υ . (7.17)
При этом, как для определения конечного состояния рабочего тела, так и в расчетах изменения внутренней энергии и теплоты учитывается постоянство удельного объёма.
Изобарный процесс ( p const )
Постоянство давления при протекании процесса позволяет рассчитывать работу по уравнению:
L pdV m l m pdυ m p υ2 υ1 . |
(7.18) |
Исходя из второго уравнения первого закона термодинамики (выражение теплоты через энтальпию и располагаемую работу)
dQ dI Vdp и dq di υdp
в изобарных процессах теплоту можно определять по разности энтальпий:
Vdp 0 и υdp 0
(7.19)
Изменение внутренней энергии рассчитывается по уравнению I закона термодинамики или по расчётному уравнению для ∆U при учёте неизменности давления:
U Q L m u2 u1 m i2 p υ2 i1 p υ1 . (7.20)
Изотермический процесс (T const )
В условиях неизменного значения температуры, теплоту целесообразно рассчитывать по уравнению:
Q TdS m q m Tds m T s2 s1 . |
(7.21) |
Изменение внутренней энергии происходит только за счёт изменения её потенциальной части (из-за изменения сил взаимодействия между молекулами):
76

U |
Uпот m u2 |
u1 m i2 p2 υ2 i1 p1 υ1 . (7.22) |
Работа |
процесса рассчитывается на основе уравнения первого закона |
|
термодинамики: L Q |
U . |
|
При использовании для расчетов диаграмм и при изображении процессов в диаграммах необходимо учитывать, что в области влажного пара изотермы совпадают с изобарами в соответствии с условиями протекания фазовых
превращений. |
|
|
Адиабатный (изоэнтропийный) процесс ( s const ;Q 0 ) |
|
|
Из условия |
адиабатного процесса (Q 0 ) вытекает, что |
работа равна |
изменению внутренней энергии и противоположна ему по знаку: |
|
|
L |
U m u1 u2 m i1 p1 υ1 i2 p2 υ2 . |
(7.23) |
Для открытых систем, связанных с адиабатными условиями протекания процессов, важнейшее значение имеет располагаемая работа (работа открытой системы):
(7.24)
которая для адиабатных условий, в соответствии со вторым уравнением первого закона термодинамики (24) может рассчитываться по выражению:
Lo I I1 I2 m i1 i2 . (7.25)
Формальное применение уравнения адиабатного процесса идеального газа для процесса реального газа позволяет определить среднюю эмпирическую величину показателя адиабаты рассматриваемого процесса в заданном интервале изменения состояния пара:
p υ k |
p |
2 |
υ |
k |
, |
|
1 1 |
|
|
2 |
|
|
|
kср ln p2 |
p1 . |
(7.26) |
||||
|
lnυ1 υ2 |
|
|
|||
Процесс при постоянной сухости пара ( x const )
В этом процессе возникают трудности в достаточно точных расчётах термодинамических величин (теплоты и работы), являющихся функциями
77
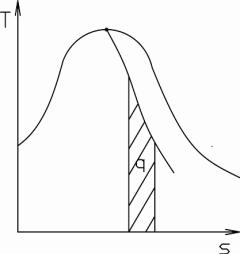
процесса. Приближенный расчет теплоты может быть осуществлен на основе следующих представлений: если в T-s-координатах линию сухости x const принять за прямую (см. рисунок 7.7), то теплота выразится как площадь трапеции под линией процесса:
|
Q m q m T1 T2 |
s |
2 |
s |
. |
|
|
(7.27) |
||
|
|
2 |
|
1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 7.7 Процесс при постоянной |
|
|||||||
|
|
|
|
сухости в Т-s диаграмме |
|
|
||||
|
|
|
Для повышения |
точности |
расчетов |
|||||
|
|
теплоты |
|
линию процесса |
x const можно |
|||||
|
|
разбить на ряд участков, то есть представить |
||||||||
|
|
её в виде ломаной линии и для каждого из |
||||||||
|
|
отрезков |
процесса |
подсчитать |
тепловые |
|||||
|
|
эффекты, затем суммируя их. Изменение |
||||||||
внутренней |
энергии |
подсчитывается |
|
по |
основному |
его выражению |
||||
U m (u2 u1 ) или |
U m i2 p2 υ2 i1 p1 υ1 . |
|
|
|
||||||
Работа |
определяется на основании |
первого |
закона |
термодинамики |
||||||
L Q U . |
|
|
|
|
|
|
|
|
|
|
Аналогичная методика расчета может быть применена и для произвольных процессов, протекающих в реальных газах.
7.4 Фазовые превращения
По энергетической сути фазовые превращения, как и химические реакции, вызываются разностью химических потенциалов, в соответствии с выражением химической энергии
dEхим μ dm , |
(7.28) |
где μ – химический потенциал, dm – изменение количества вещества.
78
Разность химических потенциалов может быть вызвана внешним энергетическим воздействием или может быть присуща системе по её природе.
Фазовые превращения принято делить на два вида:
Фазовые превращения I рода, происходящие со скачкообразным изменением объёма υ и энтропии s и наличием теплоты фазового перехода. Такими превращениями являются: плавление, парообразование (испарение, кипение), возгонка, аллотропические превращения и обратные им процессы – кристаллизация, конденсация.
Фазовые превращения II рода, выражающиеся в проявлении необычных свойств при достижении определенных значений параметров и скачкообразным изменением некоторых характеристик (теплоемкости, коэффициента теплового расширения, сжимаемости и др.). При этом не наблюдается ни скачка объёма υ, ни скачка энтропии s и нет теплоты фазового перехода.
К таким фазовым превращениям относятся:
–переход магнитных металлов (ферромагнетиков) в парамагнитное состояние (когда они теряют магнитные свойства) в, так называемой, точке Кюри: Fe – 769 ºC, Ni – 358 ºC, Co – 920 ºC;
–явление сверхпроводимости (когда исчезает электрическое сопротивление), открытое Х.Камерлинг-Оннесом в 1911 г.;
–явление сверхтекучести (когда исчезает вязкость), открытое для гелия (HeI→HeII) П.Капицей в 1938 г.;
–некоторые превращения в кристаллах;
–переход состояния веществ в критической точке.
Все эти превращения происходят в пределах одной фазы, без изменений кристаллической структуры, и механизм их состоит в перегруппировке атомов в молекулах вещества. Общая теория фазовых переходов II рода была дана Л.
Ландау в 1937-1941 гг..
79
