
- •Глава VI. Атом
- •§ 6.1. Развитие представлений о строении атома
- •§ 6.2. Спектры испускания и поглощения атомов. Формула Бальмера
- •§ 6.3. Модель атома Бора
- •§ 6.4. Волновая модель атома
- •§ 6.5. Многоэлектронные атомы
- •§ 6.6. Лазер
- •Глава VII. Ядро атома
- •§ 7.1. Характеристики ядра атома: состав, размер, стабильность
- •§ 7.2. Энергия связи ядра атома
- •§ 7.3. Радиоактивность. Закон радиоактивного распада
- •§ 7.4. Виды радиоактивного распада
- •§ 7.5. Ядерные реакции
§ 6.3. Модель атома Бора
Модель атома Бора (1913 г.) представляет собой сочетание классической ядерной модели атома Резерфорда и квантовых идей, получивших название постулатов Бора.
Первый постулат (о стационарных состояниях): в атоме существуют стационарные (не изменяющиеся со временем) орбиты, при движении по которым электрон не излучает энергию. Для таких состояний момент импульса электрона имеет квантованные значения:
mυnrn=![]() (6.2)
(6.2)
Здесь m-масса
электрона,
υn
– его
скорость при движении по орбите радиуса
rn,
n
– номер
стационарной орбиты, n=1,
2, ..,
![]() -
постоянная Планка. Каждому стационарному
состоянию соответствует определенное
значение энергии: Е1,
Е2,..,Еn,..
– энергия
квантуется.
-
постоянная Планка. Каждому стационарному
состоянию соответствует определенное
значение энергии: Е1,
Е2,..,Еn,..
– энергия
квантуется.
Второй постулат (правило частот): при переходе электрона с одной стационарной орбиты (с номером n) на другую (с номером m) излучается (поглощается) фотон с энергией
hν=En -Em (6.3)
Этот постулат учитывает линейчатый характер спектров испускания и поглощения атома.
Модель Бора
позволяет рассчитать стационарные
состояния атома водорода: rn,
υn,
Еn.
Кулоновская сила притяжения электрона
к ядру сообщает электрону центростремительное
ускорение:
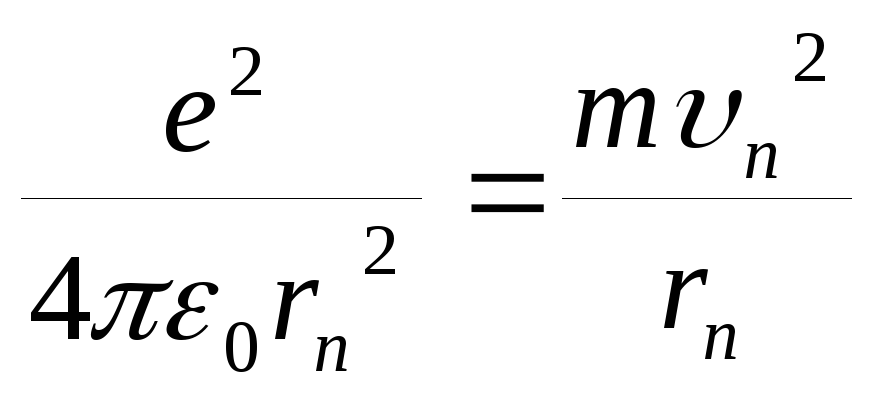 .
Это уравнение, решенное совместно с
уравнением (6.2), дает rn
и υn.
Полная энергия электрона в стационарном
состоянии отрицательная, так как
потенциальная энергия кулоновского
притяжения
.
Это уравнение, решенное совместно с
уравнением (6.2), дает rn
и υn.
Полная энергия электрона в стационарном
состоянии отрицательная, так как
потенциальная энергия кулоновского
притяжения
![]() отрицательная и превосходит по модулю
кинетическую энергию, иначе бы электрон
покинул атом. Расчеты дают следующую
формулу:
отрицательная и превосходит по модулю
кинетическую энергию, иначе бы электрон
покинул атом. Расчеты дают следующую
формулу:
 (6.4)
(6.4)
П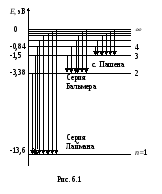 одставляя
численные значения, получим: Е1=
-13,6 эВ, Еn
= -13,6/n2
эВ 1.
Совокупность значений Еn
называется
уровнями
энергии.
Схема уровней энергии электрона в атоме
водорода приведена на рис. 6.1. Уровень
с наименьшим значением энергии (n=1)
называется основным состоянием, все
остальные уровни энергии (n=2,3
и т.д.) называются возбужденными. Уровень
n=
соответствует
ионизованному атому: неподвижный
электрон находится вне атома. Свободный
электрон может иметь любую кинетическую
энергию, такому состоянию соответствует
область Е≥0,
в ней энергия не квантуется, а может
изменяться плавно. Вертикальные стрелки
указывают возможные переходы электрона
с одного уровня на другой, их длина
соответствуют энергиям фотонов в спектре
излучения. Обратные переходы, которые
на схеме можно изобразить стрелками
обратного направления, дают спектр
поглощения. Модель Бора снимает все
противоречия модели Резерфорда с
опытом: необъяснимую устойчивость
атомов, отсутствие излучения в нормальном
состоянии, совпадение спектров испускания
и поглощения и их линейчатый характер.
Модель Бора теоретически получила
значение постоянной Ридберга: R=
одставляя
численные значения, получим: Е1=
-13,6 эВ, Еn
= -13,6/n2
эВ 1.
Совокупность значений Еn
называется
уровнями
энергии.
Схема уровней энергии электрона в атоме
водорода приведена на рис. 6.1. Уровень
с наименьшим значением энергии (n=1)
называется основным состоянием, все
остальные уровни энергии (n=2,3
и т.д.) называются возбужденными. Уровень
n=
соответствует
ионизованному атому: неподвижный
электрон находится вне атома. Свободный
электрон может иметь любую кинетическую
энергию, такому состоянию соответствует
область Е≥0,
в ней энергия не квантуется, а может
изменяться плавно. Вертикальные стрелки
указывают возможные переходы электрона
с одного уровня на другой, их длина
соответствуют энергиям фотонов в спектре
излучения. Обратные переходы, которые
на схеме можно изобразить стрелками
обратного направления, дают спектр
поглощения. Модель Бора снимает все
противоречия модели Резерфорда с
опытом: необъяснимую устойчивость
атомов, отсутствие излучения в нормальном
состоянии, совпадение спектров испускания
и поглощения и их линейчатый характер.
Модель Бора теоретически получила
значение постоянной Ридберга: R=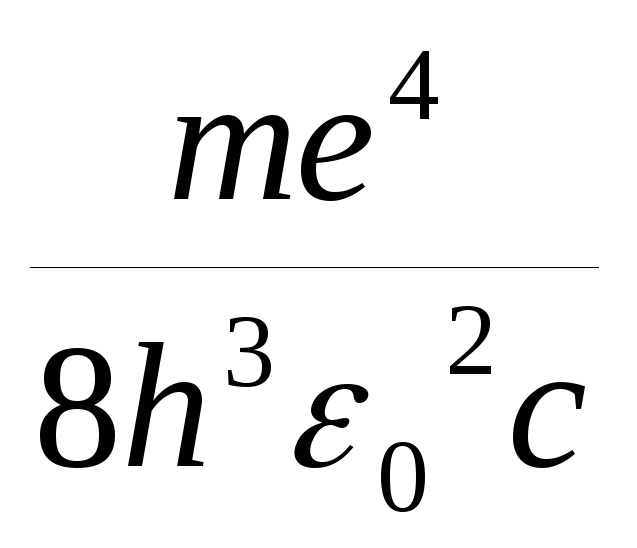 =1.097.107
м -1.
Самостоятельно получите этот результат,
используя формулы (6.1, 6.3 и 6.4).
=1.097.107
м -1.
Самостоятельно получите этот результат,
используя формулы (6.1, 6.3 и 6.4).
Модель Бора дала
правильный результат для спектра
водородоподобных ионов, т.е. ионизованных
атомов, где остался всего лишь один
электрон:
![]() .
Z-порядковый
номер элемента в таблице Менделеева,
указывающий величину заряда ядра иона.
.
Z-порядковый
номер элемента в таблице Менделеева,
указывающий величину заряда ядра иона.
Однако для атомов, содержащих два и более электронов, теория Бора не совпала с опытом. В современной физике модель атома Бора имеет исторический характер. Эта модель не является последовательно ни классической, ни квантовой. Ее историческая роль состоит в том, что она показала, что атом – микрочастица, и является объектом квантовой физики. Современная модель атома – квантовая (или волновая.).
