
- •Кинетика физико-химических процессов. Химическое равновесие.
- •Экспериментальная часть
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •1.1. Ход опыта
- •1.2Данные опыта и расчёта.
- •1.3. Вывод
- •2. Зависимость скорости реакции от температуры
- •2.1. Ход опыта
- •2.2 Расчет и анализ экспериментальных данных
- •Ход опыта
- •4.2 Расчет и анализ экспериментальных данных
- •5.1. Ход опыта
- •Электролиты. Реакции в растворах электролитов
- •Экспериментальная часть
- •1.Зависимость степени диссоциации от природы электролита
- •1.1Ход и данные опыта
- •2.3 Ход опыта
- •3.3 Расчёт и анализ данных
- •4.2 Ход опыта
- •4.5 Вывод.
- •5. Гидролиз карбоната натрия
- •5.1 Ход опыта
- •5.2 Расчет и анализ экспериментальных данных.
Кинетика физико-химических процессов. Химическое равновесие.
Цель работы: изучить влияние различных факторов на кинетику и равновесие физико-химических процессов.
Экспериментальная часть
-
Зависимость скорости реакции от концентрации реагирующих веществ
1.1. Ход опыта
Для наблюдения зависимости скорости реакции от концентрации реагирующих веществ используем реакцию взаимодействия йодата калия (KIO3) с сульфитом натрия (NA2SO3) в присутствии серной кислоты и крахмала.
Суммарное уравнение реакции имеет вид:
2KIO3 + 5Na2SO3 + H2SO4 = I2 + 5Na2SO4 + K2SO4 + H2O,
или в ионной форме:
2IO-3 + 5SO32-+2H+=I2+5SO42-+H2O.
Для выполнения опыта используем
растворы: раствор А (0,002 н раствор
иодата калия), раствор Б (0,02 н
раствор сульфита натрия, содержащий в
500 мл 0,02 н раствора
![]() 50 мл 2 н раствора серной кислоты и
50 мл
50 мл 2 н раствора серной кислоты и
50 мл
![]() -го
раствора крахмала).
-го
раствора крахмала).
Для опыта приготовили раствор Б пяти различных концентрации: в 5 пронумерованных химических стаканов налили по 10мл. раствора Б и добавили в каждый из них дисцилированную воду в количествах указанных в табл. 1.
Затем взяли 2 пробирки в одну из них внесли 20 капель раствора А, в другую из стакана №1 – 20 капель раствора Б, смешали растворы и одновременно включили секундомер. Зафиксировали секундомером время в табл.1. Варианты 2,3,4 и 5 проделали в том же порядке.
1.2Данные опыта и расчёта.
Для каждого варианта рассчитали относительную скорость реакции Vi = 1/ τi (i = 1..5) и данные занесли в табл.1.
Таблица 1
|
Номер стакана |
Объём, мл |
Относительная концентрация раствора Б (нормальность) |
Время τ,с |
Относительная скорость реакции V=1/τ,с-1 |
|
|
Раствор Б |
Дистил. вода |
||||
|
1 |
10 |
0 |
0,02 |
8,5 |
0,12 |
|
2 |
10 |
5 |
0,0133 |
76 |
0,01 |
|
3 |
10 |
10 |
0,01 |
421 |
0,002 |
|
4 |
10 |
15 |
0,008 |
1994 |
0,0005 |
|
5 |
10 |
20 |
0,0066 |
3131 |
0,0003 |
Таблица 1. Результаты эксперимента
Из данных таблицы видно, что скорость реакции влияет влияет концетрация реагирующих веществ. Зависимость скорости реакции от концетрации реагирующих веществ выражается основным законом химической кинетики– законом действия масс: скорость гамогенной химической реакции при постоянной температуре прямо пропорционально произведению концетрации реагирующих веществ взятых в степенях равных стехиометрическим коэффициентам в уравнениях реакции. Построим график по полученным значениям.
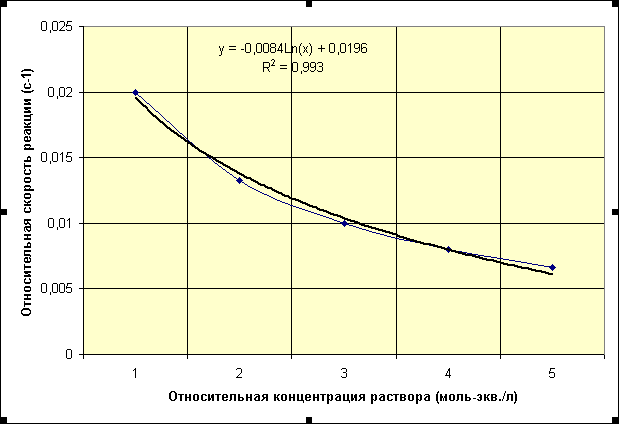
Рисунок 1 - График зависимости скорости протекания реакции от концентрации
реагирующих веществ.
1.3. Вывод
Из графика функции видно, что скорость химической реакции выше, когда выше концентрация раствора.
