
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
Кинетика – это учение о скоростях и механики физико-химических процессов.
Система – это совокупность взаимодействующих веществ фактически или мысленно выделенное в окружающей среде. Системы могут быть гомогенные (состоят из 1 фазы) и гетерогенные (состоят из 2х и более фаз). Параметры, описывающие состояние системы: T, p, C.
Фаза – часть системы однородная по составу, структуре, свойствам и имеющая границу раздела с другими частями системы.
Процесс – переход системы из одного состояния в другое при изменении хотя бы одного из параметров. Процессы могут быть физическими (изменяется агрегатное состояние вещества) и химическими (изменяется химический состав вещества). Классификация процессов: 1) по условиям протекания (изобарные p=const, изохорные V=const, изотермические T=const, адиабатные Q=const) ; 2) самопроизвольные – не требующие энергетических затрат, не самопроизвольные – требующие энергетических затрат; 3) обратимые – в которых каждое из реагирующих веществ присутствует в системе в определенном количестве в любой момент времени, необратимые – в которых систему невозможно вернуть в исходное состояние; 4) по характеру обмена теплотой с окружающей средой: +Q –экзотермическая, -Q –эндотермическая. Скорость. Скорость физико-химического процесса – изменение количества реагирующих веществ в единицу времени в единице реакционного пространства. Cкорость гомогенной реакции можно определить, как изменение концентрации одного из реагирующих веществ в единицу времени. Скорость гетерогенных реакций измеряется количеством вещества, вступающего в реакцию или образующегося в единицу времени на единицу поверхности. Процесс осуществляется не в объеме твердого вещества, а на поверхности, концентрация его остается постоянной, поэтому скорость гетерогенных реакций определяется изменением концентрации газов или жидкостей.
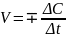 ;
;
 .
Скорость любой химическое реакции
зависит от следующих основных
факторов:
1)природа реагирующих
веществ (состав, структура, природа
химической связи);
2)концентрация в-в
в жидком или газообразном состоянии.
(концентрация твердой фазы = const);
3)T;
4) p (для реакций с участием
газов); 5) пов-ть раздела фаз в гетерогенных
процессах;
6)присутствие катализатора
(ингибитора).
.
Скорость любой химическое реакции
зависит от следующих основных
факторов:
1)природа реагирующих
веществ (состав, структура, природа
химической связи);
2)концентрация в-в
в жидком или газообразном состоянии.
(концентрация твердой фазы = const);
3)T;
4) p (для реакций с участием
газов); 5) пов-ть раздела фаз в гетерогенных
процессах;
6)присутствие катализатора
(ингибитора).
Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
Зависимость скорости реакции от концентрации реагирующих веществ выражается основным законом химической кинетики – законом действия масс (ЗДМ): скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для
реакции
 выражение закона запишется как
выражение закона запишется как
|
где
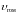 –
скорость реакции;
–
скорость реакции;
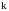 –
константа скорости химической реакции;
СА
и СВ –
концентрации реагирующих веществ,
моль/л; а, b –
стехиометрические коэффициенты в
уравнении реакции.
–
константа скорости химической реакции;
СА
и СВ –
концентрации реагирующих веществ,
моль/л; а, b –
стехиометрические коэффициенты в
уравнении реакции.
Физический смысл константы скорости (k): k показывает, с какой скоростью протекает реакция при концентрациях реагирующих веществ, равных 1 моль/л.
Константа скорости зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ и парциальных давлений (для газов).
Для реагирующих веществ в газообразном состоянии вместо концентраций в законе действия масс можно использовать их парциальные давления:
В случае гетерогенных процессов в закон действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или растворе. Концентрации веществ, находящихся в твердой фазе, постоянны и включены в константу скорости. В общем случае скорость реакции в гетерогенных процессах пропорциональна поверхности соприкосновения реагирующих веществ. Чем больше поверхность взаимодействия, тем больше вероятность столкновения взаимодействующих частиц, и, следовательно, больше скорость гетерогенной реакции. Закон действия масс справедлив для простых реакций, протекающих в газах или растворах. Для сложных гомогенных реакций закон применим для каждой отдельной стадии, но не для всей реакции в целом. Скорость сложных реакций определяется самой медленной (лимитирующей) стадией. В гетерогенных процессах, отличающихся сложностью и многостадийностью, закон действия масс применим лишь тогда, когда лимитирующей стадией является сама химическая реакция.
|
|

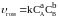 ,
, .
.