
- •Кинетика физико-химических процессов. Химическое равновесие.
- •Экспериментальная часть
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •1.1. Ход опыта
- •1.2Данные опыта и расчёта.
- •1.3. Вывод
- •2. Зависимость скорости реакции от температуры
- •2.1. Ход опыта
- •2.2 Расчет и анализ экспериментальных данных
- •Ход опыта
- •4.2 Расчет и анализ экспериментальных данных
- •5.1. Ход опыта
- •Электролиты. Реакции в растворах электролитов
- •Экспериментальная часть
- •1.Зависимость степени диссоциации от природы электролита
- •1.1Ход и данные опыта
- •2.3 Ход опыта
- •3.3 Расчёт и анализ данных
- •4.2 Ход опыта
- •4.5 Вывод.
- •5. Гидролиз карбоната натрия
- •5.1 Ход опыта
- •5.2 Расчет и анализ экспериментальных данных.
2. Зависимость скорости реакции от температуры
2.1. Ход опыта
Для проведения опыта подготовили 2 пробирки: в одну налили 20 капель 0,1н раствора щавельной кисты, а в другую столько же перманганата калия и 20 капель серной кислоты. Обе пробирки закрепили в крышке калориметра, наполовину заполненного водой, так, чтобы они не касались стенок и дна калориметра. Поставили калориметр на электрическую плитку и нагрели до 30ᵒС. Затем содержимое 1-й пробирки вылили во 2-ю, не вынимая её из калориметра и включили секундомер. Отметили время смешания до полного обесцвечивания смеси растворов, данные занесли в таблицу 2. Затем в той же последовательности выполнили 2-4 варианты опыта, повышая температуру каждый раз на десять градусов, пока она не достигла 60 ᵒС.
5H2C2O4+2 KmnO4+3H2SO4=10CO2+2MnSO4+K2SO4+8H2O
ионный вид уравнения:
5H2C2O4+2MnO-4+6H+=10CO2+2Mn2++8H2O
В кислой среде ион Mn0- восстанавливается в ион Mn2+, в результате цвет раствора изменяется: из красно – фиолетового до бледно розового (цвет иона Мn при большой концетрации) или бесцветного (при малой концетрации).
Результаты полученных во время эксперимента , занесены в таблицу №2.
2.2 Расчет и анализ экспериментальных данных
Таблица 2.
|
Номер опыта |
Температура t, oC |
Время от начала реакции до конца, τ,c |
Относительная скорость реакции V=1/τ,c-1 |
|
1 |
30 |
838 |
0,001 |
|
2 |
40 |
649 |
0,002 |
|
3 |
50 |
397 |
0,003 |
|
4 |
60 |
193 |
0,005 |
Рассчитаем скорость реакции по формуле Vi = 1/ τi (i = 1..4). Рассчитаем температурный коэффициент γ для V при температурах 30-40oC, 40-50oC, 50-60oC. Получим γ1 = (V 40 0C / V 30 0C) = 2
γ2 = (V 50 0C / V 40 0C) = 1,5
γ3 = (V 60 0C / V 50 0C) = 1,7
Температурный коэффициент γ определим как среднее значение полученных коэффициентов γ = 2,6.
Получается нелинейная зависимость скорости протекания реакции от температуры.
Температурный коэффициент γ зависит от природы реагирующих веществ.
Построим график по полученным значениям:
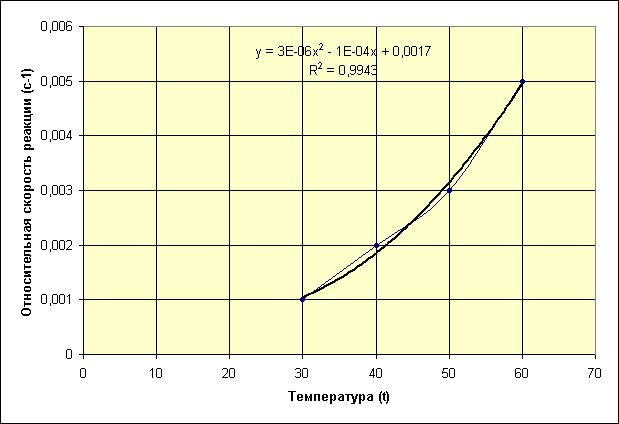
Рисунок 2 - График зависимости скорости протекания реакции от температуры.
2.3 Вывод
Исходя из анализа полученных данных можно сказать, что скорость физико-химического процесса непосредственно зависит от температуры. Повышение температуры влечет за собой возрастания числа активных молекул, обладающих избыточной энергией. Эта энергия также называется энергией активации.
3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ
-
Ход опыта
В две пробирки было налито ¼ объёма 10%-го раствора соляной кислоты. Помещенно в пробирки одновременно одинаковое количество (около 0,5г.) мела и мрамора.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Наблюдалось интенсивное выделение газа больше в пробирке с мелом чем в пробирке с мрамором.
-
Расчет и анализ экспериментальных данных
Реакция с мелом протекла быстрее. Плотность мела меньше, чем плотность мрамора, значит, площадь поверхности взаимодействия будет больше. А так как гетерогенные процессы протекают на границе раздела фаз, то реакция будет более быстрой и более бурной с мелом, чем с мрамором.
-
Вывод
Было установлено, что при большей плотности реагирующих веществ гетерогенные реакции протекают медленнее, так как поверхность взаимодействия будет меньшей, а значит, меньшей будет и вероятность взаимодействия молекул.
4. Влияние концентрации реагирующих веществ на состояние равновесия
4 .1 Ход работы
Для того чтобы более чётко увидеть влияние концентрации на смещение химического равновесия, воспользуемся реакцией взаимодействия раствора хлорида железа (FeCL3) с радонитам калия (КСNS), которая является обратимой.
Смещение химического равновесия будем наблюдать на примере взаимодействия хлористого железа (FeCl3) с радонитом калия (КСNS).
FeCl3 + 3KCNS →← Fe(CNS)3 + 3KCl (реакция обратима)
Смешаем 10 мл FeCl3 и 10 мл KCNS и разольем в 4 пробирки. Добавим в первую FeCl3, во вторую – KCNS, в третью – KCl, четвертая – контрольная. Результаты наблюдения изменением окраски в пробирках занесем в таблицу 3.
Таблица 3
Форма записи результатов наблюдений
|
Номер пробирки |
Добавленное вещество |
Изменение интенсивности окраски (ослабление, усиление) |
Направление смещения равновесия (→, ←, →←) |
|
1 |
FeCl3 |
Усиление |
→ |
|
2 |
KCNS |
Усиление |
→ |
|
3 |
KCl |
Ослабление |
← |
|
4 |
Контрольная |
--- |
→← |
