
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •РАЗДЕЛ I. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ
- •ГЛАВА 1. ГОРЕНИЕ – ОСНОВНОЙ ПРОЦЕСС НА ПОЖАРЕ
- •1.1. Определение горения
- •1.2. Характеристика участников процесса горения
- •1.4. Опасные факторы пожара
- •ГЛАВА 2. МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
- •2.1. Расчет объема воздуха, необходимого для горения
- •2.1.1. Горючее – индивидуальное химическое соединение
- •2.1.2. Горючее – смесь газов и паров
- •2.2.1. Горючее – индивидуальное химическое соединение
- •2.2.2. Горючее – смесь газов и паров
- •2.2.3. Горючее – сложное вещество с известным элементным составом
- •2.3. Продукты сгорания. Дым и его характеристики
- •ГЛАВА 3. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
- •3.1. Уравнение теплового баланса процесса горения
- •3.3. Расчет температуры горения
- •РАЗДЕЛ II. ТЕОРИИ ГОРЕНИЯ
- •4.1. Тепловая теория горения
- •4.1.1. Механизм химических реакций при горении
- •4.1.2. Факторы, влияющие на скорость реакций горения
- •4.2. Цепная теория горения
- •4.3. Диффузионная теория горения
- •ГЛАВА 5. ПЛАМЯ И ЕГО РАСПРОСТРАНЕНИЕ В ПРОСТРАНСТВЕ
- •5.1. Виды пламени
- •5.2. Структура пламени
- •5.3. Процессы, протекающие в пламени
- •5.4. Скорость распространения пламени
- •5.5. Характер свечения пламени
- •IV.I. ВОЗНИКНОВЕНИЕ ГОРЕНИЯ
- •ГЛАВА 6. САМОВОСПЛАМЕНЕНИЕ
- •ГЛАВА 7. САМОВОЗГОРАНИЕ
- •7.1. Механизм процесса самовозгорания веществ
- •7.2. Самовозгорание жиров и масел
- •7.3. Самовозгорание химических веществ
- •ГЛАВА 8. ВЫНУЖДЕННОЕ ВОСПЛАМЕНЕНИЕ (ЗАЖИГАНИЕ)
- •8.2. Закономерности перехода самовоспламенения к зажиганию
- •8.3. Зажигание нагретым телом
- •8.4. Элементы тепловой теории зажигания
- •8.6. Элементы тепловой теории зажигания электрической искрой
- •8.8. Зажигание твердых и жидких горючих веществ
- •8.9. Зажигание лучистым тепловым потоком
- •8.10. Основные виды и характеристики источников зажигания
- •IV.II. РАЗВИТИЕ ПРОЦЕССОВ ГОРЕНИЯ
- •ГЛАВА 9. ГОРЕНИЕ ГАЗОПАРОВОЗДУШНЫХ СМЕСЕЙ
- •9.1. Концентрационные пределы распространения пламени
- •9.2. Факторы, влияющие на КПР
- •9.2.1. Зависимость КПР от химической природы горючего вещества
- •9.2.2. Влияние начальной температуры смеси на КПР
- •9.2.3. Влияние давления горючей смеси на КПР
- •9.2.4. Влияние флегматизаторов и ингибиторов на КПР
- •ГЛАВА 10. ГОРЕНИЕ ЖИДКОСТЕЙ
- •10.1. Условия для возникновения горения жидкостей
- •9.2. Температурные пределы распространения пламени
- •10.3. Скорость испарения жидкости
- •10.4. Температура вспышки. Температура воспламенения жидкости
- •10.5. Механизм теплового распространения горения жидкостей
- •10.7. Распределение температуры в горящей жидкости
- •10.8. Вскипание и выброс при горении резервуара с ГЖ
- •ГЛАВА 11. ГОРЕНИЕ ТВЕРДЫХ ВЕЩЕСТВ И МАТЕРИАЛОВ
- •11.2. Основные закономерности процессов горения органических твердых горючих материалов
- •11.4. Гетерогенное горение
- •11.5. Горение металлов
- •11.6. Особенности горения пылевидных веществ
- •РАЗДЕЛ V. ВЗРЫВЫ.
- •ГЛАВА 12. ВЗРЫВЫ. УДАРНЫЕ ВОЛНЫ И ДЕТОНАЦИЯ
- •12.1. Основные определения. Типы взрывов
- •12.4. Основные свойства и параметры ударной волны
- •12.6. Взрывчатые вещества
- •12.6.1. Краткие сведения об основных взрывчатых веществах
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
- •Приложение 5
69
9.QПГ1600= 14886,44 > QПГ = 14293,53, следовательно, температура горения вещества находится в интервале от 1500 до 16000С.
10.Определяем температуру горения:
ТГ =1500 + 14293,53 −13853,889 (1600 −1500) = 15560С = 1829 К 14886,44 −13853,889
Задания для самоконтроля
1.Написать уравнение теплового баланса для процессов горения.
2.Что такое удельная теплота горения, ее размерность ?
3.Чем отличается низшая теплота горения от высшей?
4.Как связаны энтальпия и теплота горения?
5.Энтальпия горения этана ∆НГОР = - 1430,4 кДж/моль. Чему равно значение теплоты горения этана в кДж/моль и кДж/м3. Условия стандартные.
6.Энтальпия горения нафталина С10Н8 ∆НГОР = - 5161,2 кДж/моль. Выразить величину теплоты горения этого вещества в кДж/кг.
7.Перечислите температуры горения.
8.При расчете каких ТГ не учитывается диссоциация продуктов горения?
9.При расчете каких ТГ не учитываются теплопотери в окружающую среду?
10. При расчете каких ТГ принимается, что состав горючей смеси является стехиометрическим?
11. Рассчитать температуру горения бензола, если потери тепла излучением составляют 20 %, а коэффициент избытка воздуха 1,8.
12. Определить температуру горения торфа состава: 56,4 % углерода, 6,56 % во-
дорода, 24,0 % кислорода, 0,6 % серы, 3,6 % азота и 9,84 % золы. η = 0,4, α = 2,0.
13. Вычислить температуру горения газовой смеси состава: пропан – 60 %, бутан –
40 %. η = 0,3, α = 1,7.
РАЗДЕЛ II. ТЕОРИИ ГОРЕНИЯ
ГЛАВА 4. ТЕПЛОВАЯ, ЦЕПНАЯ И ДИФФУЗИОННАЯ ТЕОРИИ ГОРЕНИЯ
4.1. Тепловая теория горения
В существующем виде тепловую теорию разработали академики
Я.Б.Зельдович, Н.Н.Семенов и профессор Д.А.Франк-Каменецкий. В ос-
нове ее лежит представление о подобии полей концентраций и температуры во фронте пламени.
Если с помощью оптического прибора рассмотреть кинетическое пламя в неподвижной горючей смеси, то можно увидеть следующую картину
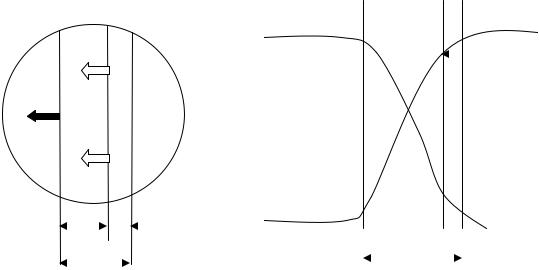
70
(рис. 4. 1).
а) |
|
|
|
|
Сгор, |
|
|
|
|
|
|
|
|
|
б) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Т |
С0 |
|
|
|
Тг |
|||||
Т0 |
|
|
|
|
1 |
|
|
||||||||
q |
|
|
|
|
|
|
|
Т |
=ТГ −θ |
||||||
С0 |
|
|
|
|
|
|
|
С |
|||||||
Uн |
|
Тг |
Тпг |
|
|
|
|
|
|
|
|
|
|
|
|
q |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
δпод |
δгор |
Т0 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δфп |
|
|
|
δфп |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 4.1. Схема фронта (а) и изменение температуры и концентрации горючего (б) в кинетическом пламени
Справа находятся нагретые до высокой температуры Тпг продукты горения, слева - холодная с температурой Т 0 исходная горючая смесь, а между ними - ярко светящаяся полоска - фронт пламени с толщиной δ. Горючий компонент во фронте пламени сгорает, и в продуктах горения его концентрация практически равна нулю. Естественно, температура продуктов горения Тпг = Тг >> Т0 - температуры исходной смеси. Поскольку теплота распространяется от горячего к холодному, в сторону исходной смеси будет идти тепловой поток q, нагревая прилегающий к ней слой, так называемую зону подогрева. Передача теплоты от нее осуществляется теплопроводностью. Смесь в этом слое воспламенится при достижении температуры самовоспламенения. Зона горения переместится туда, затем в следующий слой, следующий и т.д. Фронт пламени будет непрерывно перемещаться до самой границы горючей смеси. Такое распространение пламени называют но р- мальным или дефлаграционным горением.
Обратимся к рисунку 4.1 и составим уравнение теплового баланса для
71
фронта пламени. В результате сгорания 1 моля горючего газа или пара выделится Q кДж/моль теплоты и концентрация его понизится от C0 до С. Теплота будет израсходована на нагрев горючей смеси от T0 до T. Если принять теплоемкость смеси постоянной, то уравнение материального баланса будет иметь следующий вид:
Q(c0 - c) = cр(Т - Т0). |
(4.1) |
При T = Tг концентрация горючего С = 0, |
т.е. |
Q c = cр(Tг - T0). |
(4.2) |
Разделив уравнение (4.1) на выражение (4.2), получим:
(c0 – c)/с0 = (T - T0)/(Тг – Т0).
Это соотношение указывает на то, что во фронте пламени концентрация и температура меняются по одному и тому же закону. Следовательно, скорость реакции горения зависит в основном от температуры. Это означает, что реакции горения протекают в очень узкой части фронта пламени при температурах, близких к максимальной температуре горения. Толщина зоны горения составляет менее одной десятой части фронта пламени:
δгор ≈ 00,1δфп.
4.1.1. Механизм химических реакций при горении
Акты химического превращения происходят при непосредственном контакте реагирующих компонентов (молекул, атомов, радикалов), но только в тех случаях, когда их энергия превышает определенный энергетический предел, называемый энергией активации Еа. Изобразим графически изменение энергии реагирующих компонентов (горючего и окислителя) и продуктов реакции при горении (рис.4.2)
По оси абсцисс изображен путь реакции горения, по оси ординат –
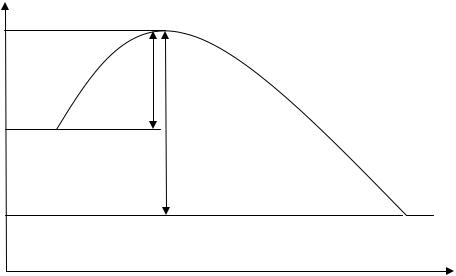
72
энергия. EH – средняя начальная энергия реагирующих компонентов,
EK - средняя энергия продуктов горения.
Е
Е̉
Еа пр. Еа обр.
Ен
Ек
Ход реакции
Рис 4.2. Изменение энергии реагирующих веществ и продуктов реакции при горении
В реакцию горения будут вступать только активные частицы горючего и окислителя, которые будут обладать энергией, необходимой для вступление во взаимодействие, т.е. способные преодолеть энергетический барьер E′. Избыточная энергия активных частиц по сравнению со средней энергией EH , называется энергией активации Ea . Поскольку реакции, протекающие при горении являются экзотермическими EK ≤ EH . Разность энергий образовавшихся продуктов горения и исходных веществ (горючего и окислителя) определяет тепловой эффект реакции:
