
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •РАЗДЕЛ I. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ
- •ГЛАВА 1. ГОРЕНИЕ – ОСНОВНОЙ ПРОЦЕСС НА ПОЖАРЕ
- •1.1. Определение горения
- •1.2. Характеристика участников процесса горения
- •1.4. Опасные факторы пожара
- •ГЛАВА 2. МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
- •2.1. Расчет объема воздуха, необходимого для горения
- •2.1.1. Горючее – индивидуальное химическое соединение
- •2.1.2. Горючее – смесь газов и паров
- •2.2.1. Горючее – индивидуальное химическое соединение
- •2.2.2. Горючее – смесь газов и паров
- •2.2.3. Горючее – сложное вещество с известным элементным составом
- •2.3. Продукты сгорания. Дым и его характеристики
- •ГЛАВА 3. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
- •3.1. Уравнение теплового баланса процесса горения
- •3.3. Расчет температуры горения
- •РАЗДЕЛ II. ТЕОРИИ ГОРЕНИЯ
- •4.1. Тепловая теория горения
- •4.1.1. Механизм химических реакций при горении
- •4.1.2. Факторы, влияющие на скорость реакций горения
- •4.2. Цепная теория горения
- •4.3. Диффузионная теория горения
- •ГЛАВА 5. ПЛАМЯ И ЕГО РАСПРОСТРАНЕНИЕ В ПРОСТРАНСТВЕ
- •5.1. Виды пламени
- •5.2. Структура пламени
- •5.3. Процессы, протекающие в пламени
- •5.4. Скорость распространения пламени
- •5.5. Характер свечения пламени
- •IV.I. ВОЗНИКНОВЕНИЕ ГОРЕНИЯ
- •ГЛАВА 6. САМОВОСПЛАМЕНЕНИЕ
- •ГЛАВА 7. САМОВОЗГОРАНИЕ
- •7.1. Механизм процесса самовозгорания веществ
- •7.2. Самовозгорание жиров и масел
- •7.3. Самовозгорание химических веществ
- •ГЛАВА 8. ВЫНУЖДЕННОЕ ВОСПЛАМЕНЕНИЕ (ЗАЖИГАНИЕ)
- •8.2. Закономерности перехода самовоспламенения к зажиганию
- •8.3. Зажигание нагретым телом
- •8.4. Элементы тепловой теории зажигания
- •8.6. Элементы тепловой теории зажигания электрической искрой
- •8.8. Зажигание твердых и жидких горючих веществ
- •8.9. Зажигание лучистым тепловым потоком
- •8.10. Основные виды и характеристики источников зажигания
- •IV.II. РАЗВИТИЕ ПРОЦЕССОВ ГОРЕНИЯ
- •ГЛАВА 9. ГОРЕНИЕ ГАЗОПАРОВОЗДУШНЫХ СМЕСЕЙ
- •9.1. Концентрационные пределы распространения пламени
- •9.2. Факторы, влияющие на КПР
- •9.2.1. Зависимость КПР от химической природы горючего вещества
- •9.2.2. Влияние начальной температуры смеси на КПР
- •9.2.3. Влияние давления горючей смеси на КПР
- •9.2.4. Влияние флегматизаторов и ингибиторов на КПР
- •ГЛАВА 10. ГОРЕНИЕ ЖИДКОСТЕЙ
- •10.1. Условия для возникновения горения жидкостей
- •9.2. Температурные пределы распространения пламени
- •10.3. Скорость испарения жидкости
- •10.4. Температура вспышки. Температура воспламенения жидкости
- •10.5. Механизм теплового распространения горения жидкостей
- •10.7. Распределение температуры в горящей жидкости
- •10.8. Вскипание и выброс при горении резервуара с ГЖ
- •ГЛАВА 11. ГОРЕНИЕ ТВЕРДЫХ ВЕЩЕСТВ И МАТЕРИАЛОВ
- •11.2. Основные закономерности процессов горения органических твердых горючих материалов
- •11.4. Гетерогенное горение
- •11.5. Горение металлов
- •11.6. Особенности горения пылевидных веществ
- •РАЗДЕЛ V. ВЗРЫВЫ.
- •ГЛАВА 12. ВЗРЫВЫ. УДАРНЫЕ ВОЛНЫ И ДЕТОНАЦИЯ
- •12.1. Основные определения. Типы взрывов
- •12.4. Основные свойства и параметры ударной волны
- •12.6. Взрывчатые вещества
- •12.6.1. Краткие сведения об основных взрывчатых веществах
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
- •Приложение 5
182
22. При какой концентрации горючего скорость распространения пламени максимальна?
23. Какие процессы происходят в зоне подготовки горючей смеси к горению?
24. В каком случае газовоздушную смесь можно считать горючей, трудногорючей и негорючей?
25. В емкости объемом 800 мл образовалась стехиометрическая концентрация метанола. Сколько мл спирта (ρ = 0,792 г/мл) испарилось в этой емкости?
ГЛАВА 10. ГОРЕНИЕ ЖИДКОСТЕЙ
В огромных количествах горючие жидкости добываются, транспортируются, хранятся, перерабатываются и используются в народном хозяйстве страны. Основным их источником являются нефть и газовый конденсат, объем добычи, которых сейчас у нас в стране составляет более 300 млн. т. Такое количество нефти и конденсата транспортируется, хранится, перерабатывается и потребляется во многих отраслях народного хозяйства - в нефтеперерабатывающей, нефтехимической, химической промышленности и других, на всех видах транспорта и в быту.
Характерной особенностью практически всех горючих жидкостей является способность их к испарению при любых условиях. Над поверхн о- стью горючих жидкостей всегда находятся их пары, которые, смешиваясь с воздухом, могут образовать взрывоопасные смеси. Такое состояние жидкостей приводит к тому, что пожарная их опасность представляет опасность двоякого рода: в одном случае происходит только вспышка паров, а в другом - вспышка паров и возникновение устойчивого горения самой жидкости.
10.1. Условия для возникновения горения жидкостей
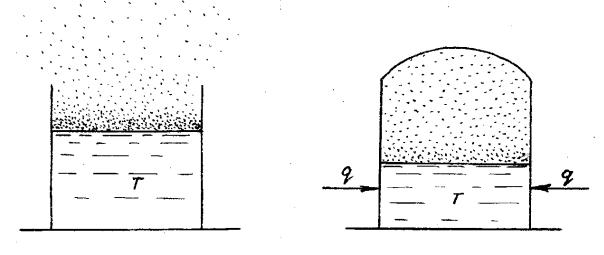
Реакция горения жидкости начинается и протекает сложнее, чем у газов. Представим себе, что жидкость налита в открытый сосуд (рис.10.1). Жидкости непрерывно испаряются даже при низких температурах. Поэтому над зеркалом жидкости всегда присутствует парообразная смесь с воздухом за счет того, что часть молекул на поверхности, которые имеют большую
183
кинетическую энергию, покидают жидкость и смешиваются с воздухом. При этом поверхность жидкости охлаждается. За счет теплового движения молекулы постепенно распространяются за пределы открытого сосуда. Плотность пара жидкостей по воздуху больше единицы, т.е. пар тяжелее воздуха. Он оседает вниз, скапливаясь на поверхности земли, пола и т.п. В результате длительного испарения могут образовываться взрывоопасные паровоздушные облака очень большой протяженности - до нескольких десятков и даже сотен метров.
Рис.10.1. Схема испарения жидко- |
Рис.10.2. Схема парообразования |
сти из открытого сосуда |
в закрытом сосуде |
Пар по своим свойствам во многом аналогичен газу, поэтому его п о- жарная опасность характеризуется всеми показателями пожарной опасности газов. Концентрация пара по высоте над зеркалом жидкости в открытом со-
суде монотонно уменьшается от ϕнас. до 0. На характер зависимости не оказывает влияние температура и вид жидкости.
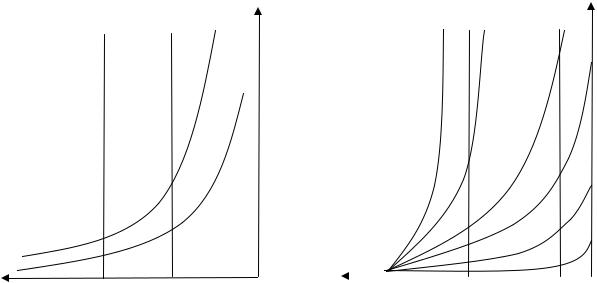
Иначе ведут себя жидкости в закрытом сосуде (рис. 10.2). В этом случае пары уже не могут рассеиваться в окружающую среду. По мере испарения концентрация пара за время τ0 до τиспар. в свободном пространстве сосуда повышается и в итоге достигает состояния насыщения. Устанавливается динамическое равновесие, за время при котором количество испаряющихся
184
молекул жидкости равно количеству молекул пара конденсирующихся обратно в жидкость. Такой пар называют насыщенным, а его парциальное давление - давлением насыщенного пара Рs Как правило, давление насыщенного пара обозначается Рs. Концентрация насыщенного пара во всем закрытом объеме одинакова.
Н |
|
|
|
|
|
Н |
|
|
|
|
|
|
|
а |
б |
|
|
τ4 |
|
|
|
|
|
|
τs |
τ3 |
|
τ2 |
|
|
|
|
τ2 |
|
|
|
|
|
|
|
|
τ1 |
|
|
|
|
|
τ1 |
|
|
|
|
|
τn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
φ, % об НКПР ВКПР |
φ, % об |
|
НКПР |
ВКПР |
||
Рис. 10.3 Изменение концентрации паров от высоты над уровнем жидко-
сти и времени.
а - открытая емкость; б - закрытая емкость; τ- время, τn>τ
Давление насыщенного пара горючих жидкостей часто используется в пожарно-технических расчетах.
Зависимость давления насыщенного пара от температуры описывается
уравнением Клапейрона - Клаузиуса: |
|
в дифференциальной форме: |
|
dlnP/dT = Qисп/(RT2), |
(10.1) |
или в интегральной форме: |
|
Ps = P0 exp(-Qисп/(RT0), |
(10.2) |
где Рs - давление насыщенного пара; |
|
185
Qисп - мольная теплота испарения жидкости.
Помимо уравнения Клапейрона - Клаузиуса давление насыщенных паров может быть рассчитано по эмпирическому уравнению Антуана:
lgPs = А - В/(t + C), (10.3)
Уравнение Антуана для большого числа горючих жидкостей приведено в справочной литературе.
Расчет давления |
Пример 10.1. Определить давление насыщенно- |
насыщенного пара по |
го пара толуола С6Н5СН3 при температуре |
уравнению Антуана |
200С по уравнению Антуана. |
|
|
|
|
Решение:
В пожарных расчетах наиболее распространенным способом определения давления насыщенного пара при заданной температуре является расчет по уравнению Антуана:
|
B |
|
|
( А− |
B |
) |
|
|
|
|
|||
lg P = А− |
; |
Рs =10 |
|
C+tP , |
||
C + tP |
|
|||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
Рs - давление насыщенного пара, кПа; |
|
|
|
|||
tР - рабочая (заданная) температура, |
0С; |
|
|
|
||
А, В, С - константы уравнения Антуана из справочной литературы [17]. ( таблица 5 приложения).
Для нашей задачи: tР = 200С;
А = 6,0507; В = 1328,17; С = 217,713.
|
|
(6,0507− |
1328,17 |
) |
|
|
Р |
= 10 |
217,713+20 |
= 2,9 кПа. |
|||
|
|
Зная давление насыщенного пара, можно рассчитать его концентрацию в паро-воздушной смеси и установить пожарную опасность смеси насыщенного пара с воздухом.
Расчет объемной |
Пример 10.2. Резервуар заполнен бензолом С6Н6. Вы- |
концентрации паров по |
числить объемную и массовую концентрацию паров бен- |
давлению насыщенного |
зола в свободном пространстве резервуара. Температура |
100С, давление 780 мм рт.ст. |
|
пара |
|
Решение:
Зная величину давления насыщенного пара в емкости, можно определить объемную концентрацию паров жидкости при данных условиях. Величина давления насы-

186
щенного пара не зависит от объема жидкости в резервуаре.
Объемная концентрация паров (газов) в замкнутом объеме рассчитывается через давление насыщенного пара по формуле:
ϕОБ = PPs 100 , % ,
АТМ
где
ϕОБ - объемная концентрация газа или пара, %;
Р S- давление насыщенного пара при данной температуре, мм рт.ст., кПа, МПа, атм; Р s рассчитывают по уравнению Антуана или определяют по номограмме.
Р АТМ - внешнее давление, мм рт.ст., кПа, МПа, атм.
При температуре 100С для бензола Р ПАР = 40 мм рт.ст.( по номограмме). Тогда
ϕОБ = 78040 100 = 5,1 %
Определяем массовую концентрацию паров бензола.
Для этого воспользуемся формулой для определения массовой концентрации паров
ϕМАС = Ps М PАТМ VМ
где ϕМАС - массовая концентрация, кг(г)/м3;
Рs - давление насыщенного пара, мм рт.ст., кПа, МПА, атм;
РАТМ - внешнее давление, мм рт.ст., кПа, МПа, атм;
М - молярная масса вещества, г/моль, кг/кмоль,
VМ - молярный объем газа или пара, л/моль, м3/кмоль.
Для нашей задачи:
М ( С6Н6 ) = 78 кг/кмоль; VМ необходимо рассчитать.
VМ = 760 22,4 283 = 22,6 м3/кмоль. 273 780
Рассчитаем массовую концентрацию паров бензола.
ϕМАС = 78040 2278,6 = 0177, кг/м3 = 177 г/м3.
Зная концентрационные пределы распространения пламени вещества и объемную концентрацию его паров, можно оценить взрывоопасность паров при заданной температуре. Так КПР бензола составляет от 1,4 до 7,1 % (объемных). Сравним этот интервал с полученной объемной концентрацией паров бензола при заданных условиях – 5,1 %. Можно сделать вывод, что данная концентрация паров бензола взрывоопасна.
