
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •РАЗДЕЛ I. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ
- •ГЛАВА 1. ГОРЕНИЕ – ОСНОВНОЙ ПРОЦЕСС НА ПОЖАРЕ
- •1.1. Определение горения
- •1.2. Характеристика участников процесса горения
- •1.4. Опасные факторы пожара
- •ГЛАВА 2. МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
- •2.1. Расчет объема воздуха, необходимого для горения
- •2.1.1. Горючее – индивидуальное химическое соединение
- •2.1.2. Горючее – смесь газов и паров
- •2.2.1. Горючее – индивидуальное химическое соединение
- •2.2.2. Горючее – смесь газов и паров
- •2.2.3. Горючее – сложное вещество с известным элементным составом
- •2.3. Продукты сгорания. Дым и его характеристики
- •ГЛАВА 3. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
- •3.1. Уравнение теплового баланса процесса горения
- •3.3. Расчет температуры горения
- •РАЗДЕЛ II. ТЕОРИИ ГОРЕНИЯ
- •4.1. Тепловая теория горения
- •4.1.1. Механизм химических реакций при горении
- •4.1.2. Факторы, влияющие на скорость реакций горения
- •4.2. Цепная теория горения
- •4.3. Диффузионная теория горения
- •ГЛАВА 5. ПЛАМЯ И ЕГО РАСПРОСТРАНЕНИЕ В ПРОСТРАНСТВЕ
- •5.1. Виды пламени
- •5.2. Структура пламени
- •5.3. Процессы, протекающие в пламени
- •5.4. Скорость распространения пламени
- •5.5. Характер свечения пламени
- •IV.I. ВОЗНИКНОВЕНИЕ ГОРЕНИЯ
- •ГЛАВА 6. САМОВОСПЛАМЕНЕНИЕ
- •ГЛАВА 7. САМОВОЗГОРАНИЕ
- •7.1. Механизм процесса самовозгорания веществ
- •7.2. Самовозгорание жиров и масел
- •7.3. Самовозгорание химических веществ
- •ГЛАВА 8. ВЫНУЖДЕННОЕ ВОСПЛАМЕНЕНИЕ (ЗАЖИГАНИЕ)
- •8.2. Закономерности перехода самовоспламенения к зажиганию
- •8.3. Зажигание нагретым телом
- •8.4. Элементы тепловой теории зажигания
- •8.6. Элементы тепловой теории зажигания электрической искрой
- •8.8. Зажигание твердых и жидких горючих веществ
- •8.9. Зажигание лучистым тепловым потоком
- •8.10. Основные виды и характеристики источников зажигания
- •IV.II. РАЗВИТИЕ ПРОЦЕССОВ ГОРЕНИЯ
- •ГЛАВА 9. ГОРЕНИЕ ГАЗОПАРОВОЗДУШНЫХ СМЕСЕЙ
- •9.1. Концентрационные пределы распространения пламени
- •9.2. Факторы, влияющие на КПР
- •9.2.1. Зависимость КПР от химической природы горючего вещества
- •9.2.2. Влияние начальной температуры смеси на КПР
- •9.2.3. Влияние давления горючей смеси на КПР
- •9.2.4. Влияние флегматизаторов и ингибиторов на КПР
- •ГЛАВА 10. ГОРЕНИЕ ЖИДКОСТЕЙ
- •10.1. Условия для возникновения горения жидкостей
- •9.2. Температурные пределы распространения пламени
- •10.3. Скорость испарения жидкости
- •10.4. Температура вспышки. Температура воспламенения жидкости
- •10.5. Механизм теплового распространения горения жидкостей
- •10.7. Распределение температуры в горящей жидкости
- •10.8. Вскипание и выброс при горении резервуара с ГЖ
- •ГЛАВА 11. ГОРЕНИЕ ТВЕРДЫХ ВЕЩЕСТВ И МАТЕРИАЛОВ
- •11.2. Основные закономерности процессов горения органических твердых горючих материалов
- •11.4. Гетерогенное горение
- •11.5. Горение металлов
- •11.6. Особенности горения пылевидных веществ
- •РАЗДЕЛ V. ВЗРЫВЫ.
- •ГЛАВА 12. ВЗРЫВЫ. УДАРНЫЕ ВОЛНЫ И ДЕТОНАЦИЯ
- •12.1. Основные определения. Типы взрывов
- •12.4. Основные свойства и параметры ударной волны
- •12.6. Взрывчатые вещества
- •12.6.1. Краткие сведения об основных взрывчатых веществах
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
- •Приложение 5
106
РАЗДЕЛ IV. УСЛОВИЯ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ ПРОЦЕССОВ ГОРЕНИЯ
IV.I. ВОЗНИКНОВЕНИЕ ГОРЕНИЯ
ГЛАВА 6. САМОВОСПЛАМЕНЕНИЕ
6.1.Радикально-цепной механизм процессов окисления
иего основные закономерности
Процессы самовоспламенения могут протекать по цепному и по тепловому механизму. Теория этих процессов разработана академиком
Н.Н. Семеновым и его школой.
Рассмотрим механизм радикально-цепных реакций на примере горения водорода и углеводородов.
Заполним сосуд стехиометрической смесью Н2:О2 = 1:1 по объему и будем медленно нагревать его со всех сторон. При определенной температуре в сосуде возникнут химические превращения. Взаимодействие водорода с кислородом начинается со следующей эндотермической реакции:
H2 + О2 → 2 ОН - 67 кДж/моль, зарождение цепи. |
/1/ |
Далее происходит развитие цепи: |
|
продолжение |
|
ОН + Н2 → Н2О + Н + 44 кДж/моль, |
/2/ |
разветвление |
|
Н + О2 → ОН + О − 54 кДж/моль, |
/3/ |
О + H2 → ОН + Н |
/4/ |
Н + О2 + Н2 → 2 ОН + Н − 42 кДж/моль. |
/5/ |
107
На каждой элементарной стадии процесса образуются один (продолжение) или два (разветвление цепи) радикала. Наконец, когда концентрация активных центров станет достаточно большой, все более заметными становятся реакции обрыва цепи:
Н + ОН → Н2О, |
/6/ |
ОН + Н → Н2О, |
/7/ |
Н + Н → Н2, |
/8/ |
Н + стенка → обрыв, |
/9/ |
ОН + стенка → обрыв. |
/10/ |
Таким образом, окисление водорода представляет собой непрерывную и разветвляющуюся цепь последовательных превращений активных частиц (молекул, атомов, радикалов), т.е. радикально-цепной процесс с разветвлением. Цепь сильно ветвится, и концентрация активных центров лавинообразно нарастает, т.е. реакция самоускоряется, что в конечном итоге приводит к самовоспламенению.
В целом по аналогичному механизму, но несколько медленнее, протекают процессы окисления углеводородов, хотя в зависимости от вида горючего многие элементарные стадии будут различными. Окисление углеводородов обычно протекает по следующим типичным элементарным стадиям:
RH + О2 → R + НО2 |
зарождение цепи |
/11/ |
R + О2 → ROO (или R’-CH-OO ) продолжение цепи |
/12/ |
|
На этой стадии образуется пероксидный радикал. Далее превращение этого радикала протекает по двум конкурирующим направлениям в зависимости от температуры. Так, при температурах ниже примерно 400°С образуется гидропероксид:
ROO + HR → ROOH + R , |
/13/ |
который далее распадается на два новых радикала: |
|
ROOH → RO + ОН вырожденное разветвление. |
/13а/ |
108
При температурах выше 400°С часть пероксидных радикалов изомери-
зуется и, распадаясь, превращается в альдегид: |
|
R’-CH2-OO → R’- CH-О-OH → R’-CHO + ОН |
/14/ |
и далее - вырожденное разветвление: |
|
R’-CHO + O2 → R’-CO +HO |
/14а/ |
Реакции вырожденного разветвления /13/ и /13а/ протекают при низких давлениях и могут привести к возникновению так называемых "холодных пламен".
При высоких давлениях и температуре цепь разветвляется по реакциям /14/ и /14а/ и возникает "горячее" пламя. Горячие пламена от холодных отличаются также тем, что в них кроме конечных продуктов СО2 и Н2О в заметных количествах образуются оксид углерода СО, а также радикалы :С=С: и :СН , при рекомбинации которых получается сажа. Процессы цепного самовоспламенения других органических горючих веществ во многом аналогичны.
Характерной особенностью разветвленных цепных реакций является незначительное количество активных центров, появляющихся в результате теплового движения молекул. Основная их часть образуется в результате разветвления цепи. Их концентрация n определяется скоростью начального инициирования цепи Wo, а также скоростью разветвления и обрыва цепей. Сумма этих трех скоростей представляет собой общую скорость образования активных центров. Тогда в дифференциальной форме выражение для скорости цепной разветвленной реакции окисления будет иметь следующий вид:
dn / dt = w0 + f n - g n = wo + (f-g)n, |
(6.1) |
где Wo - скорость начального инициирования активных центров; f - константа скорости разветвления цепи;
g - константа скорости обрыва цепи; n - концентрация активных центров.
109
Скорость образования активных центров в начальной стадии зависит в известной степени от температуры и, в большей степени, от давления горючей смеси. Увеличение температуры повышает только скорость инициирования радикалов и скорость разветвления цепей. Скорость обрыва цепей от температуры не зависит, так как рекомбинация радикалов протекает без энергии активации. Изменение давления влияет, главным образом, на скорость обрыва цепей.
При низких давлениях преобладает обрыв цепей на стенках сосуда, при высоких - в объеме горючей смеси.
Если скорость разветвления цепи меньше скорости обрыва (f < g), то реакция протекает спокойно, как обычная цепная неразветвленная реакция (рис.6.1). Если же f > g, то в этом случае имеет место лавинообразное нарастание концентрации радикалов, а следовательно, и скорости самой реакции.
Интегрирование уравнения (5.1) приводит к выражению:
n ≈ wo/(f-g) [exp(f-g)τ-l], |
(6.2) |
из которого видно, что через каждые τ = 1/(f-g) сек концентрация радикалов n, а следовательно, и скорость цепной реакции возрастает в е раз, и за время порядка нескольких интервалов 1/(f-g) практически полное отсутствие реакции сменяется взрывным протеканием процесса. Иными словами, после некоторого периода индукции происходит самовоспламенение смеси.

ω=ddnτ
110
(4.14; 4.14а)
(4.13; 4.13а)
τинд |
время, τ |
Рис. 6.1. Суммарная скорость разветвленных цепных реакций
Период индукции - это начальный период реакции, в течение которого скорость реакции неизмеримо мала, и который далее сменяется периодом быстрого развития химического превращения. То есть период индукции - это период накопления активных центров (рис.6.1).
6.2. Элементы тепловой теории самовоспламенения горючих смесей
Самовоспламенение по цепному механизму с образованием холодных пламен происходит нечасто, в основном под пониженным давлением, и не сопровождается резким повышением температуры реагирующей смеси. Цепной механизм учитывает только химическую сторону процесса. Но при горении выделяется большое количество теплоты, которая оказывает существенное влияние на протекание процесса.
Поместим в герметичный сосуд объемом V и с температурой стенок То горючую газо-воздушную смесь с температурой Т. В смеси начнутся реакции окисления со скоростью:
|
|
111 |
W = А Crop Сокβ е− |
Еа |
(6.3) |
RT |
где А – фактор соударений;
Cгop, Сок - концентрация горючего и кислорода; Еа - энергия активации;
R - универсальная газовая постоянная;
β - стехиометрический коэффициент при горючем в уравнении реакции горения.
Выделяющаяся теплота (q+) будет расходоваться на нагрев смеси и
рассеиваться в окружающую среду: |
|
||
q+ = Qгop W V, кДж/с, где |
(6.4) |
||
Qгор - тепловой эффект реакции, кДж/моль; |
|
||
V - объем сосуда, м3, |
|
||
или |
|
||
q+ = Qгop V А Crop Сокβ е− |
Еа |
(6.5) |
|
RT |
|
||
А каков будет теплоотвод?
Если температура смеси Т будет выше температуры стенки То, т.е.
Т > То, то смесь будет отдавать теплоту стенке, и вычислить такой тепловой
поток можно по формуле Ньютона: |
|
q_ = α (Т − То), кДж/м2 с, |
(6.6) |
где α - коэффициент теплоотдачи, кДж/м2 град. |
|
С учетом общей поверхности сосуда S получается следующее выраже- |
|
ние для расхода теплоты: |
|
q_ = α (Т − То ) S, кДж/c. |
(6.7) |
Анализ полученных выражений (6.5) и (6.7) показывает, как и почему будет меняться тепловое состояние системы в зависимости от температуры стенки сосуда и самой горючей смеси. Графически q+ представляет собой экспоненциальную зависимость, а q_ - прямую линию (рис.6.2).
Рассмотрим состояние системы при температуре стенки T01 = const. Пусть Т будет меньше T01 (начало графика). Здесь приход теплоты выше расхода, т.е. q+ > q_, поэтому смесь будет нагреваться, и в точке А устано-
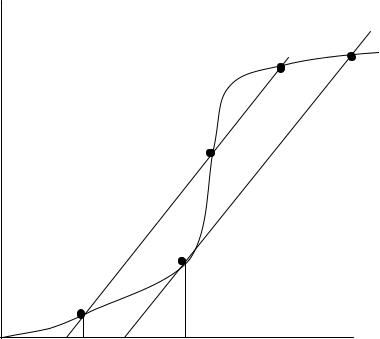
112
вится равновесие. В этой точке, естественно, химическая реакция продолжается, но при малейшем повышении температуры смеси система вновь вернется в эту точку, поскольку там (справа от точки А) расход теплоты выше прихода. При смещении влево система опять же вернется в точку А, поскольку здесь наоборот приход теплоты больше расхода. Таким образом, в точке А система находится в состоянии устойчивого равновесия, и реакция будет спокойно идти до полного расходования компонентов или ее вообще не будет.
q |
|
|
|
q− |
|
|
|
Г |
q+ |
|
|
|
|
|
|
|
В |
|
|
|
|
С |
|
|
А |
|
|
|
|
01 |
Т02 |
с |
|
Т |
Т |
|
Т |
|
|
Рис.6.2. Изменение выделения q+ и отвода q_ теплоты |
||||
|
в зависимости от температуры. |
|||
Теперь повысим температуру стенок сосуда до Т02. Прямая теплоотвода сместится параллельно самой себе вправо, и кривая прихода будет касаться ее в единственной точке С. Вначале горючая смесь будет нагреваться от температуры Та до Тс , и система перейдет в точку С, установится равновесие

113
(q+ = q_). При малейшем увеличении температуры смеси выше Тс система тут же сместится вправо, а там приход теплоты превышает расход. Поэтому смесь будет стремительно по экспоненциальному закону нагреваться до самовоспламенения. То есть произойдет тепловой взрыв. Следовательно, температура стенки Т02, для которой прямая отвода теплоты – касательная кривой выделения, является предельной для существования стационарного ре-
жима, т.е. критической температурой самовоспламенения.
Таким образом, критическими условиями самовоспламенения являются:
1. q+ = q_ ; 2. dqdT+ = dqdT−
При превышении тепловыделения над теплоотводом произойдет самовоспламенение смеси.
Как видно из рисунка 6.2., критическая температура самовоспламене-
ния несколько ниже истинной температуры самовоспламенения Тс. Для
саморазогрева горючей смеси от температуры Т02 до Тс необходимо время,
которое называется индукционным периодом теплового взрыва (самовос-
пламенения).
Величина индукционного периода в ряде случаев достигает пяти и более секунд. Следует отметить, что реальные системы находятся либо под атмосферным, либо под повышенным давлением. Поэтому в них не реализуется в чистом виде только цепной или только тепловой механизм самовоспламенения. На практике в большинстве случаев механизм самовоспламенения смешанный, цепочечно-тепловой, но рассмотренные здесь закономерности остаются справедливыми и для такого смешанного механизма.

114
6.3. Температура самовоспламенения как показатель пожарной опасности, практическое значение и методы ее определения
Температура самовоспламенения - это наименьшая температура окружающей среды, при которой в условиях специальных испытаний наблюдается самовоспламенение вещества.
Температура самовоспламенения относится к числу важнейших показателей пожарной опасности. Ее используют при оценке пожаровзрывоопасности веществ, при определении группы взрывоопасности горючей смеси и т.д.
Практическое определение температуры самовоспламенения основывается на следующих теоретических предпосылках (см. рис.6.2). В точке С устанавливается равенство прихода и расхода теплоты, т.е. q+ = q_. Подставив сюда соответствующие выражения для тепловыделения (6.5) и теплоот-
вода (6.7), получим уравнение теплового баланса для точки С:
Еа |
(6.8) |
Qгop V А Crop Сокβ е− RT = α (Т − То ) S |
Разделим обе части уравнения на величину объема V:
Qгop А Crop Сокβ е− RTЕа = α (Т − То ) VS (6.9)
Левая часть этого выражения представляет собой скорость выделения теплоты в единице объема горючей смеси, а правая - скорость отвода через поверхность стенок сосуда из этой же единицы объема.
Выражение (6.9) показывает, что температура самовоспламенения не является физической константой горючих веществ, и зависит от множества факторов: от размера и формы сосуда (S/V); от химических свойств горючего и его способности к окислению (тепловой эффект Q энергия активации Еа), от концентрации реагирующих веществ (Cгop и Сок) и, наконец, от теплофизических свойств горючей смеси и материала стенки сосуда (коэффициент теплоотдачи α).
115
Отношение площади стенок к объему S/V называется удельной поверхностью и имеет размерность 1/м или м-1. Величина удельной поверхности существенно влияет на теплоотвод и, тем самым, на величину температуры самовоспламенения. Чем больше величина удельной поверхности S/V, тем больше значение Тсв.
Рассмотрим, как будет меняться температура самовоспламенения при изменении объема сосуда, т.е. при изменении отношения площади стенок к объему S/V? Например, для куба с гранью «а» удельная поверхность будет равна S/V = 6а2/а3 == 6/а. (6.10)
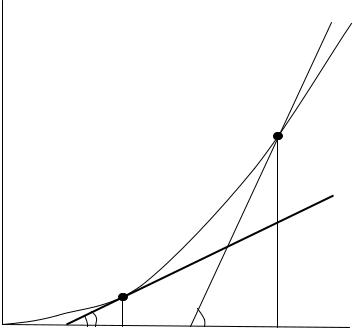
Предположим, что в уравнении (6.9) теплового баланса меняется только температура в точке С. Тогда левая часть уравнения изменяться не будет, и соответствующая ей кривая тепловыделения останется на прежнем месте. Правая часть уравнения - прямая линия, которая касается кривой в точке С. Величина αS/V есть угловой коэффициент этой прямой или tgβ - угла ее наклона к оси абсцисс (см. рис.6.3)
q
q+ q−
|
|
С |
|
|
q−1 |
С′ |
|
|
δ′ |
|
δ |
|
|
|
Т′0 Т′С |
Т0 |
ТС |
Рис.6.3. Изменение теплового баланса горючей смеси при увеличении объема сосуда.
116
Увеличим грань куба в три раза. Его удельная поверхность станет равной:
S / V = 6(3а)2 / (За)3 = 2 /а, |
(6.11) |
т.е. уменьшится в три раза, значит уменьшится и сам угол β. В этом случае прямая теплоотвода будет располагаться ниже предыдущей прямой, и точка С в месте с ней переместится в точку C1, а значит будет ниже и критическая температура самовоспламенения. Следовательно, с увеличением объема сосуда температура самовоспламенения снижается. Увеличить теплоотвод можно не только уменьшением объема горючей смеси, но и приданием ей соответствующей формы.
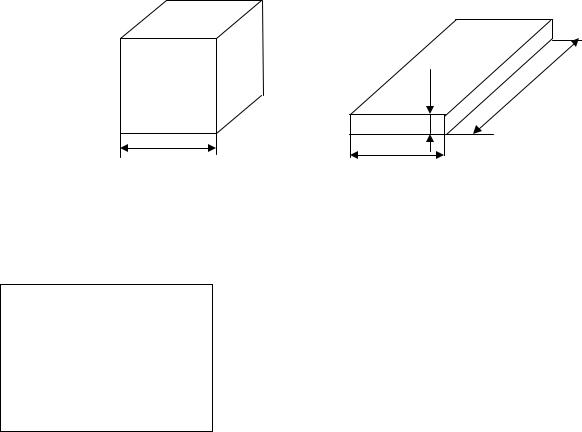
На рис.6.4 изображены равные объемы разной формы. При нагреве в кубе происходит самовоспламенение, а в пластине - нет.
2∙10-2 |
2∙10-3
2∙10-2 |
Рис.6.4. Равновеликие объемы разной формы сосудов с горючей смесью (размеры даны в метрах)
8∙10-1
Зависимость
температуры самовоспламенения от величины удельной поверхности
Решение:
1. Для куба (сосуд № 1)
Пример 6.1. Имеются три сосуда с горючей паро-
воздушной смесью при одинаковых внешних условиях. Сосуд № 1: куб с ребром а = 5 см; Сосуд № 2: параллелепипед с размерами а = 25 см,
b = 5 см, с = 1 см;
Сосуд № 3: шар диаметром d = 6,2 мм.
В каком из сосудов наибольшая температура самовоспламенения?

117
S = 6 52 = 150 см2
V = 53 = 125 см3
VS = 150125 = 1, 2 см-1
2. Для параллелепипеда (сосуд № 2)
S = 25 5 2 + 5 1 2 + 25 1 2 = 250 + 10 + 50 = 310 см2
V = 25 5 1 = 125 см3
VS = 125310 = 2, 48 см-1
3. Для шара (сосуд № 3)
S = πd2 = 3,14 6,22 = 120,7 см2 |
|
||||||||||
V = |
4 |
3 |
|
|
4 |
3,14 |
3,13 |
3 |
|||
3 πr |
|
= |
|
3 |
= 124,7 |
≈ 125 см |
|||||
|
S |
120,7 |
|
|
|
-1 |
|
||||
|
|
= |
|
|
= |
0,97 см |
|
||||
V |
|
124,7 |
|
||||||||
Объем реакционных сосудов примерно одинаков, а площадь теплоотвода различа-
ется.
Наибольшее значение S/V у сосуда № 2, следовательно, в нем будет наибольшая температура самовосплаименения, а наименьшее значение Тсв в реакционном сосуде в форме шара.
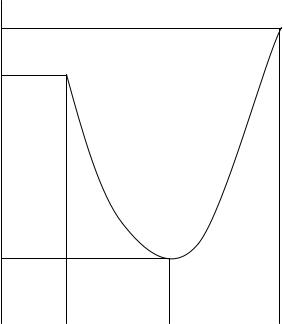
Температура самовоспламенения зависит от состава горючей смеси, принимая минимальное значение при стехиометрическом соотношении компонентов (рис.6.5). Эта зависимость используется для экспериментального определения Тс. Начиная с некоторых предельных значений, смеси как бедные, так и богатые не способны воспламеняться. Это подтверждается экспериментально. Например, кривая зависимости Тс = f(C) для оксида углерода имеет минимум при 20 %.
118
ТВ
ТН
ТС
|
|
|
|
|
СН |
ССТЕХ |
СВ |
С,% |
|
Рис. 6.5. Зависимость температуры самовоспламенения от состава смеси
Скорость реакции горения зависит от давления и катализаторов, поэтому температура самовоспламенения зависит также и от этих факторов (табл.6.1).
Таблица 6.1
Зависимость температуры самовоспламенения от давления
Вещество |
|
|
|
|
-5 |
Па: |
|
|
|
|
Тс, К при давлении р 10 |
|
|
||||
|
1,013 |
5,065 |
10,13 |
15,18 |
|
20,26 |
25,23 |
|
Бензин |
753 |
623 |
583 |
563 |
|
553 |
523 |
|
Бензол |
953 |
893 |
893 |
793 |
|
773 |
763 |
|
Катализаторы, как известно, делятся на положительные (ускоряющие) и отрицательные (замедляющие реакцию – ингибиторы). Положительные катализаторы снижают температуру самовоспламенения, а отрицательные - повышают. Каталитическими свойствами могут обладать стенки сосуда, в ко-
119
тором находится горючая смесь. С увеличением каталитической активности материала стенки сосуда Тс снижается.
Температура самовоспламенения смеси горючих веществ обычно не подчиняется правилу аддитивности. Так, например, температура самовос-
пламенения смеси метанола и диэтилового эфира разного состава всегда ниже рассчитанной по правилу аддитивности.
Таким образом, приведенные данные показывают, что температура самовоспламенения действительно не является константой, а зависит от множества факторов. Истинное ее значение в точке С на рис.6.2 экспериментально можно определить только путем прямого измерения температуры. Однако современные средства измерений не позволяют пока это сделать с достаточной степенью точности, поскольку неизвестно, в какой именно точке объема горючей смеси возникает первоначальный очаг горения. Тепловая теория самовоспламенения подсказывает выход из данной ситуации. В точке касания С, с одной стороны, существует равенство тепловыделения и теплоотвода. С другой стороны, в точке С каждая функция является касательной к другой, т.е. производные по температуре от q+ и q_ также должны быть равны между собой В математической форме это будет иметь следующий вид:
Qгop V ko Cгop Cок exp(-E/RTc) = α (T-To)-S |
(6.12) |
и для производных: |
|
Qгop V ko Cгop Cок exp(-E/RTc) E/RTc2 = a S |
(6.13) |
Разделив (6.12) на (6.13), получим: |
|
RTc2/E = Tc - To. |
(6.14) |
Путем несложных математических преобразований из этого квадратного уравнения можно найти выражение для Тс, которое будет иметь вид:
Тс = То + RTc2 / Е. |
(6.15) |
120
Из рис.6.2 видно, что при самовоспламенении смесь в сосуде нагревается от температуры То до Тс. Расчеты показывают, что разница между ними невелика. Например, для углеводородов она равна всего 30 °С.
Это обстоятельство используется на практике: за температуру самовоспламенения принимается наименьшая температура стенки сосуда, при которой происходит самовоспламенение.
Так как температура самовоспламенения сильно зависит от условий ее определения (от материала сосуда, его формы, размеров и т.д.), то чтобы исключить этот отрицательный момент, в нашей стране и за рубежом законодательным путем установлены одинаковые для всех лабораторий условия испытаний, зафиксированные в ГОСТе 12.1.044-89. Следует отметить, что методика эта универсальна и применяется для определения температуры самовоспламенения газов, жидкостей и твердых горючих веществ.
В настоящее время температура самовоспламенения определена для многих веществ, и ее можно найти в справочной литературе. Однако не для всех. Для алканов, ароматических углеводородов и алифатических спиртов она может быть приближенно рассчитана по условной средней длине молекулы соединения.
Задания для самоконтроля
1.Что называется самовоспламенением?
2.Что называется свободным радикалом?
3.Как влияет повышение температуры на скорость инициирования радикалов, скорость разветвления цепей и скорость обрыва цепей?
4.За какое время скорость цепной реакции возрастает в "е" раз?
5.Напишите выражения для скорости реакции окисления.
6.Напишите выражения для скорости тепловыделения и теплоотвода.
7.Как зависит скорость теплоотвода от площади поверхности теплоотвода?
8.Как зависит скорость теплоотвода от объема реакционной смеси?
9.Изобразите графически изменение тепловыделения от температуры.
10.Изобразите графически изменение теплоотвода от температуры.
11.Изобразите графически ситуацию, когда тепловыделение всегда больше тепло-
отвода.
12.Изобразите графически ситуацию, при которой теплоотвод всегда превышает тепловыделение.
13.Какая температура называется температурой самовоспламенения?
