
- •1Вопрос Модель строения атома
- •2Вопрос
- •3Вопрос
- •4Вопрос
- •5Вопрос
- •8Вопрос
- •Вопрос 9 Химичёская термодинамика, термодинамические параметры (т, р, V). Внутренняя энергия. Первый закон термодинамики.
- •Вопрос10 Энтальпия образования вещества. Закон Гесса и его применение.
- •Вопрос 12. Свободная энергия Гиббса. Самопроизвольность протекания реакций. Свободная энергия Гиббса
- •Вопрос 13
- •Вопрос14.
- •Вопрос 15.
- •16Вопрос
- •17Вопрос
- •18Вопрос
- •19Вопрос
- •Вопрос 20.
- •21Вопрос
- •22Вопрос
- •23Вопрос
- •24Вопрос
- •25Вопрос
- •Вопрос 35.
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •56 Вопрос
- •57. Защитные покрытия: виды, методы нанесения, области применения.
- •58. Полимеры. Способы получения. Реакции полимеризации и поликонденсации.
- •59. Природные полимеры: целлюлоза, белки, природный каучук.
- •60. Синтетические полимеры. Конденсационные смолы.
24Вопрос
Смотреть тетрадь 15 страница растворы
25Вопрос
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
|
(1) |
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8×10−16моль/л. Уравнение (1) можно переписать как:
|
(2) |
Обозначим произведение K·[H2O] = Kв = 1,8×10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
26,27,28вопросы
Смотреть в тетрадке 17-20 страницы(Гидролиз)
29
Дисперсные системы. Классификация дисперсных систем. Дисперсные системы - это гетерогенные системы, которые состоят из 2 составляющих: дисперсной фазы(д.ф.) и дисперсной среды(д.с.).Дисперсную фазу составляют раздробленные частицы(т.е. более крупные частицы), равномерно распределенные в дисперсионной среде. Дисперсионная среда – это та среда, в которой равномерно распределены частицы дисперсной фазы. К дисперсным относят системы, где средний размер частицы находится в пределах 10-9м <=d<=10-4 ,где d-средний размер частицы. В зависимости от величины частиц дисперсной фазы различают следующие системы:



30.
Коллоидные
системы. Строение коллоидных частиц.
Коллоидные
системы — дисперсные системы,
промежуточные между истинными растворами и
грубодисперсными системами — взвесями.
Или это система, в которой дискретные
частицы, капли или пузырьки дисперсной
фазы, имеющие размер хотя бы в одном из
измерений от 1 до 1000 нм, распределены в
другой фазе, обычно непрерывной,
отличающейся от первой по составу или
агрегатному состоянию и именуемой
дисперсионной средой.
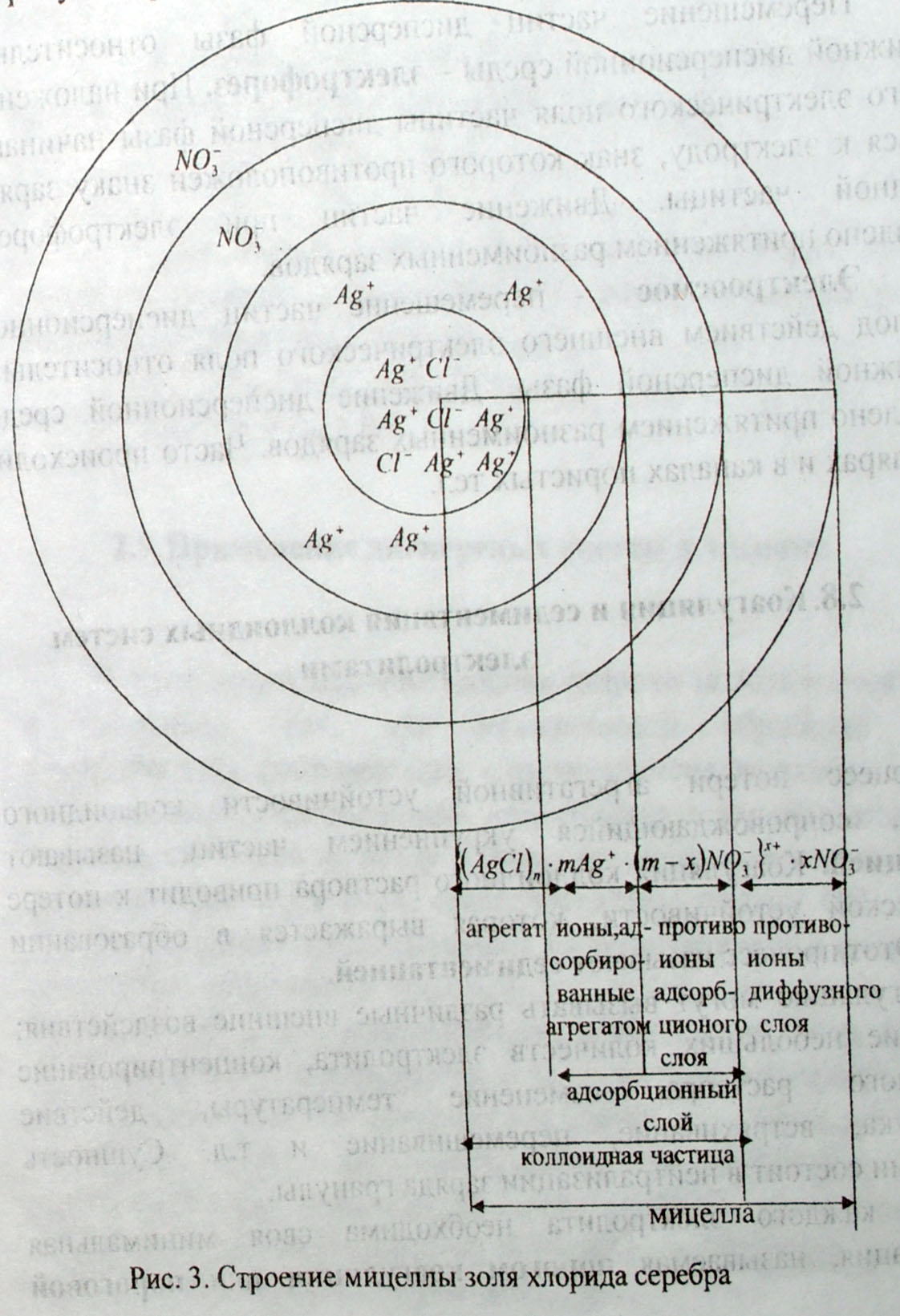
Коллоидная
частица имеет сложное строение. Она
включает в себя ядро, адсорбированные
ионы, противоионы и растворитель.
Рассмотрим процесс образования гидрозоля
и строение его дисперсных частиц на
примере гидрозоля AgCl.
Этот гидрозоль образуется при медленном
приливании водного раствора NaCl
к водному раствору AgNO3,
взятому в избытке. Если ввести сразу
большую порцию раствора NaCl,
то мгновенно выпадает осадок AgCl
и золь не получится. При постепенном
введении раствора NaCl
в раствор AgNO3
в системе в пернвый момент образуются
кристаллические агрегаты (AgCl)n
из ионов Ag+
и Cl-.
Агрегаты (AgCl)n
адсорбируют на своей поверхности те
ионы, которые составляют кристаллическую
решетку и находятся в растворе в избытке.
Этим условиям отвечают ионы Ag+.
В результате адсорбции ионов Ag+
кристаллические агрегаты хлорида
серебра приобретают положительный
заряд. Ионы, адсорбирующиеся на поверхности
кристаллического агрегата, называют
потенциалопределяющими. Наличие
одноименных зарядов на агрегатах
препятствует их объединению и росту
кристаллов AgCl.
Агрегаты AgCl
с адсорбированными на их поверхности
ионами приобретают состояние агрегативной
устойчивости. Кристаллический агрегат
(AgCl)n
вместе с потенциалопределяющими ионами
Ag+
составляет ядро. К заряженному ядру
притягиваются ионы противоположного
заряда – противоионы. Для данной системы
раствор AgNO3
– кристалл AgCl
противоионами будут нитрат-ионы NO3-.
Противоионы, непосредственно примыкающие
к ядру, образуют адсорбционный слой
противоионов. За этим слоем следует
диффузный слой тех же противоионов.
Ядро вместе с противоионами адсорбционного
слоя составляет коллоидную частицу,
или гранулу. Коллоидная частица вместе
с противоионами диффузного слоя
называется мицеллой. Коллоидная частица
всегда заряжена, знак заряда соответствует
знаку заряда потенциалопределяющих
ионов; мицелла в отличие от гранулы
электронейтральна. Формула мицеллы:
![]() в
фигурные скобки заключена гранула.
Ионы, указанные за скобкой, составляют
внешнюю часть мицеллы. Эти ионы под
действием электрического поля отрываются
от мицеллы, и к отрицательно заряженному
электроду будет передвигаться гранула,
заряд которой определяется ионами
серебра, входящими в ядро. Строение
мицеллы и заряд гранулы зависят от
способа получения коллоидного раствора.
Если взять избыток NaCl,
то на поверхности агрегата будут
адсорбироваться хлорид-ионы, имеющиеся
в растворе, а в качестве противоионов
адсорбированного и диффузного слоев
будут выступать ионы натрия
в
фигурные скобки заключена гранула.
Ионы, указанные за скобкой, составляют
внешнюю часть мицеллы. Эти ионы под
действием электрического поля отрываются
от мицеллы, и к отрицательно заряженному
электроду будет передвигаться гранула,
заряд которой определяется ионами
серебра, входящими в ядро. Строение
мицеллы и заряд гранулы зависят от
способа получения коллоидного раствора.
Если взять избыток NaCl,
то на поверхности агрегата будут
адсорбироваться хлорид-ионы, имеющиеся
в растворе, а в качестве противоионов
адсорбированного и диффузного слоев
будут выступать ионы натрия
![]() .
Во внешнем электрическом поле отрицательно
заряженная гранула перемещается к
положительно заряженному электроду.
.
Во внешнем электрическом поле отрицательно
заряженная гранула перемещается к
положительно заряженному электроду.
31.
Получение
и применение коллоидов. Коллоидные
растворы по размерам частиц ДФ занимают
промежуточное положение между
грубодисперсными системами и истинными
растворами.![]() Их можно получить 2 способами:
1)
Измельчание крупных частиц до размеров
коллоидных в присутствии стабилизатора
-диспергирование.
2)
Объединение молекул и ионов в истинных
растворах в более крупные коллоидные
частицы – конденсационные
методы.
Их можно получить 2 способами:
1)
Измельчание крупных частиц до размеров
коллоидных в присутствии стабилизатора
-диспергирование.
2)
Объединение молекул и ионов в истинных
растворах в более крупные коллоидные
частицы – конденсационные
методы.
Конденсационные методы бывают 1) химической конденсации и 2) физической конденсации. 1) Методы химической конденсации. В их основе лежат химические реакции (восстановление, обмен и тд), в результате которых образуются малорастворимые вещества. Необходимое при этом условие – избыток одного из реагирующих веществ, которое играет роль стабилизатора образующихся коллоидных частиц. Например, получение золя иодида серебра реакцией обмена при избытке одного из реагентов: AgNO3+KI->AgI+KNO3. 2) К методам физической конденсации относится метод замены растворителя. Суть метода: в истинном растворе какого-либо вещества хороший растворитель заменяется на плохой для данного вещества. Например, эфирные масла хорошо растворимы в спирте, но нерастворимы в воде. Спирт же и вода взаимно растворяются в любых соотношениях. Так, если в стакан с водой при перемешивании добавлять одеколон или духи, то образуется мутноватый, очень устойчивый коллоидный раствор эфирных масел в воде.
Диспергирование. Эти методы технически осуществляются дроблением, измельчением, истиранием на дробилках, жерновах, шаровых и вибрационных мельницах. Диспергирование ведет, добавляя стабилизирующие вещества, препятствующие слипанию раздробленных веществ. Следует отметить, что коллоидные растворы металлов получают электрическим диспергированием. Эмульсии получают путем диспергирование ультразвуком. Приготовленные золи следует очищать от содержащихся в них примесей электролитов, т к эти в-ва понижают их устойчивость и мешают изучению свойств. Процесс очистки золей наз-ся диализом. Осущ-ся он в приборах – диализаторах, содержащих полупроницаемые перепонки, через которые свободно проходят ионы и молекулы низкомолекулярных веществ, но задерживаются более крупные по размеру коллоидные частицы.
Применение. В технологии машиностроения используются эмульсии и суспензии. Так, при механической обработке металлов употребляются смазывающие и охлаждающие жидкости (СОЖ), то есть жидкости, охлаждающие зону резания и уменьшающие трение стружки, сходящей по резцу. Такими жидкостями являются эмульсии из масла(фрезол) в воде, стабилизированные ионами ОН-. Эмульсии щелочного характера не вызывают коррозии станков и инструментов. Суспензии абразивных материалов в жидкостях или в виде паст используются для доводки поверхностей изделий. Гели кремниевой кислоты широко применяются в сварочной и литейной технологии для производства электродных покрытий, керамических флюсов и литейных форм. Латексы, представляющие собой коллоидные растворы полимеров в воде, используются для нанесения защитных от коррозии полимерных покрытий электрофоретическим методом.
32.
Свойства коллоидных систем. Молекулярно-кинетические свойства, которые связаны с движением дисперсных частиц: 1) Тепловое (броуновское) движение – это случайные перемещения частиц в процессе их собственного теплового движения и под влиянием ударов других частиц дисперсной фазы и дисперсионной среды. 2) Диффузия – это самопроизвольное перемещение частиц в область более низкой концентрации в результате теплового движения. 3) Осмос и осмотическое давление. При разделении 2 растворов различной концентрации или раствора и чистого растворителя полупроницаемой мембраной возникает поток растворителя от меньшей концентрации к большей, выравнивающий в итоге концентрацию. Этот процесс называют осмосом. Осмотическое давление – это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану. 4) Седиментация – самостоятельное оседание частиц под действием силы тяжести.
Оптические св-ва. Размер коллоидных частиц лежит в пределах 10-9-10-7м и именно в связи с такой высокой степенью дисперсности гетерогенность коллоидных растворов нельзя обнаружить с помощью обычного микроскопа. Если наблюдать коллоидные растворы в переходящем свете, то они окажутся совершенно прозрачными, но при боковом освещении они оставляют на пути прохождения пучка света на темном фоне световой след. Образующийся световой конус получил название конуса Тиндаля, а само явление – эффект Фарадея-Тиндаля. Образование расходящегося светового конуса можно также увидеть на темном фоне неба, от луча солнца, проникшего в темную запыленную комнату. В истинных растворах низкомолекулярных веществ рассеяние света ничтожно мало, поэтому конус не наблюдается. Под действием внешнего электрического поля наблюдаются 2 явления: 1) перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды – электрофорез. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак которого противоположен знаку заряда коллоидной частицы. Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. 2) Электроосмос – перемещение частиц дисперсионной среды под действием внешнего эл поля относительно неподвижной дисперсной фазы. Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Часто происходит в капиллярах и в каналах пористых тел.
33
Устойчивость
коллоидных систем. Процесс
потери агрегативной устойчивости
коллоидного раствора, сопровождающийся
укрупнением частиц, называют коагуляцией.
Коагуляция коллоидного раствора приводит
к потере кинетической устойчивости,
которая выражается в образовании осадка.
Этот процесс называют седиментацией.
Коагуляцию могут вызывать различные
внешние воздействия: добавление небольших
кол-в электролита, концентрирование
коллоидного раствора, изменение
температуры, действие ультразвука,
встряхивание, перемешивание и т д. Сущ-ть
коагуляции состоит в нейтрализации
заряда гранулы. Для каждого электролита
необходима своя минимальная концентрация,
называемая порогом коагуляции или
пороговой концентрацией (Спк). Величина,
обратная порогу коагуляции, называется
коагулирующей способностью: Р=1/Спк.
Правила
коагуляции электролитами:
1. Коагуляцию
вызывают ионы, которые имеют знак заряда,
противоположный знаку заряда гранул.
Коагуляцию положительно заряженных
ионов вызывают анионы, отрицательно
заряженных – катионы.
2. Коагулирующее
действие ионов тем сильнее, чем выше
заряд иона коагулянта(правило
Шульце-Гарди)![]() 3.
Для ионов одного заряда коагулирующая
способность зависит от радиуса
сольватированного иона: чем больше
радиус, тем больше коагулирующая
спос-ть:
3.
Для ионов одного заряда коагулирующая
способность зависит от радиуса
сольватированного иона: чем больше
радиус, тем больше коагулирующая
спос-ть:
![]()
34.
Поверхностные явления. Явления, протекающие на границах раздела фаз, а также связанные с изменением концентраций 3го компонента на этих границах, наз-ся поверхностными явлениями. Важнейшее свойство поверхностного слоя состоит в том, что находящиеся в нем молекулы обладают избыточной энергией Гиббса по сравнению с молекулами внутренней части той же фазы. На примере жидкости это можно объяснить след. Образом: для внутренних молекул равнодействующая всех сил равна 0, а для поверхностных молекул она направлена перпендик-но пов-ти внутрь фазы(в воду). Поэтому поверх-ые молекулы стремятся втянуться внутрь жид-ти, вследствие чего пов-ть раздела жид-ти стремится к уменьшению. В свободной капле жидкости стремление к уменьшению пов-ти приводит к ее сферической форме. Для выведения молекул на пов-ть нужно преодолеть эту силу, т е совершить работу и сообщить молекулам определенную энергию, и если площадь пов-ти увеличивается на какую-то величину, то на какую-то величину возрастает и поверхностная энергия. Величина работы, которую необходимо затратить на увеличение пов-ти на 1 см2 численно равна свободной поверхностной энергии на 1 см2 пов-ти и называется поверхностным натяжением сигма σ (Дж/м2 или Н/м). Свободная энергия свободной пов-ти раздела фаз может быть рассчитана по уравнению Gs=σS , где S- площадь пов-ти, σ – поверхностное натяжение на границе раздела фаз. С термодинамической точки зрения коллоидно-дисперсные системы, обладая высокой поверх-ой энергией, являются системами неустойчивыми. В них самопроизвольно должны протекать процессы, уменьшающие поверхностную энергию Gs, например, путем укрупнения частиц дисперсной фазы(уменьшения энтропии). Для чистых жидкостей σ постоянна при данной t. Вещества, понижающие пов-ое натяж-е растворителя, наз-ся поверхностно-активными(ПАВ). Молекулы ПАВ состоят из полярных групп –ОН –NH2 –СООН и др.(«голова») и неполярной части(«хвост»). Такое сост-е придает ПАВ двойственность свойств. Полярная группа гидратируется, что определяет сродство ПАВ к воде – гидрофильность; неполярный радикал обуславливает растворимость этих веществ в воде и придает ПАВ гидрофобность. ПАВ применяется в кач-ве стабилизаторов – спец веществ, не придающих коллоидным растворам устойчивость против укрупнения частиц дисперсной фазы. Изменение концентрации растворенного в-ва в поверхностном слое раствора называют адсорбцией. Если вещество поглощается всем объемом растворителя, то такой процесс называют абсорбцией. Поверхностные явления определяют такие процессы, как пропитку, экстракцию, флотацию, смазку и др. Флотация – метод обогащения полезных ископаемых, основанный на различной смачиваемости водой ценных материалов и пустой породы.

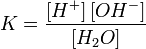 ,
,