- •ФІзична та колоїдна хімія
- •Київ нухт 2011
- •Видання подається в авторський редакції вступ
- •Лабораторна робота № 1 Визначення інтегральної теплоти розчинення солі
- •Теоретичні відомості
- •Опрацювання результатів
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 2 побудова та аналіз діаграм стану обмежено розчинних рідин
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 3 кріометричне визначення молярної маси речовини
- •Теоретичні відомості
- •Кріоскопічні сталі деяких розчинників
- •Визначення температури замерзання чистого розчинника
- •Визначення температури замерзання розчину
- •Завдання на виконання роботи
- •Установки, прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота №4 електропровідність розчинів електролітів
- •Теоретичні відомості
- •Електрична провідність розчинів слабких електролітів
- •Електрична провідність розчинів сильних електролітів
- •Методика виміру електричної провідності
- •Завдання на виконання роботи
- •Опрацювання результатів
- •Оцінка похибки вимірювань
- •Аналіз одержаних результатів, висновки
- •Питання для самоперевірки
- •Лабораторна робота № 5 електрорушійні сили
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота №6 хімічна кінетика
- •Теоретичні відомості
- •Аналіз одержаних результатів, висновки
- •Лабораторна робота №6.2 визначення константи швидкості розчинення бензойної кислоти у воді Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 7 визначення поверхневого натягу розчинів та розрахунок адсорбції на межі поділу розчин – повітря
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання лабораторної роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 8 адсорбція на межі поділу тверде тіло – рідина. Обчислення питомої поверхні адсорбенту
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати розрахунку адсорбції на межі поділу тверде тіло – рідина
- •Питання для самоперевірки
- •Лабораторна робота № 9 методи одержання колоїдних систем
- •Теоретичні відомості
- •Будова колоїдної частинки
- •Прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи № 9.3 Одержання гідрозолю гідроксиду заліза гідролізом хлорного заліза за Крекке
- •Порядок виконання роботи № 9.4 Одержання золю гідроксиду заліза Гремом методом пептизації
- •Порядок виконання роботи № 9.5 Перевірка на ефект Тіндаля
- •Порядок виконання роботи № 9.6 Одержання емульсії типу м/в
- •Одержання емульсії типу в/м
- •Одержання емульсій, стабілізованих порошками
- •Емульсії соняшникової олії у воді
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 10 електрофоретичне визначення електрокінетичного потенціалу
- •Теоретичні відомості
- •Швидкість електрофоретичного перенесення визначають за рівнянням:
- •Градієнт потенціалу дорівнює:
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 11 визначення коагулюючої дії золю гідроксиду заліза та перевірка правила шульце-гарді
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати визначення порогу коагуляції
- •Оцінка похибки вимірювань
- •Питання для самоперевірки
- •Лабораторна робота № 12 визначення кінетики і ступеня набухання желатини
- •Теоретичні відомості
- •Лабораторна робота № 12.1 вагове визначення кінетики набухання желатину у спиртово-водних сумішах
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати дослідження кінетики набухання желатину ваговим методом
- •Лабораторна робота № 12.2 вплив рН на ступінь набухання желатини та визначення ізоелектричної точки методом набухання
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати дослідження кінетики набухання желатину
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 13 визначеня зв`язаної води індикаторним рефрактометричним методом
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Оцінка похибки вимірювань
- •Питання для самоперевірки
- •Література
Кріоскопічні сталі деяких розчинників
Розчинник |
Кк |
Розчинник |
Кк |
Вода Нітробензол Бензол |
1,86 5,90 5,10 |
Фенол Камфора |
7,80 49,00 |
Зниження
тиску насиченої пари над розчином так
само, як і зниження температури замерзання
розчину залежить лише від кількості
часток, молекул, іонів, асоціатів
розчиненої речовини і не залежить від
природи цих частинок. Зазначені
властивості одержали назву колігативних
властивостей
розчинів.
Відомо, що 1 моль речовини вміщує NА=
6,021023
молекул (стала Aвогадро). Однак, якщо
утворення розчину супроводжується
асоціюванням молекул розчиненої
речовини, тобто утворенням часток, що
складаються з груп молекул, при розчиненні
1 моль речовини, утворюється менша
кількість часток у розчині (NNА),
тобто концентрація виявиться меншою
порівняно з тією, що була б за відсутності
асоціації. Це призводить до того, що
зменшення температури замерзання
розчину
![]() виявиться замалим, а розрахована молярна
маса буде завеликою.
виявиться замалим, а розрахована молярна
маса буде завеликою.
При розчиненні електроліту дисоціація його молекул призводить до збільшення кількості частинок у розчині залежно від природи електроліту і ступеня його дисоціації. В цьому випадку (N> NА) концентрація виявиться більшою за розраховану і зниження температури замерзання розчину буде завеликим, а розрахована молярна маса – замалою.
Одержані таким чином молярні маси називають "уявними".
Для
слабкого електроліту відношення істинної
молярної маси Міст
до "уявної" Муяв
показує в скільки разів збільшилась
кількість частинок в розчині внаслідок
дисоціації:
![]()
![]() (3.14)
(3.14)
Число і називається ізотонічним коефіцієнтом. Залежність між ізотонічним коефіцієнтом і та ступенем дисоціації така:
![]() (3.15)
(3.15)
звідки
![]() (3.16)
(3.16)
де – кількість іонів, на які дисоціює молекула в розчині.
Якщо розчинення неелектроліту не супроводжується його асоціацією (наприклад, утворення водних розчинів невеликих концентрацій сахарози, сечовини), кріометричні вимірювання дають істині значення молярної маси. Таким чином, у водних розчинах істинна молярна маса визначається тільки у випадку неелектролітів (сахароза, глюкоза та ін.).
Молярна маса електролітів визначається кріоскопічним методом в органічних розчинниках, у яких розчинена речовина не дисоціює.
Якщо розчинена речовина – електроліт, що розпадається на два іони, використовують рівняння для розрахунку коефіцієнта активності розчиненої речовини :
![]() (3.17)
(3.17)
де
![]() (3.18)
(3.18)
Якщо відомий коефіцієнт активності, можна обчислити активність розчиненої речовини а, моляльна концентрація якої С, г/л:
![]() (3.19)
(3.19)
Визначення температури замерзання чистого розчинника
Найчастіше охолодження рідини до температури замерзання не спричинює утворення твердої фази (льоду). Рідина, що має температуру нижчу за температуру її замерзання, називається переохолодженою. Іноді переохолодження може досягати кількох градусів, що призводить до нових ускладнень при визначенні температур замерзання. Переохолодження неоднаково впливає на визначення температур замерзання розчинника і розчину.
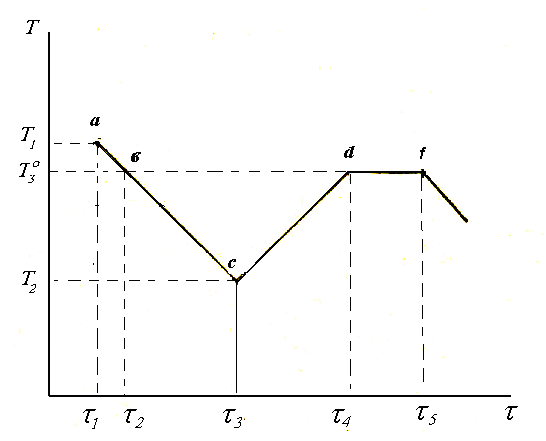
Якщо
зміну температури води з часом подати
в системі координат температура–час,
одержимо криву (рис. 3.2). В початковий
момент часу вода мала температуру
оточуючого середовища T1
– точка а на кривій. До часу 2
вода досягла температури замерзання
![]() –
точка в, але не замерзла і до часу
3, в точці с зазнала
переохолодження до Т2
–
точка в, але не замерзла і до часу
3, в точці с зазнала
переохолодження до Т2
Рис. 3.2. Термографічна крива охолодження води
|
На ділянці вс
відбувалось переохолодження. В точці
с
почали швидко випадати кристали
льоду. Температура замерзаючої води
за рахунок теплоти кристалізації
підвищилась і стала дорівнювати
температурі замерзання
|
, бо в рівновазі співіснують фази: пара–вода–лід. Температура залишається сталою доки в системі існують усі три фази, тобто поки не замерзла вся вода. Замерзання всієї води при охолодженні веде до подальшого зниження температури і, починаючи з точки f, йде охолодження льоду.
На практиці, спостерігаючи меніск у термометрі, при охолодженні рідини будемо бачити, що температура води постійно знижується, потім різко зростає і встановлюється на сталому значенні протягом значного часу. Це й буде температура замерзання води.
Температуру замерзання визначають не менше як два рази. Відхилення не повинно становити більше як 0,01 °С.
Температура переохолодження може бути більшою або меншою залежно від умов заморожування. При перемішуванні вона є набагато меншою, оскільки за цих умов легше виникають центри кристалізації. При визначенні води переохолодження не збільшує похибку. Енергійне та рівномірне перемішування пришвидшує вимірювання.