
- •Лекция 2 статистическая физика
- •9.Функции распределения
- •Основу статистической физики составляет теория вероятностей
- •9.1. Микросостояние. Вероятность. Средние значения
- •9.2. Распределение Максвелла
- •9.3. Распределение молекул по модулям скорости
- •Наиболее вероятной скорости
- •9.4. Формула Максвелла в приведенном виде
- •5.3.5. Распределение по энергиям молекул
- •9.6. Опытная проверка распределения Максвелла
- •9.7. Распределение Больцмана
- •9.8. Барометрическая формула
- •9.9. Распределение Больцмана при дискретных уровнях
- •10.10. Закон распределения Максвелла—Больцмана
9.7. Распределение Больцмана
В отсутствие внешних сил средняя концентрация п молекул газа в состоянии термодинамического равновесия всюду одинакова.
Если же газ находится во внешнем силовом поле, ситуация становится иной.
Рассмотрим, например, поведение молекул газа, находящегося под действием силы тяжести.
Если бы не было теплового движения, то все молекулы «упали» бы на поверхность Земли. Наличие же теплового движения мешает этому.
В результате совместного действия этих двух факторов устанавливается некоторое равновесие, и концентрация молекул становится зависящей от высоты.
Найдем эту зависимость.
Пусть газ находится во внешнем поле потенциальных (консервативных) сил, действующих для простоты в одном направлении и зависящих только от координаты z.
При тепловом равновесии температура Т должна быть одинакова по всей толщине газа, иначе бы возникли потоки тепла, и состояние газа не было бы равновесным.
Д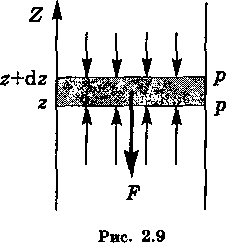 ля
определенности будем считать, что
ля
определенности будем считать, что
силы внешнего поля направлены вниз,
а ось Z — вверх (рис. 10).
Выделим мысленно бесконечно узкий слой газа толщиной dz с площадью основания столба, равной единице (S = 1).
Запишем условие равновесия этого слоя, используя гидростатический подход.
На слой dz действует
- направленная вверх сила, обусловленная разностью давлений dp (dp < 0),
- и сила, действующая вниз со стороны внешнего поля.
При равновесии должно соблюдаться
равенство
![]() (8)
(8)
где
![]() —
проекция внешней силы, действующей
на каждую молекулу.
—
проекция внешней силы, действующей
на каждую молекулу.
Заметим, что левая и правая части этого равенства являются отрицательными.
Из механики известно, что
![]()
где U — потенциальная энергия молекулы во внешнем поле.
Поэтому (8) можно переписать так:
![]() .
.
Будем считать газ идеальным.
Подставим давление из основного уравнения МКТ p = nkT,
продифференцировав, получаем dp = dnkT.
Тогда
![]() ,
или
,
или![]()
Проинтегрировав последнее уравнение,
получим
![]() .
.
Будем считать, что
![]() и
и
![]() ,
,
Тогда
![]() Этот
закон и выражает распределение Больцмана.
Этот
закон и выражает распределение Больцмана.
С помощью распределения Больцмана можно найти число молекул в интересующем нас элементарном объеме dV:
![]()
При этом следует иметь в виду, что объем dV может иметь, вообще говоря, не любую форму. Обязательным является выполнение условия: во всех точках объема dV концентрация n должна быть одинаковой.
Приведенный вывод формулы распределения Больцмана является чисто гидростатическим: в нем мы по сути рассматривали газ как сплошную среду, отвлекаясь от его молекулярной структуры.
Это допустимо лишь для достаточно плотных газов при наличии большого числа столкновений.
Необходимо, чтобы средний свободный пробег молекул между последовательными столкновениями был мал по сравнению с толщиной dz слоя.
Только в этом случае имеет смысл говорить о давлении, которое действует на слой dz со стороны соседних слоев. И тем не менее приведенный вывод привел к верному результату.
9.8. Барометрическая формула
Умножив обе части распределения Больцмана на kT,
получим согласно основному уравнению
МКТ, что давление
![]()
где
![]() —
молярная масса, R — универсальная
газовая постоянная.
—
молярная масса, R — универсальная
газовая постоянная.
Это так называемая барометрическая формула.
О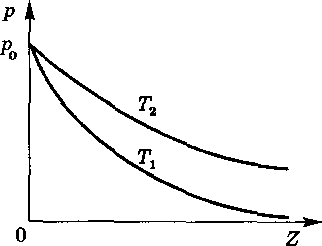 на
строго справедлива для идеального
газа, температура которого не зависит
от высоты (изотермическая атмосфера).
на
строго справедлива для идеального
газа, температура которого не зависит
от высоты (изотермическая атмосфера).
На рис. 11
показаны два графика зависимости
давления от высоты z
при разных температурах
![]() .
Следует обратить внимание на то, что
в отличие от распределений n(z),
кривые p(z)
на рис. 11 начинаются в одной точке
независимо от температуры.
.
Следует обратить внимание на то, что
в отличие от распределений n(z),
кривые p(z)
на рис. 11 начинаются в одной точке
независимо от температуры.
Это не случайно и имеет простое объяснение .
Рис.11
При анализе ситуации, изображенной на рис. 11, мы приходим к выводу, что
в результате повышения температуры
от
![]() до
до
![]() центр масс газа перемещается вверх.
центр масс газа перемещается вверх.
Возникает вопрос: под действием какой внешней силы?
На первый взгляд вроде ничего не
изменилось — ни сила тяжести, ни сила
реакции со стороны поверхности Земли
(ведь давление
![]() осталось прежним).
осталось прежним).
На самом же деле в процессе нагревания газа равновесие нарушается , вторая сила оказывается большей по модулю. Она направлена вверх и вызывает перемещение центра масс.
Представим барометрическую формулу
в виде
![]() ,
,
где
![]() — это высота, на которой давление
убывает в е раз.
— это высота, на которой давление
убывает в е раз.
Значение h играет роль характерной толщины атмосферы.
При = 20 г/моль и Т = 280 К величина h = 8 км.
По сравнению с радиусом Земли атмосфера — тонкая пленочка (что и позволяет при получении барометрической формулы считать ускорение g не зависящим от высоты).
Вычислим число молекул с помощью функции распределения Больцмана.
Возьмем на поверхности Земли площадку с площадью S = 1
и рассмотрим столб воздуха над этой площадкой.
В слое толщиной dz на высоте z находится число молекул
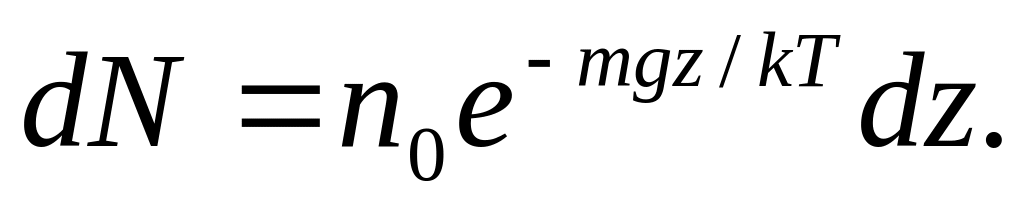
Интегрируя это выражение по z от 0 до ∞, находим полное число молекул N столбе:
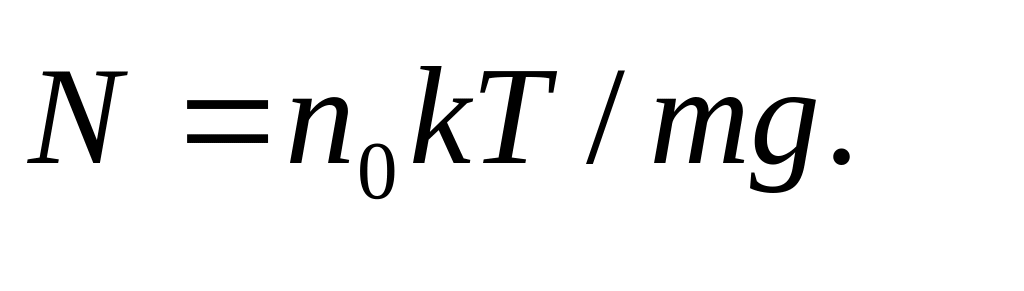
Затем умножим N на массу т одной молекулы и на площадь поверхности Земли
 .
В результате найдем, что масса М
атмосферы
.
В результате найдем, что масса М
атмосферы
![]() .
.
Эту задачу можно решить и проще, рассуждая так.
Поскольку атмосфера Земли в целом находится в равновесии, то можно считать, что сила тяжести, действующая на газ в каждом вертикальном столбе единичного сечения, уравновешивается силой реакции со стороны поверхности Земли, т.е. давлением
![]() (1 атм).
(1 атм).
Умножив на площадь поверхности Земли, получим Mg, где М — искомая масса.
Отсюда М = 5,3 • 1018 кг.
Строго говоря, атмосфера Земли не является равновесной.
Атмосфера непрерывно рассеивается, хотя для Земли этот процесс идет очень медленно. Рассеивание обусловлено тем, что в процессах соударения молекул в верхних слоях атмосферы неизбежно возникают молекулы, скорости которых оказываются больше второй космической. И таким молекулам иногда «удается» без столкновений покинуть атмосферу Земли. За все время существования Земля потеряла очень малую часть своей атмосферы.
Из распределения Больцмана возникает следующий «парадокс»: почему в поле тяжести при движении молекул
вверх их кинетическая энергия уменьшается, а температура остается прежней, т.е. средняя кинетическая энергия не меняется,
а при движении вниз кинетическая энергия всех молекул увеличивается, а средняя их энергия остается той же?
Этот «парадокс» был разъяснен уже Максвеллом. При движении
вверх молекулы действительно замедляются, но при этом наиболее медленные молекулы выбывают из потока частиц.
вниз, наоборот, молекулы не только ускоряются, но одновременно их поток пополняется более медленными молекулами. В результате средняя скорость теплового движения молекул остается неизменной.
Сила тяжести меняет лишь концентрацию молекул на разных высотах, но не температуру газа
. И закон распределения Больцмана как раз и выводится из условия, чтобы температура газа оставалась всюду одной и той же.
