
- •Практикум по физической химии Екатеринбург 2003 г Введение
- •1. Термохимия.
- •1.1. Краткая теория.
- •1.2 Экспериментальная часть.
- •1.2.1. Аппаратура
- •1.2.2. Определение постоянной калориметра.
- •1.3. Лабораторная работа 1. Определение теплоты растворения металлического магния Mg в растворе соляной кислоты hCl.
- •1.4. Лабораторная работа 2. Определение теплоты образования кристаллогидрата сульфата меди CuSo45h2o.
- •2. Термодинамика фазовых переходов.
- •2.1. Краткая теория. Однокомпонентная система.
- •2.2. Лабораторная работа 3. Определение теплоты испарения жидкости динамическим методом
- •3. Гетерогенное химическое равновесие.
- •3.1. Краткая теория
- •3.2. Лабораторная работа 4. Определение константы равновесия и расчет основных термодинамических величин реакций разложения оксидов никеля и кобальта.
- •4. Диаграммы состояния двухкомпонентных систем.
- •4.1. Краткая теория.
- •4.2. Лабораторная работа 5. Построение диаграммы состояния бинарной системы фенол-нафталин.
- •5. Растворы.
- •5.1. Краткая теория
- •5.1. Лабораторная работа 6. Построение диаграммы состояния бинарного раствора.
- •6. Электропроводность растворов электролитов.
- •6.1. Краткая теория
- •6.2. Лабораторная работа 7. Электропроводность растворов электролитов.
- •6.3. Лабораторная работа 8. Числа переноса в растворах электролитов.
- •7. Электрохимическое равновесие электрод-электролит
- •7.1. Краткая теория
- •7.2. Лабораторная работа 9. Измерение электродных потенциалов и эдс гальванических элементов.
- •8. Химическая кинетика
- •8.1. Краткая теория
- •8.2. Лабораторная работа 10. Определение скорости реакции омыления уксусноэтилового эфира.
- •9. Напряжение разложения растворов электролитов. Основы электрохимичесКой кинетиКи
- •9.1. Краткая теория
- •9.2. Лабораторная работа11. Определение напряжения разложения растворов электролитов.
- •Литература
8.2. Лабораторная работа 10. Определение скорости реакции омыления уксусноэтилового эфира.
Аппаратура. Измерение скорости реакции сводится к определению зависимости концентрации вещества участвующего в реакции от времени. Применяемые в кинетике для этой цели методы условно можно разделить на химические и физические. Химические методы дают непосредственно абсолютные значения концентраций, но они менее удобны, т.к. связаны с отбором проб в различные моменты времени, необходимости «замораживания» процесса вследствие долгой аналитической процедуры и т.п. В физических методах анализа измеряется, какое либо физическое свойство реакционной смеси, непосредственно связанное с концентрациями реагирующих веществ и продуктов, изменяющееся в ходе реакции. К таким свойствам можно отнести: давление и объем – для газовых реакций; оптические свойства, электропроводность, вязкость, теплопроводность и др. Преимущество физических методов в их быстроте. Часто такие измерения производятся прямо в реакционном сосуде, так, что отпадает отбор проб и связанные с этой операцией ошибки. Обычно физические измерения никак не влияют на состояние системы. При этом часто можно применять непрерывную автоматическую запись изменения свойства системы. Однако физические методы не дают непосредственно абсолютных значений концентрации. Могут появиться ошибки связанные с переводом значения измеряемого свойства в концентрацию. Например, при спектроскопическом изучении малые количества сильноокрашенных загрязнений или побочных продуктов могут сильно исказить картину. Поэтому для детального изучения кинетики какой-либо реакции полезно применять несколько методов. Если реакция происходит с изменением числа или типа ионов и связана с изменением электрического сопротивления, то за ее ходом можно следить, измеряя электрическое сопротивление раствора.
Например, в ходе реакции омыления этилацетата раствором гидроксида натрия изменяется концентрация ионов ОН–. Так как подвижность иона ОН– значительно больше подвижности ацетат-иона, сопротивление реакционной смеси с течением времени увеличивается, а электропроводность уменьшается.
Удельная электропроводность в начальный момент времени определяет электропроводность раствора щелочи и равна:
![]() (8.9)
(8.9)
где а – начальная концентрация щелочи, а – ее эквивалентная электропроводность. Так как = Na++OH‑, то:
![]() . (8.10)
. (8.10)
Зависимость эквивалентной электропроводности 0,05N раствора щелочи от температуры выражается уравнением:
![]() . (8.11)
. (8.11)
Подставив уравнение (8.11) в уравнение (8.10), и решив последнее относительно а, получим:
![]() (8.12)
(8.12)
Удельная электропроводность в данный момент реакции равна:
![]() . (8.13)
. (8.13)
Из уравнений (8.9) и (8.13) следует, что:
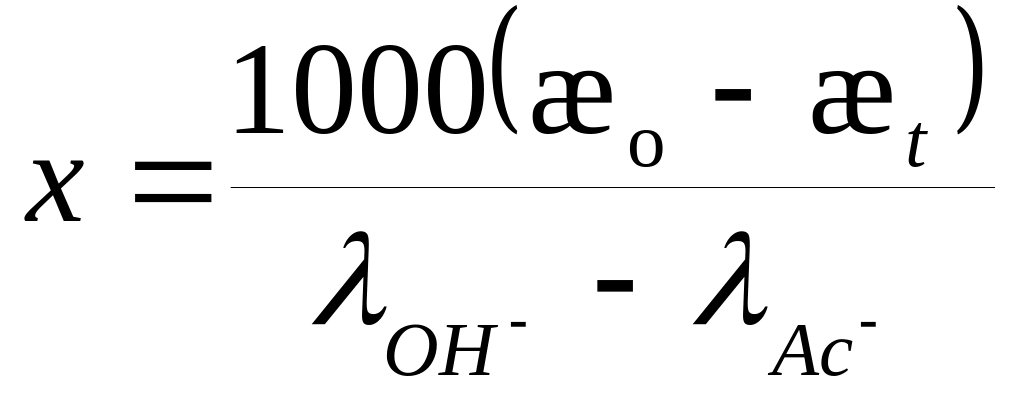 (8.14)
(8.14)
Считая, что разность (OH‑ ‑ Ac-) неизменна в течение реакции и приблизительно равна 139[1+0.0165(T-18)], получим:
![]() (8.15)
(8.15)
Так как начальная концентрация эфира b равна концентрации ионов Ac‑, образовавшихся к концу реакции, то из уравнения (8.14) следует, что:
![]() (8.16)
(8.16)
Определив на опыте æ0, æt, æ, по приведенным выше уравнениям (8.12), (8.15), (8.16) рассчитывают начальные концентрации щелочи и эфира, а также количество щелочи и эфира, израсходованные к моменту времени t и к моменту полного завершения реакции (t = ). Значение æ получают путем измерения электропроводности раствора после проведения реакции в термостате при 80oС в течение 1 часа, с последующим охлаждением раствора.
Приборы и реактивы
1. Мост переменного тока Р5010 |
7. Реакционный сосуд – колба на 100 мл |
2. Ячейка для определения электропроводности жидких веществ (растворов) |
8. Сосуд для определения электропроводности – химический стакан на 50 мл |
3. Мерная колба на 50 мл |
9. Бюретка на 25 мл |
4. Пипетки на 25 мл |
10. Раствор KCl 0,1 N (фиксанал) |
5. Раствор NaOH ~ 0,1N |
11. Водный раствор CH3COOC2H5 ~ 0,1N |
6. Раствор HCl 0,1 N или H2SO4 0,1 N (фиксанал) |
|
Порядок выполнения работы
Определение постоянной ячейки для измерения электропроводности. В сосуд для измерения электропроводности наливают 25 мл 0,1 N раствора KСl, опускают туда ячейку с электродами, следя за тем, чтобы раствор полностью покрыл электроды и считывают значение сопротивления с индикатора моста переменного тока. Измерения проводят не менее 3-х раз. (Результаты вносят в таблицу 8.1, см. ниже)
Определение электропроводности исходного раствора щелочи. Из 0,1 N раствора щелочи готовят 0,05 N раствор разбавлением 25 мл 0,1 N раствора в мерной колбе объемом 50 мл. Сосуд и ячейку для измерения электропроводности ополаскивают дистиллированной водой, а затем дважды 0,05 N раствором щелочи. После этого наливают в ячейку исследуемый раствор и определяют электропроводность. (Результаты вносят в таблицу 8.2, (см. ниже)).
Измерение электропроводности реакционной смеси. 0,1 N раствор щелочи объемом 25 мл смешивают с равным объемом раствора эфира в мерной колбе, и с этого момента ведут отсчет времени реакции. Небольшим количеством полученной смеси ополаскивают предварительно промытый в дистиллированной воде стакан, заливают в него реакционный раствор и опускают в него чистую ячейку для измерения электропроводности. Все эти операции следует проводить по возможности быстро. Электропроводность (æt) измеряют через 5, 10, 15, 25, 40, и 60 минут после начала реакции. (Результаты вносят в таблицу 8.2, (см. ниже)). Одновременно с этими измерениями оставшуюся смесь в течение часа нагревают на водяной бане с обратным холодильником при 80–900С. Затем смесь охлаждают до комнатной температуры. Промыв дважды этой смесью сосуд для измерения электропроводности наливают ее в сосуд и определяют электропроводность (æ). (Результаты вносят в таблицу 8.2, (см. ниже))
Определение концентрации раствора NaOH. Также одновременно с выполнением опыта, описанного в предыдущем абзаце, проводят определение концентрации раствора NaOH. Берут аликвоту 10 мл HCl 0,1 N или H2SO4 0,1 N, приготовленной из фиксанала и титруют раствором гидроксида натрия в присутствии индикатора метилового оранжевого. Из результатов титрования определяют нормальность раствора щелочи.
Обработка результатов эксперимента
Постоянная сосуда для измерения электропроводности рассчитывается по формуле:
K= æR, (8.17)
где æ удельная электропроводность 0,1 N раствора KCl, R сопротивление 0,1 N раствора KCl. Значения æ для разных температур приведены в справочной литературе.
Значения æ0, æt, æ рассчитывают по формуле:
![]() (8.18)
(8.18)
где R – сопротивление соответствующего раствора.
Начальные концентрации щелочи и эфира рассчитывают соответственно по формулам (8.11) и (8.15), а количество щелочи и эфира израсходованных к моменту времени t – по формуле (8.14). По формуле (8.16) определяют константу скорости исследуемой реакции для каждого момента времени t. Затем находят среднее значение константы скорости. (Результаты расчетов вносят в таблицу 2, (см. ниже)).
Таблица 8.1. Расчет постоянной ячейки для измерения электропроводности.
T= _____ o C |
|
æ 0.1 N р-ра KCl =______ Oм-1 cм-1 |
|
№ опыта |
R (изм), Ом |
æ, Oм-1cм-1 |
К |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
Таблица 8.2. Расчет константы скорости исследуемой реакции.
T =_______ o C |
æо=________ Oм-1cм-1 |
a = ________ моль/л |
b = _____ моль/л |
t, мин от начала опыта |
R (изм), Ом |
æ, Oм-1cм-1 |
х, моль/л |
0 |
|
|
|
5 |
|
|
|
10 |
|
|
|
15 |
|
|
|
25 |
|
|
|
40 |
|
|
|
60 |
|
|
|
|
|
|
|
